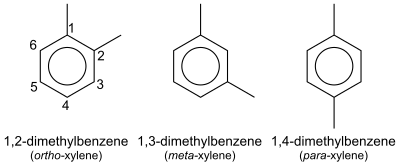
Xileno
En química orgánica, xileno o xilol (del griego ξύλον (xylon) 'madera& #39;; Nombre IUPAC: dimetilbenceno) son cualquiera de los tres compuestos orgánicos con la fórmula (CH3< /sub>)2C6H4. Se derivan de la sustitución de dos átomos de hidrógeno con grupos metilo en un anillo de benceno; qué hidrógenos se sustituyen determina cuál de los tres isómeros estructurales resulta. Es un líquido incoloro, inflamable, ligeramente graso, de gran valor industrial.
La mezcla se denomina xileno y, más precisamente, xilenos. Xilenos mixtos se refiere a una mezcla de xilenos más etilbenceno. Los cuatro compuestos tienen fórmulas empíricas idénticas C8H10. Normalmente, los cuatro compuestos se producen juntos mediante varios métodos de reformado catalítico y pirólisis.
Ocurrencia y producción
Los xilenos son un importante producto petroquímico producido por reformado catalítico y también por carbonización del carbón en la fabricación de combustible de coque. También se encuentran en el petróleo crudo en concentraciones de aproximadamente 0,5 a 1 %, según la fuente. Pequeñas cantidades se encuentran en la gasolina y los combustibles para aeronaves.
Los xilenos se producen principalmente como parte de los compuestos aromáticos de BTX (benceno, tolueno y xilenos) extraídos del producto del reformado catalítico conocido como reformado.
Varios millones de toneladas se producen anualmente. En 2011, un consorcio global comenzó la construcción de una de las plantas de xileno más grandes del mundo en Singapur.
Historia
El xileno fue aislado y nombrado por primera vez en 1850 por el químico francés Auguste Cahours (1813–1891), después de haber sido descubierto como componente del alquitrán de madera.
Producción industrial
Los xilenos se producen por la metilación del tolueno y el benceno. El xileno de grado comercial o de laboratorio que se produce generalmente contiene alrededor de 40 a 65 % de m-xileno y hasta un 20 % de cada uno de o-xileno, p-xileno y etilbenceno. La proporción de isómeros se puede modificar para favorecer el valorado p-xileno mediante el proceso patentado UOP-Isomar o mediante la transalquilación del xileno consigo mismo o con trimetilbenceno. Estas conversiones son catalizadas por zeolitas.
ZSM-5 se utiliza para facilitar algunas reacciones de isomerización que conducen a la producción en masa de plásticos modernos.
Propiedades
Las propiedades físicas de los isómeros de xileno difieren ligeramente. El punto de fusión oscila entre −47,87 °C (−54,17 °F) (m-xileno) y 13,26 °C (55,87 °F) (p-xileno), como Por lo general, el punto de fusión del isómero para es mucho más alto porque se empaqueta más fácilmente en la estructura cristalina. El punto de ebullición de cada isómero es de alrededor de 140 °C (284 °F). La densidad de cada isómero es de alrededor de 0,87 g/mL (7,26 lb/galón estadounidense o 8,72 lb/galón imp) y, por lo tanto, es menos denso que el agua. El olor a xileno es detectable en concentraciones tan bajas como 0,08 a 3,7 ppm (partes de xileno por millón de partes de aire) y se puede degustar en agua a 0,53 a 1,8 ppm.
Los xilenos forman azeótropos con agua y una variedad de alcoholes. El azeótropo con agua consta de un 60 % de xilenos y hierve a 94,5 °C. Al igual que con muchos compuestos de alquilbenceno, los xilenos forman complejos con varios halocarbonos. Los complejos de diferentes isómeros a menudo tienen propiedades dramáticamente diferentes entre sí.
Aplicaciones
Ácido tereftálico y derivados relacionados
p-Xileno es el principal precursor del ácido tereftálico y el tereftalato de dimetilo, ambos monómeros utilizados en la producción de botellas de plástico de tereftalato de polietileno (PET) y ropa de poliéster. El 98% de la producción de p-xileno y la mitad de todos los xilenos producidos se consume de esta manera. El o-xileno es un importante precursor del anhídrido ftálico. La demanda de ácido isoftálico es relativamente modesta, por lo que rara vez se busca m-xileno (y de ahí la utilidad de su conversión en o- y p-isómeros).
Aplicaciones de disolventes y fines industriales
Los xilenos se utilizan como solventes en las industrias de impresión, caucho y cuero. Es un componente común de la tinta, el caucho y los adhesivos. Al diluir pinturas y barnices, se puede sustituir por tolueno cuando se desea un secado más lento y, por lo tanto, los conservadores de objetos de arte lo utilizan en las pruebas de solubilidad. De manera similar, es un agente de limpieza, por ejemplo, para acero, obleas de silicio y circuitos integrados. En odontología, el xileno se puede utilizar para disolver la gutapercha, un material utilizado para endodoncia (tratamientos de conducto). En la industria del petróleo, el xileno también es un componente frecuente de los solventes de parafina, que se usa cuando la tubería se obstruye con cera de parafina.
Uso de laboratorio
El xileno se usa en el laboratorio para hacer baños con hielo seco para enfriar los recipientes de reacción y como solvente para eliminar el aceite de inmersión sintético del objetivo del microscopio en microscopía óptica. En histología, el xileno es el agente aclarante más utilizado. El xileno se utiliza para eliminar la parafina de los portaobjetos de microscopio secos antes de la tinción. Después de la tinción, los portaobjetos de microscopio se colocan en xileno antes de montarlos con un cubreobjetos.
Precursor de otros compuestos
En una aplicación a gran escala, el paraxileno se convierte en ácido tereftálico. La principal aplicación del ortoxileno es como precursor de los ésteres de ftalatos, utilizados como plastificantes. El metaxileno se convierte en derivados del ácido isoftálico, que son componentes de las resinas alquídicas.
Propiedades químicas
Por lo general, ocurren dos tipos de reacciones con los xilenos: las que involucran los grupos metilo y las que involucran los enlaces C-H del anillo. Al ser bencílicos y, por lo tanto, debilitados, los enlaces C-H de los grupos metilo son susceptibles a reacciones de radicales libres, incluida la halogenación a los correspondientes dicloruros de xileno (bis(clorometil)bencenos), mientras que la monobromación produce bromuro de xililo, un agente de gas lacrimógeno.. La oxidación y la amoxidación también se dirigen a los grupos metilo, proporcionando ácidos dicarboxílicos y dinitrilos. Los electrófilos atacan el anillo aromático, dando lugar a cloro y nitroxilenos.
Salud y seguridad
El xileno es inflamable pero tiene una toxicidad aguda modesta, con rangos de LD50 de 200 a 5000 mg/kg para animales. La LD50 oral para ratas es de 4300 mg/kg. El principal mecanismo de desintoxicación es la oxidación a ácido metilbenzoico y la hidroxilación a hidroxileno.
El principal efecto de la inhalación de vapor de xileno es la depresión del sistema nervioso central (SNC), con síntomas como dolor de cabeza, mareos, náuseas y vómitos. A una exposición de 100 ppm, uno puede experimentar náuseas o dolor de cabeza. A una exposición entre 200 y 500 ppm, los síntomas pueden incluir sensación de 'colocación', mareos, debilidad, irritabilidad, vómitos y tiempo de reacción lento.
Los efectos secundarios de la exposición a bajas concentraciones de xileno (< 200 ppm) son reversibles y no causan daños permanentes. La exposición a largo plazo puede provocar dolores de cabeza, irritabilidad, depresión, insomnio, agitación, cansancio extremo, temblores, pérdida de la audición, problemas de concentración y pérdida de la memoria a corto plazo. Una condición llamada encefalopatía crónica inducida por solventes, comúnmente conocida como "síndrome de solventes orgánicos" se ha asociado con la exposición al xileno. Hay muy poca información disponible que aísle el xileno de otras exposiciones a solventes en el examen de estos efectos.
Los trastornos auditivos también se han relacionado con la exposición al xileno, tanto en estudios con animales de experimentación como en estudios clínicos.
El xileno también irrita la piel y la despoja de sus aceites, haciéndola más permeable a otras sustancias químicas. Se recomienda el uso de guantes y máscaras impermeables, junto con respiradores cuando corresponda, para evitar problemas de salud ocupacional por la exposición al xileno.
Los xilenos se metabolizan a ácidos metilhipúricos. La presencia de ácido metilhipúrico se puede utilizar como biomarcador para determinar la exposición al xileno.
Contenido relacionado
Rotación óptica
Ketoprofeno
Yeso