Virus de la hepatitis C
El virus de la hepatitis C (VHC) es un virus de ARN monocatenario pequeño (de 55 a 65 nm de tamaño), envuelto y de sentido positivo de la familia < i>Flaviviridae. El virus de la hepatitis C es la causa de la hepatitis C y de algunos cánceres como el cáncer de hígado (carcinoma hepatocelular, abreviado HCC) y los linfomas en humanos.
Taxonomía
El virus de la hepatitis C pertenece al género Hepacivirus, un miembro de la familia Flaviviridae. Antes de 2011, se consideraba el único miembro de este género. Sin embargo, se ha descubierto un miembro de este género en perros: el hepacivirus canino. También hay al menos un virus de este género que infecta a los caballos. Se han descrito varios virus adicionales del género en murciélagos y roedores.
Estructura

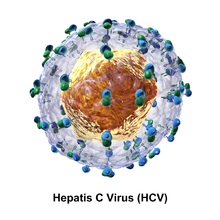
La partícula del virus de la hepatitis C consta de una envoltura de membrana lipídica que tiene entre 55 y 65 nm de diámetro. Dos glicoproteínas de la envoltura viral, E1 y E2, están incrustadas en la envoltura lipídica. Participan en la unión viral y la entrada a la célula. Dentro de la envoltura hay un núcleo icosaédrico de 33 a 40 nm de diámetro. Dentro del núcleo se encuentra el material de ARN del virus.
Glicoproteínas E1 y E2
E1 y E2 se unen covalentemente cuando se incrustan en la envoltura del VHC y se estabilizan mediante enlaces disulfuro. E2 es globular y parece sobresalir 6 nm de la membrana envolvente según las imágenes del microscopio electrónico.
Estas glicoproteínas desempeñan un papel importante en las interacciones que tiene la hepatitis C con el sistema inmunológico. Una región hipervariable, la región hipervariable 1 (HVR1), se puede encontrar en la glicoproteína E2. HVR1 es flexible y bastante accesible para las moléculas circundantes. HVR1 ayuda a E2 a proteger el virus del sistema inmunológico. Impide que CD81 se adhiera a su respectivo receptor del virus. Además, E2 puede proteger a E1 del sistema inmunológico. Aunque HVR1 es bastante variable en la secuencia de aminoácidos, esta región tiene características químicas, físicas y conformacionales similares en muchas glicoproteínas E2.
Genoma

El virus de la hepatitis C tiene un genoma de ARN monocatenario de sentido positivo. El genoma consta de un único marco de lectura abierto de 9.600 bases de nucleótidos de longitud. Este único marco de lectura abierto se traduce para producir un único producto proteico, que luego se procesa adicionalmente para producir proteínas activas más pequeñas. Por este motivo, en bases de datos disponibles públicamente, como la del Instituto Europeo de Bioinformática, el proteoma viral sólo consta de 2 proteínas.
En los extremos 5′ y 3′ del ARN se encuentran las regiones no traducidas (UTR), que no se traducen en proteínas pero que son importantes para la traducción y replicación del ARN viral. La 5' UTR tiene un sitio de unión a ribosomas o sitio de entrada a ribosomas interno (IRES) que inicia la traducción de una proteína muy larga que contiene aproximadamente 3000 aminoácidos. El dominio central del HCV IRES contiene una unión Holliday helicoidal de cuatro vías que está integrada dentro de un pseudonudo previsto. La conformación de este dominio central limita la orientación del marco de lectura abierto para su posicionamiento en la subunidad ribosómica 40S. La preproteína grande es luego escindida por proteasas celulares y virales en 10 proteínas más pequeñas que permiten la replicación viral dentro de la célula huésped, o se ensamblan en partículas virales maduras. Las proteínas estructurales producidas por el virus de la hepatitis C incluyen la proteína Core, E1 y E2; Las proteínas no estructurales incluyen NS2, NS3, NS4A, NS4B, NS5A y NS5B.
Biología molecular
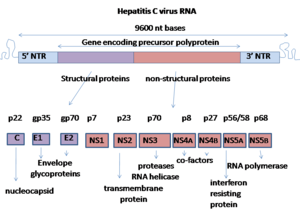
Las proteínas de este virus están dispuestas a lo largo del genoma en el siguiente orden: N terminal-núcleo-envoltura (E1)–E2–p7-proteína no estructural 2 (NS2)–NS3–NS4A–NS4B–NS5A–NS5B–C Terminal. La generación de proteínas no estructurales maduras (NS2 a NS5B) depende de la actividad de las proteinasas virales. La unión NS2/NS3 es escindida por una proteinasa autocatalítica dependiente de metales codificada dentro de NS2 y el extremo N de NS3. Las escisiones restantes aguas abajo de este sitio son catalizadas por una serina proteasa también contenida en la región N-terminal de NS3.
- La proteína central tiene 191 aminoácidos y puede dividirse en tres dominios sobre la base de la hidrofobia: el dominio 1 (residuos 1–117) contiene principalmente residuos básicos con dos regiones hidrofóbicas cortas; el dominio 2 (residuos 118–174) es menos básico y más hidrofóbico y su C-terminus está al final de p21; el dominio 3 (residuos 175–191) es altamente hidrofóbico y actúa como secuencia de señal para la proteína de sobre E1.
- Ambas proteínas de sobre (E1 y E2) son altamente glicosiladas e importantes en la entrada celular. E1 sirve como la subunidad fusógena y E2 actúa como la proteína de unión receptor. E1 tiene glicánticos de 4 a 5 N y E2 tiene 11 sitios de glucosilación N.
- La proteína NS1 (p7) es prescindible para la replicación del genoma viral, pero desempeña un papel crítico en la morfogénesis del virus. Esta proteína es una proteína de membrana de 63 aminoácidos que se localiza en el reticulum endoplasmático. Cleavage de p7 es mediado por la señal peptidases del reticulum endoplasmático. Dos dominios transmembrane de p7 están conectados por un bucle citoplasmático y están orientados hacia el lumen del reticulum endoplasmático.
- La proteína NS2 es una proteína transmembrana de 21–23 kilodalton (kDa) con actividad proteasa.
- NS3 es una proteína de 67 kDa cuyo N-terminal tiene actividad de proteasa serina y cuyo C-terminal tiene NTPase/helicase actividad. Se encuentra dentro del reticulum endoplasmático y forma un complejo heterodimérico con NS4A—una proteína de membrana de 54 aminoácidos que actúa como cofactor de la proteinasa.
- NS4A—una proteína de membrana de 54 aminoácidos que actúa como cofactor de la proteinasa.
- NS4B es una proteína integral hidrofóbica pequeña (27 kDa) con cuatro dominios transmembranos. Se encuentra dentro del reticulum endoplasmático y desempeña un papel importante para el reclutamiento de otras proteínas virales. Induce cambios morfológicos al reticulum endoplasmático formando una estructura llamada la tela membranosa.
- NS5A es una fosfoproteína hidrofílica que desempeña un papel importante en la replicación viral, modulación de las vías de señalización celular y la respuesta interferón. Se sabe que se une a las proteínas de VAP humano de reticulum endoplasmática.
- La proteína NS5B (65 kDa) es la polimerasa ARN dependiente viral. NS5B tiene la función clave de replicar el ARN viral del HCV utilizando el hilo de ARN de sentido positivo viral como su plantilla y cataliza la polimerización de triphosfatos ribonucleoside (rNTP) durante la replicación del ARN. Se han determinado varias estructuras de cristal de polimerasa NS5B en varias formas cristalinas basadas en la misma secuencia de consenso BK (HCV-BK, genotipo 1). La estructura puede ser representada por una forma de mano derecha con dedos, palma y pulgar. El sitio activo rodeado, único a NS5B, está contenido en la estructura de la palma de la proteína. Estudios recientes sobre el genotipo de proteína NS5B 1b de la estructura J4 (HC-J4) indican una presencia de un sitio activo donde se produce el posible control de la unión de nucleótido e iniciación de la síntesis de RNA de-novo. De-novo añade las imprimaciones necesarias para el inicio de la replicación del ARN. Las investigaciones actuales intentan vincular estructuras a este sitio activo para alterar su funcionalidad con el fin de evitar la replicación del ARN viral.
También se ha descrito una undécima proteína. Esta proteína está codificada por un desplazamiento de marco +1 en el gen de la cápside. Parece ser antigénico pero se desconoce su función.
Replicación

La replicación del VHC implica varios pasos. El virus se replica principalmente en los hepatocitos del hígado, donde se estima que diariamente cada célula infectada produce aproximadamente cincuenta viriones (partículas de virus) con un total calculado de un billón de viriones generados. El virus también puede replicarse en células mononucleares de sangre periférica, lo que podría explicar los altos niveles de trastornos inmunológicos encontrados en pacientes con infección crónica por VHC. En el hígado, las partículas del VHC llegan a los sinusoides hepáticos mediante el flujo sanguíneo. Estos sinusoides se encuentran junto a las células de hepatocitos. El VHC puede atravesar el endotelio de los sinusoides y llegar a la superficie basolateral de las células de los hepatocitos.
El VHC tiene una amplia variedad de genotipos y muta rápidamente debido a una alta tasa de error por parte del virus. ARN polimerasa dependiente de ARN. La tasa de mutación produce tantas variantes del virus que se considera una cuasiespecie en lugar de una especie de virus convencional. La entrada a las células huésped se produce mediante interacciones complejas entre los viriones, especialmente a través de sus glicoproteínas, y las moléculas de la superficie celular CD81, receptor de LDL, SR-BI, DC-SIGN, Claudin-1 y Occludin.
La envoltura del VHC es similar a las lipoproteínas de muy baja densidad (VLDL) y a las lipoproteínas de baja densidad (LDL). Debido a esta similitud, se cree que el virus puede asociarse con apolipoproteínas. Podría rodearse de lipoproteínas, cubriendo parcialmente E1 y E2. Investigaciones recientes indican que estas apolipoproteínas interactúan con el receptor carroñero B1 (SR-B1). SR-B1 puede eliminar los lípidos de las lipoproteínas alrededor del virus para permitir mejor el contacto con HVR1. Claudina 1, que es una proteína de unión estrecha, y CD81 se unen para crear un complejo, preparándolos para procesos posteriores de infección por VHC. A medida que se activa el sistema inmunológico, los macrófagos aumentan la cantidad de TNF-α alrededor de los hepatocitos que están siendo infectados. Esto desencadena la migración de ocludina, que es otro complejo de unión estrecha, a la membrana basolateral. La partícula de VHC está lista para ingresar a la célula.
Estas interacciones conducen a la endocitosis de la partícula viral. Este proceso es ayudado por las proteínas clatrina. Una vez dentro de un endosoma temprano, el endosoma y la envoltura viral se fusionan y el ARN ingresa al citoplasma.
El VHC se hace cargo de partes de la maquinaria intracelular para replicarse. El genoma del VHC se traduce para producir una única proteína de alrededor de 3.011 aminoácidos. Luego, la poliproteína es procesada proteolíticamente por proteasas virales y celulares para producir tres proteínas estructurales (asociadas a viriones) y siete no estructurales (NS). Alternativamente, puede ocurrir un cambio de marco en la región central para producir una proteína de marco de lectura alternativo (ARFP). El VHC codifica dos proteasas, la cisteína autoproteasa NS2 y la serina proteasa NS3-4A. Luego, las proteínas NS reclutan el genoma viral en un complejo de replicación de ARN, que está asociado con membranas citoplasmáticas reordenadas. La replicación del ARN tiene lugar a través de la ARN polimerasa NS5B dependiente de ARN viral, que produce un intermediario de ARN de cadena negativa. El ARN de cadena negativa sirve luego como plantilla para la producción de nuevos genomas virales de cadena positiva. Los genomas nacientes pueden luego traducirse, replicarse o empaquetarse dentro de nuevas partículas virales.
El virus se replica en las membranas lipídicas intracelulares. El retículo endoplásmico, en particular, se deforma en estructuras de membrana con formas únicas denominadas "redes membranosas". Estas estructuras pueden inducirse mediante la expresión exclusiva de la proteína viral NS4B. La proteína central se asocia con gotitas de lípidos y utiliza microtúbulos y dineínas para alterar su ubicación en una distribución perinuclear. La liberación desde el hepatocito puede implicar la vía secretora de VLDL. Otra hipótesis afirma que la partícula viral puede secretarse desde el retículo endoplásmico a través de la vía del complejo de clasificación endosómica necesaria para el transporte (ESCRT). Esta vía normalmente se utiliza para hacer brotar vesículas fuera de la célula. La única limitación de esta hipótesis es que la vía se utiliza normalmente para la gemación celular y no se sabe cómo el VHC controlaría la vía ESCRT para su uso con el retículo endoplásmico.
Genotipos
Según las diferencias genéticas entre los aislados del VHC, la especie del virus de la hepatitis C se clasifica en seis genotipos (1 a 6) con varios subtipos dentro de cada genotipo (representados por letras minúsculas). Los subtipos se dividen además en cuasiespecies según su diversidad genética. Los genotipos difieren entre un 30% y un 35% de los sitios de nucleótidos en todo el genoma. La diferencia en la composición genómica de los subtipos de un genotipo suele ser del 20 al 25%. Los subtipos 1a y 1b se encuentran en todo el mundo y causan el 60% de todos los casos.
Importancia clínica
El genotipo es clínicamente importante para determinar la respuesta potencial a la terapia basada en interferón y la duración requerida de dicha terapia. Los genotipos 1 y 4 responden menos al tratamiento con interferón que los otros genotipos (2, 3, 5 y 6). La duración de la terapia estándar basada en interferón para los genotipos 1 y 4 es de 48 semanas, mientras que el tratamiento para los genotipos 2 y 3 se completa en 24 semanas. Se producen respuestas virológicas sostenidas en el 70% de los casos de genotipo 1, ~90% de los genotipos 2 y 3, ~65% de los genotipos 4 y ~80% de los genotipos 6. Además, las personas de ascendencia africana tienen muchas menos probabilidades de responder al tratamiento. cuando se infecta con los genotipos 1 o 4. Se propone que una proporción sustancial de esta falta de respuesta al tratamiento es causada por un polimorfismo de un solo nucleótido (SNP) en el cromosoma 19 del genoma humano que predice el éxito del tratamiento. Los genotipos 1 y 4 del VHC se han distribuido endémicamente en áreas superpuestas de África occidental y central, infectando durante siglos a poblaciones humanas portadoras del polimorfismo genético en cuestión. Esto ha llevado a los científicos a sugerir que la persistencia prolongada de los genotipos 1 y 4 del VHC en personas de origen africano es una adaptación evolutiva del VHC a lo largo de muchos siglos a las respuestas inmunogenéticas de estas poblaciones.
La infección con un genotipo no confiere inmunidad contra otros y es posible la infección simultánea con dos cepas. En la mayoría de estos casos, una de las cepas supera a la otra en poco tiempo. Este hallazgo puede ser útil en el tratamiento, al reemplazar las cepas que no responden a la medicación por otras más fáciles de tratar.
Recombinación
Cuando dos virus infectan la misma célula, puede ocurrir una recombinación genética. Aunque poco frecuente, se ha observado recombinación del VHC entre diferentes genotipos, entre subtipos de un mismo genotipo e incluso entre cepas de un mismo subtipo.
Epidemiología
El virus de la hepatitis C es predominantemente un virus transmitido por la sangre, con un riesgo muy bajo de transmisión sexual o vertical. Debido a esta forma de propagación, los grupos clave en riesgo son los usuarios de drogas intravenosas (UDI), los receptores de hemoderivados y, a veces, los pacientes en hemodiálisis. El entorno común de transmisión del VHC también es la transmisión intrahospitalaria (nosocomial), cuando las prácticas de higiene y esterilización no se siguen correctamente en la clínica. Se han propuesto varias prácticas culturales o rituales como posible modo histórico de propagación del VHC, entre ellas la circuncisión, la mutilación genital, la escarificación ritual, los tatuajes tradicionales y la acupuntura. También se ha argumentado que, dados los períodos extremadamente prolongados de persistencia del VHC en humanos, incluso tasas muy bajas e indetectables de transmisión mecánica a través de insectos que pican pueden ser suficientes para mantener la infección endémica en los trópicos, donde las personas reciben un gran número de picaduras de insectos.
Evolución
La identificación del origen de este virus ha sido difícil, pero los genotipos 1 y 4 parecen compartir un origen común. Un análisis bayesiano sugiere que los principales genotipos divergieron hace unos 300 a 400 años del virus ancestro común. Los genotipos menores divergieron hace unos 200 años de sus genotipos principales. Todos los genotipos existentes parecen haber evolucionado a partir del genotipo 1 subtipo 1b.
Un estudio de las cepas del genotipo 6 sugiere una fecha de evolución anterior: aproximadamente entre 1.100 y 1.350 años antes del presente. La tasa estimada de mutación fue 1,8 × 10−4. Un estudio experimental estimó la tasa de mutación en 2,5–2,9 × 10−3 sustituciones de bases por sitio por año. Este genotipo puede ser el antepasado de los otros genotipos.
Un estudio de aislamientos europeos, estadounidenses y japoneses sugirió que la fecha de origen del genotipo 1b fue aproximadamente en el año 1925. Las fechas estimadas de origen de los tipos 2a y 3a fueron 1917 y 1943 respectivamente. Se estimó que el tiempo de divergencia de los tipos 1a y 1b era de 200 a 300 años.
Un estudio de los genotipos 1a y 1b estimó que las fechas de origen eran 1914-1930 para el tipo 1a y 1911-1944 para el tipo 1b. Ambos tipos 1a y 1b experimentaron expansiones masivas en su tamaño poblacional efectivo entre 1940 y 1960. La expansión del subtipo 1b del VHC precedió a la del subtipo 1a en al menos 16 años. Ambos tipos parecen haberse extendido del mundo desarrollado al mundo en desarrollo.
Las cepas del genotipo 2 de África se pueden dividir en cuatro clados que se correlacionan con su país de origen: (1) Camerún y República Centroafricana (2) Benin, Ghana y Burkina Faso (3) Gambia, Guinea, Guinea-Bissau y Senegal (4) Madagascar. También hay pruebas sólidas de la diseminación del genotipo 2 del VHC desde África occidental al Caribe mediante la trata transatlántica de esclavos.
Se cree que el genotipo 3 tiene su origen en el sudeste asiático.
Estas fechas de estos distintos países sugieren que este virus puede haber evolucionado en el sudeste asiático y haber sido propagado a África occidental por comerciantes de Europa occidental. Posteriormente se introdujo en Japón una vez que se levantó el aislamiento autoimpuesto de ese país. Una vez introducido en un país, su propagación se ve influida por muchos factores locales, incluidas las transfusiones de sangre, los programas de vacunación, el uso de drogas intravenosas y los regímenes de tratamiento. Dada la reducción en la tasa de propagación una vez que se implementó la detección del VHC en los productos sanguíneos en la década de 1990, parecería que anteriormente la transfusión de sangre era un método importante de propagación. Se requiere trabajo adicional para determinar las fechas de evolución de los distintos genotipos y el momento de su propagación por todo el mundo.
Vacunación
A diferencia de la hepatitis A y B, actualmente no existe ninguna vacuna para prevenir la infección por hepatitis C.
Investigación actual
El estudio del VHC se ha visto obstaculizado por el estrecho rango de huéspedes del VHC. El uso de replicones ha tenido éxito, pero se han descubierto recientemente. El VHC, como ocurre con la mayoría de los virus de ARN, existe como una cuasiespecie viral, lo que hace muy difícil aislar una sola cepa o tipo de receptor para su estudio.
La investigación actual se centra en inhibidores de moléculas pequeñas de la proteasa viral, la ARN polimerasa y otros genes no estructurales. Dos agentes (boceprevir de Merck y telaprevir de Vertex Pharmaceuticals), ambos inhibidores de la proteasa NS3, fueron aprobados para su uso el 13 de mayo de 2011 y el 23 de mayo de 2011, respectivamente.
Se ha informado de una posible asociación entre niveles bajos de vitamina D y una mala respuesta al tratamiento. El trabajo in vitro ha demostrado que la vitamina D puede reducir la replicación viral. Si bien este trabajo parece prometedor, los resultados de los ensayos clínicos están pendientes. Sin embargo, se ha propuesto que la suplementación con vitamina D es importante además del tratamiento estándar, para mejorar la respuesta al tratamiento.
Se ha demostrado que la naringenina, un flavonoide que se encuentra en la toronja y otras frutas y hierbas, bloquea el ensamblaje de partículas virales infecciosas intracelulares sin afectar los niveles intracelulares del ARN o la proteína viral.
Otros agentes que están bajo investigación incluyen inhibidores de nucleósidos y análogos de nucleótidos e inhibidores no nucleósidos de la ARN polimerasa dependiente de ARN, inhibidores de NSP5A y compuestos dirigidos al huésped como inhibidores de ciclofilina y silibinina.
El sofosbuvir para su uso contra la infección crónica por hepatitis C fue aprobado por la FDA el 6 de diciembre de 2013. Se ha informado que es el primer fármaco que ha demostrado seguridad y eficacia para tratar ciertos tipos de infección por VHC sin necesidad de co- administración de interferón. El 22 de noviembre, la FDA aprobó el uso de simeprevir en combinación con peginterferón alfa y ribavirina. Simeprevir ha sido aprobado en Japón para el tratamiento de la infección crónica por hepatitis C, genotipo 1.
También hay investigaciones experimentales actuales sobre terapias no relacionadas con medicamentos. La oximatrina, por ejemplo, es un extracto de raíz que se encuentra en el continente asiático y que, en cultivos celulares y estudios con animales, se ha informado que tiene actividad antiviral contra el VHC. Pequeños y prometedores ensayos en humanos han mostrado resultados beneficiosos y sin efectos secundarios graves, pero eran demasiado pequeños para generalizar conclusiones.
El 5 de octubre de 2020, se anunció que Harvey J. Alter, Michael Houghton y Charles M. Rice habían recibido el Premio Nobel de Fisiología o Medicina 2020 por el descubrimiento del VHC.
Contenido relacionado
Ley de Fick
Precisión y exactitud
Evidencia empírica