Vector viral

Los vectores virales son virus modificados diseñados para introducir material genético en las células. Este proceso puede realizarse dentro de un organismo o en un cultivo celular. Los vectores virales tienen aplicaciones generalizadas en la investigación básica, la agricultura y la medicina.
Los virus han desarrollado mecanismos moleculares especializados para transportar sus genomas a huéspedes infectados, un proceso denominado transducción. Esta capacidad se ha aprovechado para su uso como vectores virales, que pueden integrar su carga genética (el transgén) en el genoma del huésped, aunque también se utilizan habitualmente vectores no integrativos. Además de en la agricultura y la investigación de laboratorio, los vectores virales se aplican ampliamente en la terapia génica: a partir de 2022, todas las terapias génicas aprobadas se basaban en vectores virales. Además, en comparación con las vacunas tradicionales, la expresión intracelular de antígenos que permiten las vacunas de vectores virales ofrece una activación inmunitaria más robusta.
Se han desarrollado muchos tipos de virus en plataformas de vectores virales, desde retrovirus hasta citomegalovirus. Las diferentes clases de vectores virales varían ampliamente en cuanto a fortalezas y limitaciones, y algunas se adaptan a aplicaciones específicas. Por ejemplo, los vectores relativamente no inmunogénicos e integrativos como los vectores lentivirales se emplean comúnmente para la terapia génica. También se han desarrollado vectores virales quiméricos, como vectores híbridos con cualidades tanto de bacteriófagos como de virus eucariotas.
Los vectores virales fueron creados por primera vez en 1972 por Paul Berg. El desarrollo posterior se detuvo temporalmente debido a una moratoria de la investigación del ADN recombinante después de la Conferencia de Asilomar y las estrictas regulaciones de los Institutos Nacionales de Salud. Una vez levantada, en la década de 1980 se produjeron tanto la primera terapia génica con vectores virales recombinantes como la primera vacuna con vectores virales. Aunque en la década de 1990 se produjeron avances significativos en los vectores virales, los ensayos clínicos sufrieron una serie de reveses, que culminaron con la muerte de Jesse Gelsinger. Sin embargo, en el siglo XXI, los vectores virales experimentaron un resurgimiento y han sido aprobados a nivel mundial para el tratamiento de diversas enfermedades. Se han administrado a miles de millones de pacientes, en particular durante la pandemia de COVID-19.
Características

Los virus, agentes infecciosos compuestos por una capa proteica que encierra un genoma, son las entidades biológicas más numerosas de la Tierra. Como no pueden replicarse de forma independiente, deben infectar células y secuestrar la maquinaria de replicación del huésped para producir copias de sí mismos. Los virus hacen esto insertando su genoma, que puede ser ADN o ARN, ya sea monocatenario o bicatenario, en el huésped. Algunos virus pueden integrar su genoma directamente en el del huésped en forma de provirus.
Esta capacidad de transferir material genético extraño ha sido explotada por los ingenieros genéticos para crear vectores virales, que pueden transducir el transgén deseado en una célula diana. Los vectores virales constan de tres componentes:
- Una proteína capsida y a veces un sobre que encapsida la carga genética. Esto determina la gama de tipos de células que el vector infecta, denominado su tropismo.
- Una carga útil genética: el transgene que resulta en el efecto deseado cuando se expresa.
- Una "casilla regulatoria" que controla la expresión transgénita, ya sea integrada en un cromosoma host o como un episome. El casete consta de un potenciador, un promotor y elementos auxiliares.
Aplicaciones

Investigación básica
Los vectores virales se utilizan de forma rutinaria en el ámbito de la investigación básica y pueden introducir genes que codifican, por ejemplo, ADN complementario, ARN de horquilla corta o sistemas CRISPR/Cas9 para la edición genética. Los vectores virales se emplean para la reprogramación celular, como la inducción de células madre pluripotentes o la diferenciación de células somáticas adultas en diferentes tipos de células. Los investigadores también utilizan vectores virales para crear ratones y ratas transgénicos para experimentos. Los vectores virales se pueden utilizar para la obtención de imágenes in vivo mediante la introducción de un gen indicador. Además, la transducción de células madre puede permitir el seguimiento del linaje celular durante el desarrollo.
Terapia genética

La terapia génica busca modular o afectar de alguna otra manera la expresión génica mediante la introducción de un transgén terapéutico. La terapia génica mediante vectores virales se puede realizar mediante administración in vivo, administrando directamente el vector al paciente, o ex vivo, extrayendo células del paciente, transduciéndolas y luego reintroduciendo las células modificadas en el paciente. Las terapias génicas con vectores virales también se pueden utilizar para plantas, mejorando tentativamente el rendimiento de los cultivos o promoviendo la producción sostenible.
Existen cuatro grandes categorías de terapia génica: reemplazo de genes, silenciamiento de genes, adición de genes o edición de genes. En comparación con otros enfoques de terapia génica no integrativa, los transgenes introducidos por vectores virales ofrecen una expresión que dura varios años.
Vacunas

Para su uso como plataformas de vacunas, los vectores virales pueden diseñarse para transportar un antígeno específico asociado con una enfermedad infecciosa o un antígeno tumoral. Las vacunas convencionales no son adecuadas para la protección contra algunos patógenos debido a las estrategias únicas de evasión inmunológica y las diferencias en la patogénesis. Las vacunas basadas en vectores virales, por ejemplo, podrían eventualmente ofrecer inmunidad contra el VIH-1 y la malaria.
Mientras que las vacunas de subunidades tradicionales provocan una respuesta humoral, los vectores virales permiten la expresión intracelular de antígenos que activan las vías del CMH a través de vías directas y de presentación cruzada. Esto induce una respuesta inmunitaria adaptativa robusta. Las vacunas de vectores virales también tienen propiedades adyuvantes intrínsecas a través de la activación del sistema inmunitario innato y la expresión de patrones moleculares asociados a patógenos, lo que elimina la necesidad de cualquier adyuvante adicional. Además de una respuesta inmunitaria más robusta en comparación con otros tipos de vacunas, los vectores virales ofrecen una transducción genética eficiente y pueden dirigirse a tipos de células específicos. Sin embargo, la inmunidad preexistente al virus utilizado como vector puede ser un problema importante.
Antes de 2020, las vacunas de vectores virales se administraban ampliamente, pero se limitaban a la medicina veterinaria. En la respuesta mundial a la pandemia de COVID-19, las vacunas de vectores virales desempeñaron un papel fundamental y se administraron a miles de millones de personas, en particular en países de ingresos bajos y medios.
Tipos
Retrovirus
Los retrovirus (virus ARN envueltos) son plataformas virales populares debido a su capacidad de integrar material genético en el genoma del huésped. Los vectores retrovirales comprenden dos clases generales: vectores retrovirales gamma y vectores lentivirales. La diferencia fundamental entre los dos es que los vectores retrovirales gamma solo pueden infectar células en división, mientras que los vectores lentivirales pueden infectar tanto células en división como células en reposo. Cabe destacar que los genomas retrovirales están compuestos de ARN monocatenario y deben convertirse en ADN bicatenario proviral, un proceso conocido como transcripción inversa, antes de que se integren en el genoma del huésped a través de proteínas virales como la integrasa.
El vector gammaretroviral más utilizado es un virus de la leucemia murina de Moloney modificado (MMLV), capaz de transducir varios tipos de células de mamíferos. Los vectores MMLV se han asociado con algunos casos de carcinogénesis. Los vectores gammaretrovirales se han aplicado con éxito a células madre hematopoyéticas ex vivo para tratar múltiples enfermedades genéticas.
Lentiviral vectors
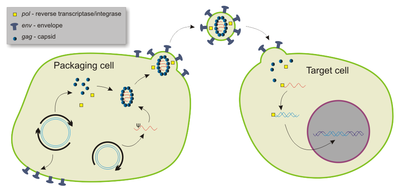
La mayoría de los vectores lentivirales se derivan del virus de inmunodeficiencia humana tipo 1 (VIH-1), aunque también se han utilizado virus de inmunodeficiencia simia modificados (VIS), virus de inmunodeficiencia felina (VIF) y virus de anemia infecciosa equina (VAIE). Como todos los genes funcionales se eliminan o se mutan de otro modo, los vectores no son citopáticos y se pueden modificar para que no sean integrativos.
Los vectores lentivirales pueden transportar hasta 10 kb de material genético extraño, aunque en 2023 se informó que 3-4 kb eran el tamaño óptimo. En comparación con otros vectores virales, los vectores lentivirales poseen la mayor capacidad de transducción, debido a la formación de un "colgajo de ADN" de tres cadenas durante la retrotranscripción del ARN lentiviral monocatenario a ADN dentro del huésped.
Aunque en su mayor parte no son inflamatorios, los vectores lentivirales pueden inducir respuestas inmunitarias adaptativas robustas por parte de las células T citotóxicas de tipo memoria y las células T auxiliares. Esto se debe en gran medida al alto tropismo de los vectores lentivirales por las células dendríticas, que activan las células T. Sin embargo, pueden infectar todos los tipos de células presentadoras de antígenos. Además, como son los únicos vectores retrovirales capaces de transducir de manera eficiente tanto células en división como células que no lo están, los convierten en las plataformas de vacunas más prometedoras. También se han probado como vacunas contra el cáncer.
Los vectores lentivirales se han utilizado como terapias in vivo, por ejemplo, para tratar directamente enfermedades genéticas como la hemofilia B y para tratamientos ex vivo, como la modificación de células inmunitarias en la terapia con células CAR T. En 2017, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el tisagenlecleucel, un vector lentiviral, para la leucemia linfoblástica aguda.
Adenoviruses

Los adenovirus son virus de ADN de doble cadena que pertenecen a la familia Adenoviridae. Sus genomas relativamente grandes, de aproximadamente 30-45 kb, los convierten en candidatos ideales para la administración genética; los vectores adenovirales más nuevos pueden transportar hasta 37 kb de material genético extraño. Los vectores adenovirales muestran una alta eficiencia de transducción y expresión de transgenes, y pueden infectar tanto células en división como células que no lo están.
La cápside adenoviral, un icosaedro, presenta una protuberancia fibrosa en cada uno de sus 12 vértices. Estas proteínas fibrosas median la entrada celular, lo que afecta en gran medida la eficacia y contribuye a su amplio tropismo, en particular a través de los receptores de adenovirus coxsackie (CAR). Los vectores adenovirales pueden inducir respuestas inmunitarias innatas y adaptativas robustas. Su fuerte inmunogenicidad se debe en particular a la transducción de células dendríticas (CD), que regulan positivamente la expresión de las moléculas MHC I y II y activan las CD. Tienen un fuerte efecto adyuvante, ya que muestran varios patrones moleculares asociados a patógenos. Una desventaja es que es común la inmunidad preexistente a los serotipos de adenovirus, lo que reduce la eficacia. El uso de adenovirus de chimpancé puede evitar este problema.
Si bien la activación de las respuestas inmunitarias tanto innatas como adaptativas es un obstáculo para muchas aplicaciones terapéuticas, hace que los vectores adenovirales sean una plataforma de vacunas ideal. La respuesta mundial a la pandemia de COVID-19 implicó el desarrollo y uso de múltiples vacunas de vectores adenovirales, entre ellas Sputnik V, la vacuna Oxford-AstraZeneca y la vacuna Janssen.
Virus asociados con el Adeno

Los virus adenoasociados (AAV) son virus de ADN monocatenario relativamente pequeños que pertenecen a la familia Parvoviridae y, al igual que los vectores lentivirales, los AAV pueden infectar tanto células en división como células que no lo están. Sin embargo, los AAV requieren la presencia de un "virus auxiliar", como un adenovirus o un virus del herpes simple, para replicarse dentro del huésped, aunque pueden hacerlo de forma independiente si se induce estrés celular o si el vector porta los genes del virus auxiliar.
Los AAV se insertan en un sitio específico del genoma del huésped, en particular en el cromosoma 19 de los humanos, el AAVS1. Sin embargo, se han diseñado AAV recombinantes que no se integran, sino que se almacenan como episomas que, en células que no se dividen, pueden durar años. Una desventaja es que no pueden transportar grandes cantidades de material genético extraño. Además, la necesidad de expresar la cadena complementaria para su genoma monocatenario puede retrasar la expresión del transgén.
En 2020 se habían identificado 11 serotipos diferentes de AAV, que se diferenciaban por la estructura de la cápside y, en consecuencia, por el tropismo. El tropismo de los vectores virales adenoasociados se puede adaptar creando versiones recombinantes a partir de múltiples serotipos, lo que se denomina pseudotipificación. Debido a su capacidad para infectar e inducir efectos duraderos dentro de células que no se dividen, los AAV se utilizan comúnmente en la investigación básica en neurociencia. Tras la aprobación del AAV Alipogene tiparvovec en Europa en 2012, en 2017 la FDA aprobó la primera terapia génica in vivo basada en AAV, voretigene neparvovec, que trataba la amaurosis congénita de Leber asociada a RPE65. En 2020, se estaban realizando o se habían completado 230 ensayos clínicos que utilizaban tratamientos basados en AAV.
Vaccinia

El virus vaccinia, un poxvirus, es otro candidato prometedor para el desarrollo de vectores virales. Su uso como vacuna contra la viruela (descrito por primera vez por Edward Jenner en 1798) condujo a la erradicación de la viruela y demostró que la vacuna contra la viruela era segura y eficaz en humanos. Además, los procedimientos de fabricación desarrollados para producir en masa reservas de vacunas contra la viruela pueden acelerar la producción de vectores virales vaccinia.
La vacuna posee un genoma de ADN grande y, en consecuencia, puede transportar hasta 40 kb de ADN extraño. Además, es poco probable que la vacuna se integre en el genoma del huésped, lo que reduce la posibilidad de carcinogénesis. Se han desarrollado cepas atenuadas (replicantes y no replicantes). Aunque se ha caracterizado ampliamente debido a su uso contra la viruela, en 2019 se desconocía la función del 50 por ciento del genoma de la vacuna. Esto puede provocar efectos impredecibles.
Como plataforma de vacunas, los vectores vaccinia muestran una expresión transgénica altamente efectiva y crean una respuesta inmune robusta. El virus actúa rápidamente: su ciclo de vida produce una progenie vaccinia madura en 6 horas y tiene tres mecanismos de propagación viral. La vaccinia también tiene un efecto adyuvante, activando una fuerte respuesta innata a través de receptores tipo Toll. Sin embargo, una desventaja significativa que puede reducir su eficacia es la inmunidad preexistente contra la vaccinia en quienes recibieron la vacuna contra la viruela.
Herpesviruses

De los nueve virus del herpes que infectan a los seres humanos, el virus del herpes simple 1 (HSV-1) es el mejor caracterizado y el más utilizado como vector viral. El HSV-1 ofrece varias ventajas: tiene un amplio tropismo y puede administrar terapias a través de sistemas de expresión especializados. Además, el HSV-1 puede atravesar la barrera hematoencefálica si se altera médicamente, lo que le permite atacar enfermedades neurológicas. Además, el HSV-1 no se integra en el genoma del huésped y puede transportar grandes cantidades de ADN extraño. La primera característica evita la mutagénesis dañina, como puede ocurrir con los vectores retrovirales y adenoasociados. Se han desarrollado cepas deficientes en la replicación.
En 2015, la FDA aprobó el talimogén laherparepvec, un vector HSV-1 que desencadena una respuesta inmunitaria antitumoral, para tratar el melanoma. A partir de 2020, los vectores HSV-1 se han aplicado experimentalmente contra sarcomas y cánceres de cerebro, colon, próstata y piel.
El citomegalovirus (CMV), un virus del herpes, también se ha desarrollado para su uso como vector viral. El CMV puede infectar a la mayoría de los tipos de células y, por lo tanto, puede proliferar en todo el cuerpo. Aunque una vacuna basada en el CMV proporcionó una inmunidad significativa contra el VIS (estrechamente relacionado con el VIH) en macacos, se informó que el desarrollo del CMV como vector confiable todavía estaba en etapas iniciales en 2020.
Virus de las plantas
Los virus vegetales también son vectores virales modificados genéticamente para su uso en la agricultura, la horticultura y la producción biológica. Estos vectores se han empleado para una variedad de aplicaciones, desde el aumento de la calidad estética de las plantas ornamentales hasta el biocontrol de plagas, la expresión rápida de proteínas y péptidos recombinantes y la aceleración del mejoramiento de cultivos. Se ha propuesto el uso de virus vegetales modificados genéticamente para mejorar el rendimiento de los cultivos y promover la producción sustentable.
Los vectores basados en virus replicantes se utilizan habitualmente. Los virus de ARN utilizados para las monocotiledóneas incluyen el virus del mosaico estriado del trigo y el virus del mosaico estriado de la cebada y, para las dicotiledóneas, el virus del cascabel del tabaco. También se han utilizado virus de ADN monocatenario como los geminivirus. Los vectores virales se pueden administrar a las plantas a través de varias vías denominadas "agroinoculación", que incluyen frotamiento, un sistema de administración biolística, agrospray, agroinyección e incluso a través de vectores de insectos. Sin embargo, la administración de vectores virales mediada por Agrobacterium, en la que las bacterias se transforman con ADN plasmídico que codifica la construcción del vector viral, es el enfoque más común.
Bacteriofages
Se han desarrollado vectores quiméricos que combinan bacteriófagos y virus eucariotas y que son capaces de infectar células eucariotas. A diferencia de los vectores basados en virus eucariotas, estos vectores bacteriófagos no tienen un tropismo innato por las células eucariotas, lo que permite que se los diseñe para que sean altamente específicos para las células cancerosas.
Los vectores bacteriófagos también se utilizan con frecuencia en biología molecular. Por ejemplo, los vectores bacteriófagos se utilizan en la evolución continua asistida por fagos, lo que promueve la mutagénesis rápida de bacterias. Aunque se limitan a los micobacteriófagos y algunos fagos de bacterias gramnegativas, los bacteriófagos se pueden utilizar para la clonación directa.
Fabricación
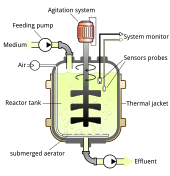
Los métodos de fabricación de vectores virales suelen variar según el vector, aunque la mayoría utiliza un sistema adherente o en suspensión con células de mamíferos. Para la producción de vectores virales en un entorno de laboratorio más pequeño, se suelen utilizar sistemas de cultivo celular estático como placas de Petri.
Las técnicas que se utilizan en el laboratorio son difíciles de escalar y requieren enfoques diferentes a escala industrial. Los fabricantes suelen utilizar grandes sistemas de cultivo desechables de un solo uso y biorreactores. Se utilizan recipientes como los que tienen superficies permeables a los gases para maximizar la densidad del cultivo celular y las unidades de transducción de soluciones. Según el recipiente, los virus se pueden aislar directamente del sobrenadante o mediante lisis química de las células cultivadas o microfluidización. En 2017, The New York Times informó de un retraso en la fabricación de virus inactivados, lo que retrasó algunos ensayos de terapia génica durante años.
Historia
En 1972, el bioquímico de la Universidad de Stanford Paul Berg desarrolló el primer vector viral, incorporando ADN del fago lambda al poliomavirus SV40 para infectar células renales mantenidas en cultivo. Las implicaciones de este logro preocuparon a científicos como Robert Pollack, quien convenció a Berg de no transducir ADN del SV40 en E. coli a través de un vector bacteriófago. Temían que la introducción de los genes supuestamente cancerígenos del SV40 creara cepas bacterianas cancerígenas. Estas preocupaciones y otras en el campo emergente del ADN recombinante condujeron a la Conferencia de Asilomar de 1975, donde los asistentes acordaron una moratoria voluntaria sobre la clonación de ADN.
En 1977, los Institutos Nacionales de Salud (NIH) emitieron directrices formales que limitaban la clonación de ADN viral a condiciones BSL-4 rígidas, impidiendo prácticamente este tipo de investigación. Sin embargo, los NIH flexibilizaron estas normas en 1979, lo que permitió a Bernard Moss desarrollar un vector viral utilizando vaccinia. En 1982, Moss informó sobre el primer uso de un vector viral para la expresión génica transitoria. Al año siguiente, Moss utilizó el vector vaccinia para expresar un antígeno de la hepatitis B, creando la primera vacuna de vector viral.
Cada reino de la medicina tiene su momento de definición, a menudo con un rostro humano unido. Polio tenía a Jonas Salk. La fertilización in vitro tenía a Louise Brown, el primer bebé del mundo de test-tube. La cirugía de trasplante tuvo a Barney Clark, el dentista de Seattle con el corazón artificial. El SIDA tenía a Magic Johnson. Ahora la terapia genética tiene a Jesse Gelsinger.
Sheryl Gay Stolberg, The New York Times Magazine
Aunque ya en 1972 se había realizado un intento fallido de terapia génica utilizando el virus del papiloma de Shope de tipo salvaje, Martin Cline intentó la primera terapia génica utilizando ADN recombinante en 1980, pero no tuvo éxito. En la década de 1990, a medida que se caracterizaban mejor las enfermedades genéticas y mejoraba la tecnología de vectores virales, hubo un optimismo excesivo sobre las capacidades de la tecnología. Muchos ensayos clínicos fracasaron. Hubo algunos éxitos, como la primera terapia génica eficaz para la inmunodeficiencia combinada grave (SCID), que empleó un vector retroviral.
Sin embargo, durante un ensayo clínico en 1999 en la Universidad de Pensilvania, Jesse Gelsinger murió a causa de una reacción fatal a una terapia génica basada en un vector adenoviral. Fue la primera muerte relacionada con cualquier forma de terapia génica. En consecuencia, la FDA suspendió todos los ensayos de terapia génica en la Universidad de Pensilvania e investigó otros 60 en todo Estados Unidos. Un editorial anónimo en Nature Medicine señaló que representaba una "pérdida de la inocencia" para los vectores virales. Poco después, la reputación del campo se vio aún más dañada cuando 5 niños tratados con una terapia génica SCID desarrollaron leucemia debido a un problema con el vector retroviral.
Los vectores virales experimentaron un resurgimiento cuando se emplearon con éxito para la administración de genes hematopoyéticos ex vivo en entornos clínicos. En 2003, China aprobó la primera terapia génica para uso clínico: Gendicine, un vector adenoviral que codifica p53. En 2012, la Unión Europea emitió su primera aprobación de una terapia génica, un vector viral adenoasociado. Durante la pandemia de COVID-19, las vacunas de vectores virales se utilizaron en una medida sin precedentes: se administraron a miles de millones de personas. En 2022, todas las terapias génicas aprobadas se basaban en vectores virales y se estaban realizando más de 1000 ensayos clínicos de vectores virales dirigidos al cáncer.
En la cultura popular

En el cine, los vectores virales suelen ser retratados como causantes involuntarios de pandemias y catástrofes para la civilización. La película de 2007 Soy leyenda muestra un vector viral que ataca al cáncer y desencadena un apocalipsis zombi. De manera similar, una terapia con vectores virales para la enfermedad de Alzheimer en El origen del planeta de los simios (2011) se convierte en un patógeno mortal y causa un levantamiento de simios. Otras películas que presentan vectores virales incluyen El legado de Bourne (2012) y Resident Evil: El capítulo final (2016).
Notas y referencias
Notas
- ^ Un niño murió finalmente. Según Cormac Sheridan, la reacción fue injusta, ya que la tasa de mortalidad general para la terapia vectorial viral era inferior a enfoques equivalentes.
Citaciones
- ^ Pasin, Menzel & Daròs 2019, p. 1010.
- ^ a b c d Labbé, Vessillier " Rafiq 2021, pág. 1.
- ^ Kayser et al. 2005, pp. 377–378.
- ^ Barth ' Aylward 2024, pág. 1.
- ^ Bulcha et al. 2021, págs. 1 a 2.
- ^ Nomaguchi et al. 2012, pág. 1.
- ^ Moen et al. 2012, pág. 2.
- ^ Lanigan, Kopera " Saunders 2020, págs. 1, 7.
- ^ a b Sakuma, Barry & Ikeda 2012, pág. 612.
- ^ Lanigan, Kopera " Saunders 2020, pág. 1.
- ^ a b c d Bulcha et al. 2021, pág. 1.
- ^ a b Pasin et al. 2024, pág. 1.
- ^ Li et al. 2023, pág. 2.
- ^ Sasmita 2019, pág. 29.
- ^ a b Wang et al. 2023, pág. 1.
- ^ Larocca & Schlom 2011, pág. 1.
- ^ Elkashif y otros 2021, pág. 1.
- ^ a b c Ura, Okuda & Shimada 2014, pág. 625.
- ^ a b Ura, Okuda & Shimada 2014, p. 624.
- ^ McCann et al. 2022, pág. 2.
- ^ Ura, Okuda & Shimada 2014, p. 624-625.
- ^ a b c d McCann et al. 2022, pág. 1.
- ^ McCann et al. 2022, págs. 1, 6 a 7.
- ^ a b c d Labbé, Vessillier " Rafiq 2021, pág. 2.
- ^ Milone " O'Doherty 2018, pp. 1530–1531.
- ^ Gruntman & Flotte 2018, pp. 1734.
- ^ Gruntman & Flotte 2018, pp. 1733.
- ^ a b c Nemirov et al. 2023, pág. 1.
- ^ Nemirov et al. 2023, pp. 1, 4.
- ^ a b Nemirov et al. 2023, págs. 1 a 2.
- ^ a b Nemirov et al. 2023, pág. 4.
- ^ Nemirov et al. 2023, pág. 7.
- ^ a b Li & Samulski 2020, pág. 255.
- ^ a b c Elkashif y otros 2021, pág. 2.
- ^ a b Farhad et al. 2022, pág. 2.
- ^ Nemirov et al. 2023, págs. 3 a 4.
- ^ a b c Ura, Okuda " Shimada 2014, pág. 628.
- ^ a b Elkashif y otros 2021, pág. 3.
- ^ Elkashif et al. 2021, págs. 3 a 4.
- ^ Elkashif y otros 2021, pág. 8.
- ^ Ewer et al. 2017, pág. 3020.
- ^ Elkashif et al. 2021, pp. 10, 11.
- ^ a b c Haggerty et al. 2019, pág. 69.
- ^ Haggerty et al. 2019, págs. 69 a 70.
- ^ a b Haggerty et al. 2019, pág. 70.
- ^ Haggerty et al. 2019, págs. 71 a 74, 78.
- ^ a b Haggerty et al. 2019, pág. 75.
- ^ a b Zhang et al. 2021, pág. 1578.
- ^ a b c Ura, Okuda " Shimada 2014, pág. 626.
- ^ a b c d Ura, Okuda & Shimada 2014, pág. 627.
- ^ a b c Kaynarcalidan, Mascaraque " Drexler 2021, pág. 1.
- ^ a b c Guo et al. 2019, pág. 4.
- ^ Mody et al. 2020, pág. 1.
- ^ Mody et al. 2020, págs. 3 a 4.
- ^ Mody et al. 2020, pág. 4.
- ^ Khushalani et al. 2023, pág. 1.
- ^ Hromic-Jahjefendic " Lundstrom 2020, pág. 631.
- ^ Ura, Okuda " Shimada 2014, pág. 631.
- ^ Sasso et al. 2020, pág. 10.
- ^ Schaefer et al. 2005, pág. 1446.
- ^ Abrahamian, Hammond & Hammond 2020, pp. 513-515.
- ^ a b Pasin, Menzel & Daròs 2019, pp. 1010–1011.
- ^ a b Zaidi & Mansoor 2017, p. 1.
- ^ Abrahamian, Hammond & Hammond 2020, págs. 520 a 523.
- ^ Abrahamian, Hammond & Hammond 2020, págs. 522 a 528.
- ^ Petrov, Dymova & Richter 2022, pág. 9.
- ^ Pranjol " Hajitou 2015, pág. 269.
- ^ Petrov, Dymova & Richter 2022, p. 1.
- ^ Elois et al. 2023, pág. 1.
- ^ Abril et al. 2022, pág. 11.
- ^ Abril et al. 2022, pág. 12.
- ^ a b c d van der Loo " Wright 2016, pág. 44.
- ^ Merten et al. 2014, pág. 184.
- ^ van der Loo " Wright 2016, pág. 45.
- ^ Kolata 2017.
- ^ Travieso et al. 2022, pág. 1.
- ^ Lukiw 2023, pág. 1.
- ^ Jackson, Symons " Berg 1972, págs. 2904 a 2909.
- ^ Carmen 1985, págs. 61 a 62.
- ^ Lukiw 2023, pág. 2.
- ^ a b Moss 2013, pág. 4220.
- ^ a b Stolberg 1999.
- ^ Wirth, Parker & Ylä-Herttuala 2013, pág. 164.
- ^ a b c d e Sheridan 2011, pág. 121.
- ^ a b Sibbald 2001, pág. 1612.
- ^ a b Bezeljak 2022, págs. 2, 10.
- ^ Wirth, Parker & Ylä-Herttuala 2013, pág. 165.
- ^ Bezeljak 2022, pág. 23.
- ^ Wirth, Parker & Ylä-Herttuala 2013, págs. 166 a 167.
- ^ Bezeljak 2022, p. 2.
- ^ Sánchez-Angulo 2023, págs. 1, 16.
- ^ Reuters 2020.
- ^ Feldman " Clayton 2022, págs. 2, 5.
- ^ Sánchez-Angulo 2023, pág. 16.
Obras citadas
Artículos de revista
- Abrahamian P, Hammond RW, Hammond J (2020). "Plant Virus–Derived Vectores: Aplicaciones en Biotecnología Agrícola y Médica". Revisión anual de Virología. 7 (1): 513-535. doi:10.1146/annurev-virology-010720-054958. PMID 32520661.
- Abril AG, Carrera M, Notario V, Sánchez-Perez A, Villa TG (2022). "El uso de Bacteriofagos en Biotecnología e Insights Recientes en Proteomics". Antibióticos. 11 (5): 653. doi:10.3390/antibióticos11050653. PMC 9137636. PMID 35625297.
- Barth ZK, Aylward FO (2024). "Marcha de los provirus". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 121 (14): e2402541121. Bibcode:2024PNAS..12102541B. doi:10.1073/pnas.2402541121. PMC 10998573. PMID 38527209.
- Bezeljak U (2022). "La terapia genética del cáncer se hace viral: las plataformas vectoriales virales vienen de la edad". Radiología y Oncología. 56 (1): 1–13. doi:10.2478/raon-2022-0002. 8884858. PMID 35148469.
- Bulcha JT, Wang Y, Ma H, Tai PW, Gao G (2021). Plataformas vectoriales virtuales dentro del paisaje de terapia génica. Transducción de señales y terapia dirigida. 6 (1): 53. doi:10.1038/s41392-021-00487-6. PMC 7868676. PMID 33558455.
- Elkashif A, Alhashimi M, Sayedahmed EE, Sambhara S, Mittal SK (2021). " Plataformas basadas en vectores adenovirales para desarrollar vacunas eficaces para combatir infecciones virales respiratorias". Clínica y Traducción Inmunología. 10 (10): e1345. doi:10.1002/cti2.1345. PMC 8510854. PMID 34667600.
- Elois MA, Silva R, Pilati GV, Rodriguez-Lazaro D, Fongaro G (2023). "Bacteriophages as Biotechnological Tools". Viruses. 15 (2): 268–284. doi:10.3390/v15020349. PMC 9963553. PMID 36851563.
- Ewer K, Sebastian S, Spencer AJ, Gilbert S, Hill AV, Lambe T (2017). "Chimpanzee adenoviral vectores como vacunas para patógenos brotados". Vacunas humanas & inmunoterapia. 13 (12): 3020–3032. doi:10.1080/21645515.2017.1383575. PMC 5718829. PMID 29083948.
- Farhad T, Neves K, Arbuthnot P, Maepa MB (2022). " Vectores Adenovirales: Potencial como Vacunas Anti-HBV y Terapéutica". Genes. 13 11): 1941. doi:10.3390/genes13111941. PMC 9689594. PMID 36360178.
- Feldman ZB, Clayton J (2022). "Genética y ética en el Corpus de la Leyenda". Journal of Literature and Science. 14 (1–2): 94–107. 9764423. PMID 36545402.
- Glorioso JC, Cohen JB, Goins WF, Hall B, Jackson JW, Kohanbash G, et al. (2020). "Oncolytic HSV Vectores y Anti-Tumor Immunity". Problemas actuales en la biología molecular. 41: 381-468. PMID 32938804.
- Gruntman AM, Flotte TR (2018). "El estado de terapia genética que evoluciona rápidamente". The FASEB Journal. 32 (4): 1733-1740. doi:10.1096/fj.201700982R. PMID 31282760.
- Guo ZS, Lu B, Guo Z, Giehl E, Feist M, Dai E, et al. (2019). "Inmunoterapia de cáncer mediada por el virus Vaccinia: vacunas contra el cáncer y oncólisis". Journal of Immunotherapy of Cancer. 9 (7): 6. doi:10.1186/s40425-018-0495-7. PMC 6325819. PMID 30626434.
- Haggerty CL, Grecco GG, Reeves KC, Atwood B (2019). "Adeno-Associated Viral Vectors in Neuroscience Research". Terapia molecular - Métodos y desarrollo clínico. 17: 69–82. doi:10.1016/j.omtm.2019.11.012. PMC 6931098. PMID 31890742.
- Hromic-Jahjefendic A, Lundstrom K (2020). "Viral Vector-Based Melanoma Gene Therapy". Biomedicinas. 8 60. doi:10.3390/biomedicinas8030060. PMC 7148454. PMID 32187995.
- Jackson DA, Symons RH, Berg P (1972). "Método bioquímico para insertar nueva información genética en el ADN del virus Simian 40: moléculas circulares de ADN SV40 que contienen genes de la fogo de lambda y el operón de la galactosa de Escherichia coli". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 69 (10): 2904–2909. Bibcode:1972PNAS...69.2904J. doi:10.1073/pnas.69.10.2904. PMC 389671. PMID 4342968.
- Kaynarcalidan O, Mascaraque SM, Drexler I (2021). "Vaccinia Virus: Desde Crude Smallpox Vaccines to Elaborate Viral Vector Vaccine Design". Biomedicinas. 9 11): 1780. doi:10.3390/biomedicinas9121780. PMC 8698642. PMID 34944596.
- Khushalani NI, Harrington KJ, Melcher A, Bommareddy PK, Zamarin D (2023). "Breaking the barriers in cancer care: La próxima generación de herpes simples inmunoterapias oncolíticas basadas en virus para el tratamiento del cáncer". Terapia molecular Oncolytics. 31: 100729. doi:10.1016/j.omto.2023.100729. PMC 10570124. PMID 37841530.
- Labbé RP, Vessillier S, Rafiq QA (2021). " Vectores Lentivirales para T Cell Engineering: Aplicaciones Clínicas, Bioprocesamiento y Perspectivas Futuras". Viruses. 13 (152): 1528. doi:10.3390/v13081528. PMC 8402758. PMID 34452392.
- Lanigan TM, Kopera HC, Saunders TL (2020). "Principios de Ingeniería Genética". Genes. 11 (3): 603-618. doi:10.3390/genes11030291. PMC 7140808. PMID 32164255.
- Larocca C, Schlom J (2011). "Varias vacunas de cáncer terapéutico basadas en vectores". The Cancer Journal. 17 (5): 359–371. doi:10.1097/PPO.0b013e3182325e63. PMC 3207353. PMID 21952287.
- Li C, Samulski RJ (2020). "Engineering adeno-asociated virus vectores para la terapia de genes". Nature Reviews Genética. 21 (4): 255–272. doi:10.1038/s41576-019-0205-4. PMID 32042148.
- Li X, Le Y, Zhang Z, Nian X, Liu B, Yang X (2023). "Terapia genética basada en vectores". International Journal of Molecular Sciences. 24 (9): 7736. doi:10.3390/ijms24097736. PMC 10177981. PMID 37175441.
- Lukiw WJ (2023). "Comentario: Un homenaje al Dr. Paul Berg (1926-2023) Bioquímico estadounidense, premio Nobel y descubridor de la tecnología de ADN recombinante, vacuna e ingeniería genética". Frontiers in Cell and Developmental Biology. 11: 1210530. doi:10.3389/fcell.2023.1210530. PMC 10233203. PMID 37274735.
- McCann N, O'Connor D, Lambe T, Pollard AJ (2022). "Varias vacunas vectoriales". Opinión actual en inmunología. 77. doi:10.1016/j.coi.2022.102210. PMC 9612401. PMID 35643023.
- Merten O, Schweizer M, Chahal P, Kamen AA (2014). "Manufacturación de vectores virales para la terapia de genes: parte I. procesamiento de aguas arriba". Bioprocesamiento farmaceutico. 2 (2): 183–203. doi:10.4155/pbp.14.16.
- Milone MC, O'Doherty U (2018). "Uso clínico de vectores lentivirales". Leucemia. 32 (7): 1529–1541. doi:10.1038/s41375-018-0106-0. PMC 6035154. PMID 29654266.
- Mody PH, Pathak S, Hanson LK, Spencer JV (2020). "Herpes Simplex Virus: A Versatile Tool for Insights Into Evolution, Gene Delivery, and Tumor Immunotherapy". Virología. 11: 1178122X20913274. doi:10.1177/1178122X20913274. 8142529. PMID 34093008.
- Moen I, Jevne C, Wang J, Kalland K, Chekenya M, Akslen LA, et al. (2012). "Expresión genérica en células tumorales y estroma en tumores dsRed 4T1 en ratones eGFP expresivos con oxigenación mejorada y sin aumento". BMC Cáncer. 12 21. doi:10.1186/1471-2407-12-21. PMC 3274430. PMID 22251838.
- Moss B (2013). "Reflexiones sobre el desarrollo temprano de vectores de poxvirus". Vacuna. 31 (39): 4220–4222. doi:10.1016/j.vaccine.2013.03.042. PMC 3755097. PMID 23583893.
- Nemirov K, Bourgine M, Anna F, Wei Y, Charneau P, Majlessi L (2023). "Lentiviral Vectors como Plataforma Vacuna contra Enfermedades Infecciosas". Farmacia. 15 3): 846. doi:10.3390/pharmaceutics15030846. PMC 10053212. PMID 36986707.
- Nomaguchi M, Fujita M, Miyazaki Y, Adachi A (2012). " Tropismo Viral". Fronteras en Microbiología. 3 (281): 281. doi:10.3389/fmicb.2012.00281. PMC 3411105. PMID 22876241.
- Pasin F, Menzel W, Daròs JA (2019). "Los virus atesorados en la era de la metagenomía y la biología sintética: una actualización sobre el ensamblaje de clones infecciosos y biotecnologías de virus vegetales". Biotecnología vegetal Journal. 17 (6): 1010–1026. doi:10.1111/pbi.13084. PMC 6523588. PMID 30677208.
- Pasin F, Uranga M, Charudattan R, Kwon CT (2024). "Ingeniería de buenos virus para mejorar el rendimiento de los cultivos". Nature Reviews Bioengineering: 1. doi:10.1038/s44222-024-00197-y.
- Petrov G, Dymova M, Richter V (2022). "Terapia Genética del Cáncer Mediado de bacterias". International Journal of Molecular Sciences. 23 (14245): 14245. doi:10.3390/ijms232214245. PMC 9697857. PMID 36430720.
- Pranjol ZI, Hajitou A (2015). "Terapia Genética del Cáncer Mediado de bacterias". Viruses. 7 (1): 268–284. doi:10.3390/v7010268. PMC 4306838. PMID 25606974.
- Sakuma T, Barry MA, Ikeda Y (2012). "Lentiviral vectores: básico a traducción". Biochemical Journal. 443 (3): 603-618. doi:10.1042/BJ20120146. PMID 22507128.
- Sasmita AO (2019). "Investigación de transferencia genética mediada por el virus actual para el tratamiento de la enfermedad de Alzheimer". Biotecnología Revisiones de ingeniería. 35 (1): 26–45. doi:10.1080/02648725.2018.1523521. PMID 30317930.
- Sánchez-Angulo M (2023). "Los patógenos microbianos en las películas". FEMS Cartas de microbiología. 370. doi:10.1093/femsle/fnad129. PMC 10754150. PMID 38059853.
- Sasso E, D'Alise AM, Zambrano N, Scarselli E, Folgori A, Nicosia A (2020). "Nuevos vectores virales para enfermedades infecciosas y cáncer". Seminarios en Inmunología. 50. doi:10.1016/j.smim.2020.101430. PMID 33262065.
- Schaefer A, Robbins KE, Nzilambi EN, Louis ME, Quinn TC, Folks TM, et al. (2005). "Vigilancia del virus del VIH y la inmunodeficiencia simbiiana, Zaire". Enfermedades Infecciosas Emergentes. 11 (9): 1446-1448. doi:10.3201/eid1109.050179. PMC 3310624. PMID 16229778.
- Sibbald B (2001). "Muerte pero una consecuencia no deseada del ensayo de terapia genética". CMAJ. 164 11): 1612. PMC 81135. PMID 11402803.
- Sheridan C (2011). "La terapia del género encuentra su nicho". Nature Biotechnology. 29 (2): 121–128. doi:10.1038/nbt.1769. PMID 21301435.
- Smith GL, Mackett M, Moss B (1983). "Infectious vaccinia virus recombinants that express hepatitis B virus surface antigen". Naturaleza. 302 (5908): 490-495. Código Civil: 1983Natur.302..490S. doi:10.1038/302490a0. PMID 6835382.
- Travieso T, Li J, Mahesh S, Mello JD, Blasi M (2022). "El uso de vectores virales en el desarrollo de vacunas". npj Vaccines. 7 (1): 75. doi:10.1038/s41541-022-00503-y. PMC 9253346. PMID 35787629.
- Ura T, Okuda K, Shimada M (2014). "Developments in Viral Vector-Based Vaccines". Vacunas. 2 (3): 624-641. doi:10.3390/vaccines2030624. PMC 4494222. PMID 26344749.
- van der Loo J, Wright JF (2016). "Progreso y desafíos en la fabricación de vectores virales". Genética molecular humana. 25 (R1): R42-52. doi:10.1093/hmg/ddv451. PMC 4802372. PMID 26519140.
- Wang S, Liang B, Wang W, Li L, Feng N, Zhao Y, et al. (2023). "Varias vacunas vectoriales: diseño, desarrollo, aplicaciones preventivas y terapéuticas en enfermedades humanas". Transducción de señales y terapia dirigida. 8 (1): 149. doi:10.1038/s41392-023-01408-5. 10081433. PMID 37029123.
- Wirth T, Parker N, Ylä-Herttuala S (2013). "Historia de terapia génica". Gene. 525 (2): 162-169. doi:10.1016/j.gene.2013.03.137. PMID 23618815.
- Zaidi SS, Mansoor S (2017). "Viral Vectors for Plant Genome Engineering". Frontiers in Plant Science. 8: 539. doi:10.3389/fpls.2017.00539. PMC 5386974. PMID 28443125.
- Zhang Z, Dong L, Zhao C, Zheng P, Zhang X, Xu J (2021). "Vacania virus vector contra enfermedades infecciosas y tumores". Vacunas humanas & inmunoterapia. 17 (6): 1578–1585. doi:10.1080/21645515.2020.1840887. PMC 8115763. PMID 33606578.
Artículos de noticias
- "Revista de acción: Una vacuna no convirtió a los personajes en la película 'I Am Legend' en zombies". Reuters. 18 de diciembre de 2020. Retrieved 27 de abril 2024.
- Kolata G (27 de noviembre de 2017). "Terapia del género golpea un Peculiar Roadblock: A Virus Shortage". El New York Times. Archivado desde el original el 25 de abril de 2023. Retrieved 20 de mayo 2024.
- Stolberg SG (28 de noviembre de 1999). "La muerte Biotech de Jesse Gelsinger". The New York Times Magazine. Archivado desde el original el 25 de octubre de 2012. Retrieved 29 de abril 2024.
Libros y protocolos
- Carmen I (1985). Cloning and the Constitution: An Inquiry into Governmental Policymaking and Genetic Experimentation. University of Wisconsin Press. ISBN 9780299103408.
- Kayser FH, Bienz KA, Eckert J, Zinkernagel RM (2005). Microbiología médica (10 ed.). Thieme. ISBN 1588902455.
- Warnock JN, Daigre C, Al-Rubeai M (2011). "Introducción a Vectores Virales". En Manfredsson FP, Benskey MJ (eds.). Vectores Virales para la Terapia Genética: Métodos y Protocolos. Springer. pp. 1–25. ISBN 9781493990641.


