Vector de clonación

Un vector de clonación es una pequeña porción de ADN que se puede mantener de forma estable en un organismo y en el que se puede insertar un fragmento de ADN extraño con fines de clonación. El vector de clonación puede ser ADN tomado de un virus, la célula de un organismo superior, o puede ser el plásmido de una bacteria. El vector contiene características que permiten la inserción conveniente de un fragmento de ADN en el vector o su eliminación del vector, por ejemplo, mediante la presencia de sitios de restricción. El vector y el ADN extraño pueden tratarse con una enzima de restricción que corta el ADN, y los fragmentos de ADN así generados contienen extremos romos o salientes conocidos como extremos pegajosos, y el ADN del vector y el ADN extraño con extremos compatibles pueden unirse mediante ligación molecular.. Después de clonar un fragmento de ADN en un vector de clonación, se puede subclonar en otro vector diseñado para un uso más específico.
Hay muchos tipos de vectores de clonación, pero los más utilizados son los plásmidos modificados genéticamente. La clonación generalmente se realiza primero usando Escherichia coli, y los vectores de clonación en E. coli incluyen plásmidos, bacteriófagos (como el fago λ), cósmidos y cromosomas artificiales bacterianos (BAC). Sin embargo, parte del ADN no se puede mantener de forma estable en E. coli, por ejemplo, se pueden utilizar fragmentos de ADN muy grandes y otros organismos como la levadura. Los vectores de clonación en levadura incluyen cromosomas artificiales de levadura (YAC).
Características de un vector de clonación
Todos los vectores de clonación comúnmente utilizados en biología molecular tienen características clave necesarias para su función, como un sitio de clonación adecuado y un marcador seleccionable. Otros pueden tener características adicionales específicas para su uso. Por razones de facilidad y conveniencia, la clonación se realiza a menudo usando E. coli. Así, los vectores de clonación utilizados suelen tener elementos necesarios para su propagación y mantenimiento en E. coli, como un origen funcional de replicación (ori). El origen de replicación ColE1 se encuentra en muchos plásmidos. Algunos vectores también incluyen elementos que les permiten mantenerse en otro organismo además de E. coli, y estos vectores se denominan vectores lanzadera.
Sitio de clonación
Todos los vectores de clonación tienen características que permiten que un gen se inserte o elimine convenientemente en el vector. Este puede ser un sitio de clonación múltiple (MCS) o un policonector, que contiene muchos sitios de restricción únicos. Los sitios de restricción en el MCS se escinden primero mediante enzimas de restricción, luego un gen diana amplificado por PCR también digerido con las mismas enzimas se liga a los vectores usando ADN ligasa. La secuencia de ADN diana se puede insertar en el vector en una dirección específica si así se desea. Los sitios de restricción pueden usarse adicionalmente para la subclonación en otro vector si es necesario.
Otros vectores de clonación pueden usar topoisomerasa en lugar de ligasa y la clonación se puede realizar más rápidamente sin necesidad de digestión de restricción del vector o inserto. En este método de clonación TOPO, se activa un vector linealizado uniendo topoisomerasa I a sus extremos, y este vector "TOPO activado" el vector puede entonces aceptar un producto de PCR al ligar tanto el 5' extremos del producto de PCR, liberando la topoisomerasa y formando un vector circular en el proceso. Otro método de clonación sin el uso de digestión de ADN y ligasa es mediante recombinación de ADN, por ejemplo, como se usa en el sistema de clonación Gateway. El gen, una vez clonado en el vector de clonación (llamado clon de entrada en este método), puede introducirse convenientemente en una variedad de vectores de expresión mediante recombinación.
Marcador seleccionable
El vector lleva un marcador seleccionable para permitir la selección de células transformadas positivamente. La resistencia a los antibióticos se utiliza a menudo como marcador, siendo un ejemplo el gen de la betalactamasa, que confiere resistencia al grupo de penicilinas de antibióticos betalactámicos como la ampicilina. Algunos vectores contienen dos marcadores seleccionables, por ejemplo, el plásmido pACYC177 tiene un gen de resistencia tanto a la ampicilina como a la kanamicina. El vector lanzadera que está diseñado para mantenerse en dos organismos diferentes también puede requerir dos marcadores seleccionables, aunque algunos marcadores seleccionables, como la resistencia a la zeocina y la higromicina B, son efectivos en diferentes tipos de células. También se pueden usar marcadores de selección auxotrófica que permiten que un organismo auxotrófico crezca en un medio de crecimiento mínimo; ejemplos de estos son LEU2 y URA3 que se utilizan con sus correspondientes cepas auxotróficas de levadura.
Otro tipo de marcador seleccionable permite la selección positiva de plásmidos con genes clonados. Esto puede implicar el uso de un gen letal para las células huésped, como barnasa, Ccda y las toxinas parD/parE. Esto normalmente funciona interrumpiendo o eliminando el gen letal durante el proceso de clonación, y los clones fallidos en los que el gen letal aún permanece intacto matarían las células huésped, por lo tanto, solo se seleccionan los clones exitosos.
Gen reportero
Los genes informadores se utilizan en algunos vectores de clonación para facilitar la selección de clones exitosos mediante el uso de características de estos genes que permiten identificar fácilmente el clon exitoso. Dichas características presentes en los vectores de clonación pueden ser el fragmento lacZα para la complementación α en la selección azul-blanca y/o un gen marcador o genes indicadores en marco y flanqueando el MCS para facilitar la producción de proteínas de fusión. Ejemplos de socios de fusión que pueden usarse para la detección son la proteína verde fluorescente (GFP) y la luciferasa.
Elementos para la expresión
No es necesario que un vector de clonación contenga elementos adecuados para la expresión de un gen diana clonado, como un promotor y un sitio de unión ribosomal (RBS); sin embargo, muchos los contienen y pueden funcionar como un vector de expresión. El ADN diana puede insertarse en un sitio que esté bajo el control de un promotor particular necesario para la expresión del gen diana en el huésped elegido. Cuando el promotor está presente, la expresión del gen está preferiblemente estrechamente controlada y es inducible de modo que las proteínas solo se produzcan cuando sea necesario. Algunos promotores comúnmente usados son los promotores T7 y lac. La presencia de un promotor es necesaria cuando se utilizan técnicas de cribado como la selección azul-blanca.
A veces se utilizan vectores de clonación sin promotor y RBS para la secuencia de ADN clonada, por ejemplo, cuando se clonan genes cuyos productos son tóxicos para E. coli células. El promotor y el RBS para la secuencia de ADN clonado también son innecesarios cuando se crea por primera vez una biblioteca de clones genómicos o de ADNc, ya que los genes clonados normalmente se subclonan en un vector de expresión más apropiado si se requiere su expresión.
Algunos vectores están diseñados para la transcripción únicamente sin expresión de proteína heteróloga, por ejemplo, para la producción de ARNm in vitro. Estos vectores se denominan vectores de transcripción. Pueden carecer de las secuencias necesarias para la poliadenilación y la terminación, por lo que no pueden usarse para la producción de proteínas.
Tipos de vectores de clonación
Hay disponible una gran cantidad de vectores de clonación, y la elección del vector puede depender de varios factores, como el tamaño del inserto, el número de copias y el método de clonación. Es posible que el inserto grande no se mantenga estable en un vector de clonación general, especialmente para aquellos con un alto número de copias, por lo tanto, la clonación de fragmentos grandes puede requerir un vector de clonación más especializado.
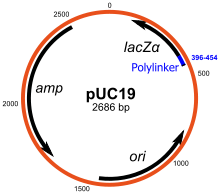
Plásmido
Los plásmidos replican de forma autónoma el ADN extracromosómico circular. Son los vectores de clonación estándar y los más utilizados. La mayoría de los plásmidos generales se pueden usar para clonar insertos de ADN de hasta 15 kb de tamaño. Uno de los primeros vectores de clonación comúnmente utilizados es el plásmido pBR322. Otros vectores de clonación incluyen la serie de plásmidos pUC, y hay disponible una gran cantidad de vectores de plásmidos de clonación diferentes. Muchos plásmidos tienen un alto número de copias, por ejemplo, pUC19 tiene un número de copias de 500-700 copias por célula, y un alto número de copias es útil ya que produce un mayor rendimiento de plásmido recombinante para la manipulación posterior. Sin embargo, los plásmidos con bajo número de copias pueden usarse preferentemente en ciertas circunstancias, por ejemplo, cuando la proteína del gen clonado es tóxica para las células.
Algunos plásmidos contienen un origen de replicación del bacteriófago M13 y pueden usarse para generar ADN monocatenario. Estos se denominan fagémidos, y los ejemplos son la serie pBluescript de vectores de clonación.
Bacteriófago
Los bacteriófagos utilizados para la clonación son el fago λ y el fago M13. Existe un límite superior en la cantidad de ADN que se puede empaquetar en un fago (un máximo de 53 kb), por lo tanto, para permitir la inserción de ADN extraño en el ADN del fago, es posible que sea necesario eliminar algunos genes no esenciales de los vectores de clonación de fagos., por ejemplo, los genes para la lisogenia, ya que el uso del fago λ como vector de clonación implica solo el ciclo lítico. Hay dos tipos de vectores de fagos λ: vector de inserción y vector de reemplazo. Los vectores de inserción contienen un sitio de escisión único en el que se puede insertar ADN extraño con un tamaño de 5 a 11 kb. En los vectores de reemplazo, los sitios de escisión flanquean una región que contiene genes que no son esenciales para el ciclo lítico, y esta región se puede delecionar y reemplazar por el inserto de ADN en el proceso de clonación, y se puede insertar un ADN de mayor tamaño de 8 a 24 kb.
También hay un límite de tamaño más bajo para el ADN que se puede empaquetar en un fago, y el ADN del vector que es demasiado pequeño no se puede empaquetar correctamente en el fago. Esta propiedad se puede usar para la selección: el vector sin inserción puede ser demasiado pequeño, por lo tanto, solo los vectores con inserción se pueden seleccionar para la propagación.
Cósmido
Los cósmidos son plásmidos que incorporan un segmento de ADN del bacteriófago λ que tiene el sitio final cohesivo (cos) que contiene los elementos necesarios para empaquetar el ADN en partículas λ. Bajo un origen de replicación apto (ori), puede replicarse como un plásmido. Normalmente se usa para clonar grandes fragmentos de ADN entre 28 y 45 Kb.
Cromosoma artificial bacteriano
El tamaño de inserción de hasta 350 kb se puede clonar en un cromosoma artificial bacteriano (BAC). Los BAC se mantienen en E. coli con un número de copias de solo 1 por celda. Los BAC se basan en el plásmido F, otro cromosoma artificial llamado PAC se basa en el fago P1.
Cromosoma artificial de levadura
Los cromosomas artificiales de levadura se utilizan como vectores para clonar fragmentos de ADN de más de 1 mega base (1 Mb = 1000 kb) de tamaño. Son útiles en la clonación de fragmentos de ADN más grandes, según se requiera en el mapeo de genomas, como en el Proyecto Genoma Humano. Contiene una secuencia telomérica, una secuencia de replicación autónoma (características requeridas para replicar cromosomas lineales en células de levadura). Estos vectores también contienen sitios de restricción adecuados para clonar ADN extraño, así como genes para usar como marcadores seleccionables.
Cromosoma artificial humano
El cromosoma artificial humano puede ser potencialmente útil como vector de transferencia de genes para la entrega de genes en células humanas y como herramienta para estudios de expresión y determinación de la función del cromosoma humano. Puede transportar fragmentos de ADN muy grandes (no hay un límite superior de tamaño para fines prácticos), por lo tanto, no tiene el problema de la capacidad de clonación limitada de otros vectores, y también evita la posible mutagénesis por inserción causada por la integración en los cromosomas del huésped por parte del virus. vector.
Vectores virales animales y vegetales
Los virus que infectan células animales y vegetales también se han manipulado para introducir genes extraños en células animales y vegetales. La capacidad natural de los virus para adsorberse en las células, introducir su ADN y replicarse los ha convertido en vehículos ideales para transferir ADN extraño a células eucariotas en cultivo. Se utilizó un vector basado en el virus Simian 40 (SV40) en el primer experimento de clonación con células de mamífero. Se han utilizado varios vectores basados en otro tipo de virus como los adenovirus y el virus del papiloma para clonar genes en mamíferos. Actualmente, los vectores retrovirales son populares para clonar genes en células de mamíferos. En el caso de plantas como el virus del mosaico de la coliflor, el virus del mosaico del tabaco y los virus Gemini se han utilizado con un éxito limitado.

Proyección: ejemplo de la pantalla azul/blanca
Muchos vectores de uso general, como pUC19, suelen incluir un sistema para detectar la presencia de un fragmento de ADN clonado, basado en la pérdida de un fenotipo fácilmente puntuable. El más utilizado es el gen que codifica para E. coli β-galactosidasa, cuya actividad puede detectarse fácilmente por la capacidad de la enzima que codifica para hidrolizar el sustrato soluble e incoloro X-gal (5-bromo-4-cloro-3-indolil-beta-d- galactósido) en un producto azul insoluble (5,5'-dibromo-4,4'-dicloro índigo). La clonación de un fragmento de ADN dentro de la secuencia lacZα basada en el vector de la β-galactosidasa evita la producción de una enzima activa. Si se incluye X-gal en las placas de agar selectivo, las colonias transformantes son generalmente azules en el caso de un vector sin ADN insertado y blancas en el caso de un vector que contiene un fragmento de ADN clonado.
Contenido relacionado
Mummichog
Plasma sanguíneo
Apariencia física humana