Valoración
Valoración (también conocida como titulación y análisis volumétrico) es un método de laboratorio común de análisis químico cuantitativo para determinar la concentración de un analito (sustancia a analizar). Se prepara un reactivo, denominado titulador o titulador, como una solución estándar de concentración y volumen conocidos. El titulador reacciona con una solución de analito (que también puede denominarse titulante) para determinar la concentración del analito. El volumen de valorante que reaccionó con el analito se denomina volumen de valoración.
Historia y etimología
La palabra "titulación" desciende de la palabra francesa titrer (1543), que significa la proporción de oro o plata en monedas o en obras de oro o plata; es decir, una medida de finura o pureza. Tiltre se convirtió en títre, que pasó a significar la "finura del oro aleado", y luego la "concentración de una sustancia en un determinado muestra". En 1828, el químico francés Joseph Louis Gay-Lussac utilizó por primera vez titre como verbo (titrer), que significa "determinar la concentración de una sustancia en un determinado muestra".
El análisis volumétrico se originó a finales del siglo XVIII en Francia. François-Antoine-Henri Descroizilles (fr) desarrolló la primera bureta (que era similar a un cilindro graduado) en 1791. Gay-Lussac desarrolló una versión mejorada de la bureta que incluía un brazo lateral e inventó los términos "pipeta& #34; y "bureta" en un documento de 1824 sobre la estandarización de las soluciones de índigo. La primera bureta verdadera fue inventada en 1845 por el químico francés Étienne Ossian Henry (1798–1873). Una mejora importante del método y la popularización del análisis volumétrico se debió a Karl Friedrich Mohr, quien rediseñó la bureta en una forma simple y conveniente, y escribió el primer libro de texto sobre el tema, Lehrbuch der chemisch-analytischen Titrirmethode (Libro de texto de métodos de titulación de química analítica), publicado en 1855.
Procedimiento
Una valoración típica comienza con un vaso de precipitados o un matraz Erlenmeyer que contiene una cantidad muy precisa del analito y una pequeña cantidad de indicador (como fenolftaleína) colocados debajo de una bureta calibrada o una jeringa de pipeteo químico que contiene el valorante. Luego se agregan pequeños volúmenes del valorante al analito y al indicador hasta que el indicador cambia de color en reacción al umbral de saturación del valorante, lo que representa la llegada al punto final de la valoración, lo que significa que la cantidad de valorante equilibra la cantidad de analito presente, de acuerdo con el reacción entre los dos. Según el punto final deseado, una sola gota o menos de una sola gota del titulador pueden marcar la diferencia entre un cambio permanente o temporal en el indicador.
Técnicas de preparación
Las titulaciones típicas requieren que el valorante y el analito estén en forma líquida (solución). Aunque los sólidos generalmente se disuelven en una solución acuosa, otros solventes como el ácido acético glacial o el etanol se usan para fines especiales (como en petroquímica, que se especializa en petróleo). Los analitos concentrados a menudo se diluyen para mejorar la precisión.
Muchas valoraciones no ácido-base requieren un pH constante durante la reacción. Por lo tanto, se puede agregar una solución tampón a la cámara de titulación para mantener el pH.
En los casos en que dos reactivos en una muestra puedan reaccionar con el titulador y solo uno sea el analito deseado, se puede agregar una solución de enmascaramiento separada a la cámara de reacción que elimina el efecto del ion no deseado.
Algunas reacciones de reducción-oxidación (redox) pueden requerir el calentamiento de la solución de muestra y la titulación mientras la solución aún está caliente para aumentar la velocidad de reacción. Por ejemplo, la oxidación de algunas soluciones de oxalato requiere un calentamiento a 60 °C (140 °F) para mantener una velocidad de reacción razonable.
Curvas de titulación
Una curva de titulación es una curva en el gráfico cuya coordenada x representa el volumen de titrante agregado desde el comienzo de la titulación, y la coordenada y de que representa la concentración del analito en la etapa correspondiente de la titulación (en una titulación ácido-base, la coordenada y generalmente representa el pH de la solución).
En una titulación ácido-base, la curva de titulación representa la fuerza del ácido y la base correspondientes. Para un ácido fuerte y una base fuerte, la curva será relativamente suave y muy empinada cerca del punto de equivalencia. Debido a esto, un pequeño cambio en el volumen de titulador cerca del punto de equivalencia da como resultado un gran cambio de pH y muchos indicadores serían apropiados (por ejemplo, tornasol, fenolftaleína o azul de bromotimol).
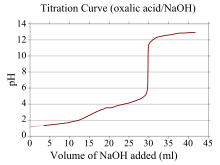
Si un reactivo es un ácido o base débil y el otro es un ácido o base fuerte, la curva de titulación es irregular y el pH cambia menos con pequeñas adiciones de titulante cerca del punto de equivalencia. Por ejemplo, se muestra la curva de titulación para la titulación entre ácido oxálico (un ácido débil) e hidróxido de sodio (una base fuerte). El punto de equivalencia ocurre entre pH 8-10, lo que indica que la solución es básica en el punto de equivalencia y sería apropiado un indicador como la fenolftaleína. Las curvas de titulación correspondientes a bases débiles y ácidos fuertes se comportan de manera similar, siendo la solución ácida en el punto de equivalencia y siendo los indicadores como el naranja de metilo y el azul de bromotimol los más apropiados.
Las valoraciones entre un ácido débil y una base débil tienen curvas de valoración que son muy irregulares. Debido a esto, es posible que ningún indicador definido sea apropiado y, a menudo, se usa un medidor de pH para monitorear la reacción.
El tipo de función que se puede usar para describir la curva se denomina función sigmoidea.
Tipos de valoraciones
Hay muchos tipos de titulaciones con diferentes procedimientos y objetivos. Los tipos más comunes de titulación cualitativa son las titulaciones ácido-base y las titulaciones redox.
Valoración ácido-base
| Indicador | Color en lado ácido | Rango de cambio de color (pH) | Color en el lado básico |
|---|---|---|---|
| Methyl violet | Amarillo | 0,0–1,6 | Violet |
| Bromophenol azul | Amarillo | 3.0 a 4.6 | Azul |
| Metil naranja | Rojo | 3.1 a 4.4 | Amarillo |
| Metil rojo | Rojo | 4.4 a 6.3 | Amarillo |
| Litmus | Rojo | 5.0-8.0 | Azul |
| Bromothymol azul | Amarillo | 6.0 a 7,6 | Azul |
| Phenolphthalein | Incoloro | 8,3 a 1,0 | Rosa |
| Alizarin amarillo | Amarillo | 10.1 a 12,0 | Rojo |
Las valoraciones ácido-base dependen de la neutralización entre un ácido y una base cuando se mezclan en solución. Además de la muestra, se agrega un indicador de pH apropiado a la cámara de titulación, que representa el rango de pH del punto de equivalencia. El indicador ácido-base indica el punto final de la titulación cambiando de color. El punto final y el punto de equivalencia no son exactamente iguales porque el punto de equivalencia está determinado por la estequiometría de la reacción, mientras que el punto final es solo el cambio de color del indicador. Por lo tanto, una selección cuidadosa del indicador reducirá el error del indicador. Por ejemplo, si el punto de equivalencia está en un pH de 8,4, entonces se usaría el indicador de fenolftaleína en lugar de amarillo de alizarina porque la fenolftaleína reduciría el error del indicador. Los indicadores comunes, sus colores y el rango de pH en el que cambian de color se dan en la tabla anterior. Cuando se requieren resultados más precisos, o cuando los reactivos son un ácido débil y una base débil, se utiliza un medidor de pH o un medidor de conductancia.
Para bases muy fuertes, como reactivos de organolitio, amidas metálicas e hidruros, el agua generalmente no es un solvente adecuado y los indicadores cuyo pKa está en el rango de cambios de pH acuosos son de poca utilidad. En su lugar, el valorante y el indicador utilizados son ácidos mucho más débiles y se utilizan disolventes anhidros como el THF.
El pH aproximado durante la titulación puede ser aproximado por tres tipos de cálculos. Antes de comenzar la titración, la concentración de [H+]{displaystyle {ce {}}} se calcula en solución acuosa de ácido débil antes de añadir cualquier base. Cuando el número de lunares de bases añadidos equivale al número de lunares de ácido inicial o así llamado punto de equivalencia, uno de hidrólisis y el pH se calcula de la misma manera que se calcularon las bases conjugadas del ácido titrado. Entre puntos de partida y finales, [H+]{displaystyle {ce {}}} se obtiene de la ecuación Henderson-Hasselbalch y la mezcla de la titación se considera como búfer. En Henderson-Hasselbalch la ecuación [ácido] y [base] se dice que son las molaridades que habrían estado presentes incluso con disociación o hidrolisis. En un búfer, [H+]{displaystyle {ce {}}} se puede calcular exactamente pero la disociación de HA, la hidrolisis de A− − {displaystyle {ce {}}}} y la auto-ionización del agua debe tenerse en cuenta. Hay que utilizar cuatro ecuaciones independientes:
- [H+][Oh.− − ]=10− − 14{fnK} {fnK}}=10^{-14}
- [H+]=Ka[HA][A− − ]{displaystyle [{ce {fn}}=K_{ce {frac {fnh}{} {fnh}{} {fn} {fnh} {fnh00}} {fnK}} {fnh}}} {fnh}} {cfnh}} {fnfnh}}}}}}} {fnf}}}}}}}}}} {ccccccccccccccccccccccccccc}}}}}} {cccccccccccccccccc}}}}}}}}} {ccccccccccc}}}}}}}}} - Sí.
- [HA]+[A− − ]=()nA+nB)V{displaystyle [{ce {fn}]+[{ce {c}]={frac {fn_{c}= {fn}= {fnc {fnfnh}}fnfnfnfnc}fnfnh} {fn} {fn}} {fn}} {fn}}} {fn}}} {c}}} {c}}}}}} {c}}}}} {c}}}}} {c}}} {c}}}} {c}}}}} {c}}}}}}}}}}} {}}}} {}}}}} {}}}}}}} {}}}}}}}}}} {}}}}}}} {}}}}}} {}}}}}}} {}}}}}}} {}}}}}}}}} {}}}}}}}}}}} {} {}}}}} {}}}}}}}}}}}}} {}}}}}}}}}}}} {}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}
- [H+]+nBV=[A− − ]+[Oh.− − ]{displaystyle [{ce {H+}]+{frac {cHFF} {B}} {fn} {fnK}} {fn}}} {fn}}} {f}} {f}} {f}}}} {f}}}} {fn}}}}}} {f}}}} {f}}} {f}}}}}}}} {c}}}}}}}}}}}}}}}}}}}}}}} {}}} {c}}}}}}}}}}}}}}}}}}} {} {c}}}}} {c}}}} {c}}}}}}}}}}}}}}}}} {c} {c}}} {c}}}} {c} {c} {c}}}}}} {c} {c}}}}}}}}} {c}}}}}}}}}} {c}}} {c}}}}}}} [A-}]+ [{ce {fn]}
En las ecuaciones, nA{displaystyle No. y nB{displaystyle No. son los topos de ácido (HA) y sal (XA donde X es la cación), respectivamente, utilizada en el búfer, y el volumen de solución es V. La ley de acción masiva se aplica a la ionización del agua y la disociación del ácido para derivar las ecuaciones primera y segunda. El equilibrio de masa se utiliza en la tercera ecuación, donde la suma de V[HA]{displaystyle V[{ce {}}} y V[A− − ]{displaystyle V[{ce {}}}} debe igual al número de lunares de ácido disuelto y base, respectivamente. El balance de carga se utiliza en la cuarta ecuación, donde el lado izquierdo representa la carga total de las caciones y el lado derecho representa la carga total de los aniones: nBV{fnMicrosoft {fn_# {fnfnMicrosoft {fn_fnfn\fn\\fn\\fn\fnfn\\fnfn\fn\\fn\\fn\\\fn\\\\\fn\\\\\\\\\\\\\\\fn\\\\\fn\\\\\\\\\\\fn\\\\\\\fn\\\\\\\\\\\\\\fn\\\\\\\\\\\\\\\\\ - Sí. es la molaridad de la cación (por ejemplo sodio, si la sal de sodio del ácido o hidróxido de sodio se utiliza para hacer el búfer).
Valoración redox
Las valoraciones redox se basan en una reacción de reducción-oxidación entre un agente oxidante y un agente reductor. Normalmente se utiliza un potenciómetro o un indicador redox para determinar el punto final de la titulación, como cuando uno de los componentes es el agente oxidante dicromato de potasio. El cambio de color de la solución de naranja a verde no es definitivo, por lo que se utiliza un indicador como la difenilamina sódica. El análisis de los vinos para el dióxido de azufre requiere yodo como agente oxidante. En este caso, el almidón se usa como indicador; se forma un complejo azul de almidón-yodo en presencia de exceso de yodo, lo que indica el punto final.
Algunas valoraciones redox no requieren indicador, debido al color intenso de los constituyentes. Por ejemplo, en permanganometría, un ligero color rosa persistente señala el punto final de la titulación debido al color del permanganato de potasio del agente oxidante en exceso. En yodometría, a concentraciones suficientemente grandes, la desaparición del ion triyoduro de color marrón rojizo intenso puede utilizarse como criterio de valoración, aunque a concentraciones más bajas la sensibilidad mejora añadiendo indicador de almidón, que forma un complejo azul intenso con el triyoduro.
Valoración en fase gaseosa
Las valoraciones en fase gaseosa son valoraciones realizadas en la fase gaseosa, específicamente como métodos para determinar especies reactivas por reacción con un exceso de algún otro gas, que actúa como valorante. En una titulación en fase gaseosa común, el ozono gaseoso se titula con óxido de nitrógeno según la reacción
- O3 + NO → O2 + NO2.
Una vez completada la reacción, se cuantifican el valorante y el producto restantes (p. ej., mediante espectroscopia de transformada de Fourier) (FT-IR); esto se utiliza para determinar la cantidad de analito en la muestra original.
La titulación en fase gaseosa tiene varias ventajas sobre la espectrofotometría simple. En primer lugar, la medida no depende de la longitud del camino, porque se utiliza la misma longitud del camino para medir tanto el exceso de titulador como el producto. En segundo lugar, la medición no depende de un cambio lineal en la absorbancia en función de la concentración del analito, tal como lo define la ley de Beer-Lambert. En tercer lugar, es útil para muestras que contienen especies que interfieren en las longitudes de onda que normalmente se usan para el analito.
Valoración complejométrica
Las valoraciones complejométricas se basan en la formación de un complejo entre el analito y el titulador. En general, requieren indicadores complexométricos especializados que formen complejos débiles con el analito. El ejemplo más común es el uso del indicador de almidón para aumentar la sensibilidad de la titulación yodométrica, siendo el complejo azul oscuro del almidón con yodo y yoduro más visible que el yodo solo. Otros indicadores complexométricos son Eriochrome Black T para la valoración de iones de calcio y magnesio, y el agente quelante EDTA utilizado para valorar iones metálicos en solución.
Valoración de potencial zeta
Las titulaciones de potencial zeta son titulaciones en las que la finalización se controla mediante el potencial zeta, en lugar de un indicador, para caracterizar sistemas heterogéneos, como los coloides. Uno de los usos es determinar el punto isoeléctrico cuando la carga superficial se vuelve cero, lo que se logra cambiando el pH o agregando surfactante. Otro uso es determinar la dosis óptima para la floculación o estabilización.
Ensayo
Un ensayo es un tipo de titulación biológica que se utiliza para determinar la concentración de un virus o una bacteria. Las diluciones en serie se realizan en una muestra en una proporción fija (como 1:1, 1:2, 1:4, 1:8, etc.) hasta que la última dilución no dé una prueba positiva para la presencia del virus. El valor positivo o negativo puede determinarse mediante la inspección visual de las células infectadas bajo un microscopio o mediante un método inmunoenzimétrico como el ensayo inmunoabsorbente ligado a enzimas (ELISA). Este valor se conoce como el título.
Medir el punto final de una titulación
Diferentes métodos para determinar el punto final incluyen:
- Indicador: Una sustancia que cambia el color en respuesta a un cambio químico. Un indicador de base ácido (por ejemplo, fenolphthalein) cambia de color dependiendo del pH. También se utilizan indicadores de redox. Una gota de solución indicadora se añade a la titación al principio; el punto final se ha alcanzado cuando el color cambia.
- Potentímetro: Un instrumento que mide el potencial electrodo de la solución. Estos se utilizan para las titraciones redox; el potencial del electrodo de trabajo cambiará repentinamente a medida que se alcanza el punto final.
- p Medidor H: Un potenciómetro con un electrodo cuyo potencial depende de la cantidad de H+ ion presente en la solución. (Este es un ejemplo de un electrodo ion-selectivo.) El pH de la solución se mide a lo largo de la titulación, más exacto que con un indicador; en el punto final habrá un cambio repentino en el pH medido.
- Conductividad: Medición de iones en una solución. La concentración de iones puede cambiar significativamente en una titulación, lo que cambia la conductividad. (Por ejemplo, durante una titación de base ácida, el H+ y OH− iones reaccionan a forma neutral H2O.) Como la conducta total depende de todos los iones presentes en la solución y no todos los iones contribuyen por igual (debido a la movilidad y la fuerza iónica), predecir el cambio de conductividad es más difícil que medirlo.
- Cambio de color: En algunas reacciones, la solución cambia de color sin ningún indicador añadido. Esto se ve a menudo en las titraciones redox cuando los diferentes estados de oxidación del producto y reaccionante producen diferentes colores.
- Precipitación: Si una reacción produce un sólido, un precipitado se formará durante la titación. Un ejemplo clásico es la reacción entre Ag+ and Cl− para formar la sal insoluble AgCl. Los precipitados nublados generalmente hacen difícil determinar el punto final precisamente. Para compensar, las titraciones de precipitación a menudo tienen que hacerse como titraciones "back" (ver abajo).
- Calómetro de la titración histérica: Un instrumento que mide el calor producido o consumido por la reacción para determinar el punto final. Se utiliza en titraciones bioquímicas, como la determinación de cómo sustratos se unen a enzimas.
- Titrimetría termométrica: Diferenciada de la titrimetría calométrica porque el calor de la reacción (como se indica por el aumento de temperatura o la caída) no se utiliza para determinar la cantidad de analito en la solución de la muestra. En cambio, el punto final está determinado por la tasa de cambio de temperatura.
- Espectroscopia: Se utiliza para medir la absorción de la luz por la solución durante la titulación si se conoce el espectro del reaccionante, titrant o producto. La concentración del material puede ser determinada por la Ley de Cerveza.
- Amperometría: mide la corriente producida por la reacción de la titración como resultado de la oxidación o reducción del analito. El punto final se detecta como un cambio en la corriente. Este método es más útil cuando se puede reducir el exceso de titrant, como en la titración de los halides con Ag+.
Punto final y punto de equivalencia
Aunque los términos punto de equivalencia y punto final a menudo se usan indistintamente, son términos diferentes. Punto de equivalencia es la finalización teórica de la reacción: el volumen de valorante añadido en el que el número de moles de valorante es igual al número de moles de analito, o algún múltiplo del mismo (como en los ácidos polipróticos). Punto final es lo que realmente se mide, un cambio físico en la solución determinado por un indicador o un instrumento mencionado anteriormente.
Hay una ligera diferencia entre el punto final y el punto de equivalencia de la titulación. Este error se denomina error de indicador y es indeterminado.
Valoración inversa
La titulación inversa es una titulación realizada a la inversa; en lugar de valorar la muestra original, se añade a la solución un exceso conocido de reactivo estándar y se valora el exceso. Una titulación inversa es útil si el punto final de la titulación inversa es más fácil de identificar que el punto final de la titulación normal, como ocurre con las reacciones de precipitación. Las valoraciones por retroceso también son útiles si la reacción entre el analito y el titulador es muy lenta, o cuando el analito se encuentra en un sólido no soluble.
Métodos gráficos
El proceso de titulación crea soluciones con composiciones que van desde el ácido puro hasta la base pura. Identificar el pH asociado con cualquier etapa del proceso de titulación es relativamente simple para bases y ácidos monopróticos. La presencia de más de un grupo ácido o base complica estos cálculos. Los métodos gráficos, como el equilígrafo, se han utilizado durante mucho tiempo para explicar la interacción de los equilibrios acoplados.
Usos particulares
Valoraciones ácido-base
- Para el combustible biodiesel: el aceite vegetal de desecho (WVO) debe ser neutralizado antes de que se pueda procesar un lote. Una parte de WVO se titrated con una base para determinar la acidez, por lo que el resto del lote puede ser neutralizado correctamente. Esto elimina los ácidos grasos libres del WVO que normalmente reaccionan para hacer jabón en lugar de combustible biodiesel.
- Método Kjeldahl: una medida de contenido de nitrógeno en una muestra. El nitrógeno orgánico se digiere en amoníaco con ácido sulfato sulfato sulfato de potasio. Por último, el amoníaco está retratado con ácido bórico y luego carbonato de sodio.
- Valor ácido: la masa en miligramos de hidróxido de potasio (KOH) requerido para titrar completamente un ácido en un gramo de muestra. Un ejemplo es la determinación del contenido libre de ácido graso.
- Valor de Saponificación: la masa en miligramos de KOH requerido para saponificar un ácido graso en un gramo de muestra. La Saponificación se utiliza para determinar la longitud media de cadena de ácidos grasos en grasa.
- Valor ester (o índice ester): un índice calculado. Valor Ester = Valor de Saponificación – Valor ácido.
- Valor de amina: la masa en miligramos de KOH igual al contenido de amina en un gramo de muestra.
- Valor hidroxil: la masa en miligramos de KOH correspondiente a grupos hidroxiles en un gramo de muestra. El analyte es acetilado usando anhídrido acético y luego tetratado con KOH.
Valoraciones redox
- Prueba Winkler para oxígeno disuelto: Se utiliza para determinar la concentración de oxígeno en el agua. El oxígeno en muestras de agua se reduce mediante el sulfato manganeso (II), que reacciona con el yoduro de potasio para producir yodo. El yodo se libera en proporción al oxígeno en la muestra, por lo que la concentración de oxígeno se determina con una titración redox de yodo con thiosulfate utilizando un indicador de almidón.
- Vitamina C: También conocido como ácido ascórbico, la vitamina C es un poderoso agente de reducción. Su concentración se puede identificar fácilmente cuando se titra con el tinte azul Dichlorophenolindophenol (DCPIP) que se vuelve incoloro cuando se reduce por la vitamina.
- Reactivo de Benedicto: El exceso de glucosa en la orina puede indicar diabetes en un paciente. El método de Benedicto es el método convencional para cuantificar la glucosa en la orina utilizando un reactivo preparado. Durante este tipo de titración, la glucosa reduce los iones cúbicos a los iones colosales que reaccionan con el ticianato potasio para producir un precipitado blanco, indicando el punto final.
- Número de bromo: Una medida de insaturación en un analito, expresada en miligramos de bromo absorbido por 100 gramos de muestra.
- Número de yodo: Una medida de insaturación en un analyte, expresada en gramos de yodo absorbido por 100 gramos de muestra.
Varios
- Karl Fischer titration: Un método potentiométrico para analizar las cantidades de agua en una sustancia. Una muestra se disuelve en el metanol, y se titula con Karl Fischer reagente. El reactivo contiene yodo, que reacciona proporcionalmente con agua. Así, el contenido de agua se puede determinar mediante la vigilancia del potencial eléctrico del exceso de yodo.
Contenido relacionado
Congelación
Serina
Lawrence




![{displaystyle {ce {[H+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)

![{displaystyle [{ce {H+}}][{ce {OH-}}]=10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64e80f918a64e1000aa161c7f047b046ed20149)
![{displaystyle [{ce {H+}}]=K_{a}{ce {{frac {[HA]}{[A^{-}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d401c8135577b043dbcb08c4ebc4b3340ce8430)
![{displaystyle [{ce {HA}}]+[{ce {A-}}]={frac {(n_{{ce {A}}}+n_{{ce {B}}})}{V}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1515a6091588b1b119a198b28d6d1908decca748)
![{displaystyle [{ce {H+}}]+{frac {n_{{ce {B}}}}{V}}=[{ce {A-}}]+[{ce {OH-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60c7344bbd50c9a75dcb598142e874aa39349a93)


![{displaystyle V[{ce {HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2580ec25274d91056971bfecc5c37718436f9c1)
![{displaystyle V[{ce {A-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45100d92fd8e282f61ee30e05034cbe2853523dd)



