Plástico
Los plásticos son una amplia gama de materiales sintéticos o semisintéticos que utilizan polímeros como ingrediente principal. Su plasticidad hace posible... (leer más)
Los valores A son valores numéricos utilizados en la determinación de la orientación más estable de los átomos en una molécula (análisis conformacional), así como una representación general del volumen estérico. Los valores A se derivan de las mediciones de energía de las diferentes conformaciones de ciclohexano de un producto químico de ciclohexano monosustituido. Los sustituyentes en un anillo de ciclohexano prefieren residir en la posición ecuatorial a la axial. La diferencia en la energía libre de Gibbs (ΔG) entre la conformación de mayor energía (sustitución axial) y la conformación de menor energía (sustitución ecuatorial) es el valor A para ese sustituyente en particular.
Los valores A ayudan a predecir la conformación de los anillos de ciclohexano. La conformación más estable será aquella que tenga el sustituyente o sustituyentes ecuatoriales. Cuando se toman en consideración múltiples sustituyentes, se favorece la conformación en la que el sustituyente con el mayor valor A es ecuatorial.
 Un sustituyente metilo tiene un valor A significativamente menor que un sustituyente
Un sustituyente metilo tiene un valor A significativamente menor que un sustituyente
terc -butilo; por lo tanto, la conformación más estable tiene el
terc -butilo en la posición ecuatorial.
La utilidad de los valores A se puede generalizar para su uso fuera de las conformaciones de ciclohexano. Los valores A pueden ayudar a predecir el efecto estérico de un sustituyente. En general, cuanto mayor sea el valor A de un sustituyente, mayor será el efecto estérico de ese sustituyente. Un grupo metilo tiene un valor A de 1,74, mientras que el grupo terc - butilo tiene un valor A de ~5. Debido a que el valor A del terc - butilo es mayor, el terc - butilo tiene un efecto estérico mayor que el metilo. Esta diferencia en los efectos estéricos se puede utilizar para ayudar a predecir la reactividad en las reacciones químicas.
Los efectos estéricos juegan un papel importante en la asignación de configuraciones en los ciclohexanos. Se pueden utilizar obstáculos estéricos para determinar la propensión de un sustituyente a residir en el plano axial o ecuatorial. Se sabe que los enlaces axiales están más obstaculizados que los enlaces ecuatoriales correspondientes. Esto se debe a que los sustituyentes en la posición axial están relativamente cerca de otros dos sustituyentes axiales. Esto hace que esté muy lleno cuando los sustituyentes voluminosos se orientan en la posición axial. Estos tipos de interacciones estéricas se conocen comúnmente como interacciones 1,3 diaxiales. Estos tipos de interacciones no están presentes con sustituyentes en la posición ecuatorial.
En general, se consideran tres contribuciones principales a la energía libre conformacional:
Al comparar la estabilidad relativa, las interacciones de 6 y 7 átomos se pueden utilizar para aproximar las diferencias de entalpía entre conformaciones. Cada interacción de 6 átomos vale 0,9 kcal/mol (3,8 kJ/mol) y cada interacción de 7 átomos vale 4 kcal/mol (17 kJ/mol).

Las líneas discontinuas indican las interacciones de 6 átomos que se encuentran en esta conformación de etilciclohexano, que asciende a aproximadamente 2,7 kcal/mol (11 kJ/mol) en el término entálpico de energía libre.

Las líneas discontinuas aquí significan las interacciones de 7 átomos, que aportan aproximadamente 8 kcal/mol (33 kJ/mol) al término entálpico, lo que hace que esta conformación tenga una energía irrealmente alta.
La entropía también juega un papel en la preferencia de un sustituyente por la posición ecuatorial. El componente entrópico está determinado por la siguiente fórmula:
Donde σ es igual al número de microestados disponibles para cada conformación.
 Posibles conformaciones axiales del etilciclohexano.
Posibles conformaciones axiales del etilciclohexano.
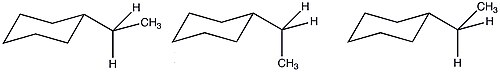 Posibles conformaciones ecuatoriales del etilciclohexano.
Posibles conformaciones ecuatoriales del etilciclohexano.
Debido a la mayor cantidad de conformaciones posibles del etilciclohexano, el valor A se reduce de lo que se predeciría basándose únicamente en términos entálpicos. Debido a estas condiciones entrópicas favorables, la relevancia estérica de un grupo etilo es similar a la de un sustituyente metilo.
| sustituyente | Un valor | sustituyente | Un valor | sustituyente | Un valor | ||
|---|---|---|---|---|---|---|---|
| D | 0.006 | CH 2 HAB | 1.79 | OSi(CH 3) 3 | 0.74 | ||
| F | 0.15 | CH(CH 3) 2 | 2.15 | OH | 0.87 | ||
| cl | 0.43 | cC 6 H 11 | 2.15 | OC 3 | 0.6 | ||
| hermano | 0.38 | C(CH 3) 3 | >4 | TOC 3 | 0.56 | ||
| yo | 0.43 | Ph | 3 | OCH 2 CH 3 | 0.9 | ||
| CN | 0.17 | CO2H _ _ | 1.35 | O-Ac | 0.6 | ||
| CAROLINA DEL NORTE | 0.21 | CO2 _ | 1.92 | O-TFA | 0,68 | ||
| suboficial | 0.51 | CO2CH3 _ _ _ | 1.27 | OCHO | 0.27 | ||
| SNC | 0.28 | CO2Et _ _ | 1.2 | O-T | 0.5 | ||
| N=C=NR | 1 | CO2 Pr _ | 0,96 | ONO 2 | 0.59 | ||
| Canal 3 | 1.7 | COCl | 1.25 | NH 2 | 1.6 | ||
| CF 3 | 2.1 | COCHE 3 | 1.17 | NHCH 3 | 1 | ||
| CH 2 CH 3 | 1.75 | SH | 0.9 | N(CH 3) 2 | 2.1 | ||
| CH=CH 2 | 1.35 | PYME | 0.7 | NH 3 | 1.9 | ||
| CCH | 0.41 | SPh | 0.8 | Nº 2 | 1.1 | ||
| CH 2 Bu | 2 | S | 1.3 | HgBr | ~0 | ||
| CH 2 OT | 1.75 | SOPH | 1.9 | HgCl | 0.3 | ||
| SO 2 Ph | 2.5 | Si(CH 3) 3 | 2.5 |
Uno de los experimentos originales realizados por Winston y Holness fue medir la tasa de oxidación en anillos sustituidos trans y cis utilizando un catalizador de cromo. El gran grupo terc -butilo utilizado bloquea la conformación de cada molécula, colocándola ecuatorial (se muestra el compuesto cis).
 Posibles conformaciones de silla de
Posibles conformaciones de silla de
cis -4-
terc -butil-1-ciclohexanol
Se observó que el compuesto cis se oxidaba a un ritmo mucho más rápido que el compuesto trans. La proposición era que el gran grupo hidroxilo en la posición axial estaba desfavorecido y formaba el carbonilo más fácilmente para aliviar esta tensión. El compuesto trans tenía tasas idénticas a las encontradas en el ciclohexanol monosustituido.
 Oxidación de cromo de
Oxidación de cromo de
cis -4-
terc -butil-1-ciclohexanol
Usando los valores A de la subunidad hidroxilo e isopropilo, se puede calcular el valor energético de un enlace de hidrógeno intramolecular favorable.
 Posibles conformaciones de silla y el enlace de hidrógeno favorable disponible en la conformación donde ambos sustituyentes hidroxilo son ecuatoriales
Posibles conformaciones de silla y el enlace de hidrógeno favorable disponible en la conformación donde ambos sustituyentes hidroxilo son ecuatoriales
Los valores A se miden usando un anillo de ciclohexano monosustituido y son una indicación de solo los estéricos que un sustituyente particular imparte a la molécula. Esto conduce a un problema cuando existen posibles factores electrónicos estabilizadores en un sistema diferente. El sustituyente de ácido carboxílico que se muestra a continuación es axial en el estado fundamental, a pesar de un valor A positivo. A partir de esta observación, está claro que existen otras posibles interacciones electrónicas que estabilizan la conformación axial.
 Representación de equilibrio de un tirón de silla de un ácido carboxílico. Se prefiere la posición axial debido a factores electrónicos favorables, a pesar de un sesgo estérico que favorece la posición ecuatorial.
Representación de equilibrio de un tirón de silla de un ácido carboxílico. Se prefiere la posición axial debido a factores electrónicos favorables, a pesar de un sesgo estérico que favorece la posición ecuatorial.
Es importante señalar que los valores A no predicen el tamaño físico de una molécula, solo el efecto estérico. Por ejemplo, el grupo terc -butilo (valor A=4,9) tiene un valor A mayor que el grupo trimetilsililo (valor A=2,5), pero el grupo terc - butilo en realidad ocupa menos espacio. Esta diferencia se puede atribuir a la mayor longitud del enlace carbono-silicio en comparación con el enlace carbono-carbono del grupo terc - butilo. El enlace más largo permite menos interacciones con los sustituyentes vecinos, lo que efectivamente hace que el grupo trimetilsililo tenga menos obstáculos estéricos, lo que reduce su valor A. Esto también se puede ver al comparar los halógenos. El bromo, el yodo y el cloro tienen valores A similares, aunque sus radios atómicos difieren.Entonces, los valores A predicen el tamaño aparente de un sustituyente, y los tamaños aparentes relativos determinan las diferencias en los efectos estéricos entre los compuestos. Por lo tanto, los valores A son herramientas útiles para determinar la reactividad de los compuestos en las reacciones químicas.
Los plásticos son una amplia gama de materiales sintéticos o semisintéticos que utilizan polímeros como ingrediente principal. Su plasticidad hace posible... (leer más)
Gasolina o nafta es un líquido inflamable transparente derivado del petróleo que se usa principalmente como combustible en la mayoría de los motores de... (leer más)
(leer más)