Valencia (química)
En química, la valencia o valencia de un elemento es la medida de su capacidad de combinación con otros átomos cuando forma compuestos químicos o moléculas.
Descripción
La capacidad de combinación o afinidad de un átomo de un elemento determinado está determinada por el número de átomos de hidrógeno con los que se combina. En el metano, el carbono tiene una valencia de 4; en amoníaco, el nitrógeno tiene una valencia de 3; en el agua, el oxígeno tiene una valencia de 2; y en el cloruro de hidrógeno, el cloro tiene una valencia de 1. El cloro, como tiene una valencia de uno, puede sustituirse por hidrógeno. El fósforo tiene una valencia de 5 en el pentacloruro de fósforo, PCl 5. Los diagramas de valencia de un compuesto representan la conectividad de los elementos, con líneas dibujadas entre dos elementos, a veces llamados enlaces, que representan una valencia saturada para cada elemento. Las dos tablas siguientes muestran algunos ejemplos de diferentes compuestos, sus diagramas de valencia y las valencias de cada elemento del compuesto.
| Compuesto | H 2Hidrógeno | CH4 Metano _ | C 3 H 8Propano | C 2 H 2Acetileno |
|---|---|---|---|---|
| Diagrama |  | 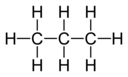 | ||
| Valencias | Hidrógeno: 1 | Carbono: 4Hidrógeno: 1 | Carbono: 4Hidrógeno: 1 | Carbono: 4Hidrógeno: 1 |
| Compuesto | NH 3Amoníaco | NaCNcianuro de sodio | H2S Sulfuro dehidrógeno | H 2 SO 4Ácido sulfúrico | Cl 2 O 7Heptóxido de dicloro | Tetróxido de xenón XeO 4 |
|---|---|---|---|---|---|---|
| Diagrama |  | 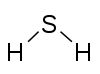 |  |  |  | |
| Valencias | Nitrógeno: 3Hidrógeno: 1 | sodio: 1Carbono: 4Nitrógeno: 3 | Azufre: 2Hidrógeno: 1 | Azufre: 6Oxígeno: 2Hidrógeno: 1 | Cloro: 7Oxígeno: 2 | Xenón: 8Oxígeno: 2 |
Definiciones modernas
La IUPAC define la valencia como:El número máximo de átomos univalentes (originalmente átomos de hidrógeno o de cloro) que pueden combinarse con un átomo del elemento considerado, o con un fragmento, o que pueden sustituirse por un átomo de este elemento.
Una descripción moderna alternativa es:El número de átomos de hidrógeno que se pueden combinar con un elemento en un hidruro binario o el doble del número de átomos de oxígeno que se combinan con un elemento en su óxido u óxidos.
Esta definición difiere de la definición de la IUPAC en que se puede decir que un elemento tiene más de una valencia.
Una definición moderna muy similar dada en un artículo reciente define la valencia de un átomo particular en una molécula como "la cantidad de electrones que un átomo usa para unirse", con dos fórmulas equivalentes para calcular la valencia:valencia = número de electrones en la capa de valencia del átomo libre – número de electrones no enlazantes en el átomo en la molécula,
yvalencia = número de enlaces + carga formal.
Desarrollo historico
La etimología de las palabras valencia (valencias en plural ) y valencia (valencias en plural ) se remonta a 1425, y significa "extracto, preparación", del latín valentia "fuerza, capacidad", del anterior valor "valía, valor" y el químico El significado que se refiere al "poder combinador de un elemento" se registra a partir de 1884, del alemán Valenz.
El concepto de valencia se desarrolló en la segunda mitad del siglo XIX y ayudó a explicar con éxito la estructura molecular de los compuestos inorgánicos y orgánicos. La búsqueda de las causas subyacentes de la valencia condujo a las teorías modernas del enlace químico, incluido el átomo cúbico (1902), las estructuras de Lewis (1916), la teoría del enlace de valencia (1927), los orbitales moleculares (1928), la teoría de la repulsión del par de electrones de la capa de valencia. (1958), y todos los métodos avanzados de la química cuántica.
En 1789, William Higgins publicó puntos de vista sobre lo que llamó combinaciones de partículas "últimas", que presagiaron el concepto de enlaces de valencia. Si, por ejemplo, según Higgins, la fuerza entre la última partícula de oxígeno y la última partícula de nitrógeno fuera 6, entonces la fuerza de la fuerza se dividiría en consecuencia, y lo mismo para las otras combinaciones de partículas últimas (ver ilustración).
Sin embargo, el comienzo exacto de la teoría de las valencias químicas se remonta a un artículo de 1852 de Edward Frankland, en el que combinó la teoría radical más antigua con pensamientos sobre la afinidad química para mostrar que ciertos elementos tienen la tendencia a combinarse con otros elementos para forman compuestos que contienen 3, es decir, en los grupos de 3 átomos (p. ej., NO 3, NH 3, NI 3, etc.) o 5, es decir, en los grupos de 5 átomos (p. ej., NO 5, NH 4 O, PO 5, etc.), equivalentes de los elementos adjuntos. Según él, esta es la manera en que mejor se satisfacen sus afinidades, y siguiendo estos ejemplos y postulados, declara cuán obvio es que
Una tendencia o ley prevalece (aquí), y que, sin importar cuáles puedan ser los caracteres de los átomos que se unen, el poder de combinación del elemento que atrae, si se me permite el término, siempre se satisface con el mismo número de estos átomos..
Este "poder de combinación" se denominó luego cuantivalencia o valencia (y valencia por los químicos estadounidenses). En 1857, August Kekulé propuso valencias fijas para muchos elementos, como 4 para el carbono, y las utilizó para proponer fórmulas estructurales para muchas moléculas orgánicas, que todavía se aceptan en la actualidad.
La mayoría de los químicos del siglo XIX definieron la valencia de un elemento como el número de sus enlaces sin distinguir diferentes tipos de valencia o enlace. Sin embargo, en 1893 Alfred Werner describió complejos de coordinación de metales de transición como [Co(NH 3) 6 ]Cl 3, en los que distinguió valencias principales y subsidiarias (en alemán: 'Hauptvalenz' y 'Nebenvalenz'), correspondientes a los conceptos modernos de estado de oxidación y número de coordinación respectivamente.
Para los elementos del grupo principal, en 1904, Richard Abegg consideró las valencias positivas y negativas (estados de oxidación máximos y mínimos) y propuso la regla de Abegg en el sentido de que su diferencia es a menudo 8.
Electrones y valencia
El modelo de Rutherford del átomo nuclear (1911) mostró que el exterior de un átomo está ocupado por electrones, lo que sugiere que los electrones son responsables de la interacción de los átomos y la formación de enlaces químicos. En 1916, Gilbert N. Lewis explicó la valencia y el enlace químico en términos de una tendencia de los átomos (del grupo principal) a lograr un octeto estable de 8 electrones de capa de valencia. Según Lewis, el enlace covalente genera octetos al compartir electrones, y el enlace iónico genera octetos al transferir electrones de un átomo a otro. El término covalencia se atribuye a Irving Langmuir, quien afirmó en 1919 que "el número de pares de electrones que un átomo dado comparte con los átomos adyacentes se denomina covalencia de ese átomo". El prefijo co-significa "juntos", por lo que un enlace covalente significa que los átomos comparten una valencia. Después de eso, ahora es más común hablar de enlaces covalentes en lugar de valencia, que ha dejado de usarse en trabajos de alto nivel debido a los avances en la teoría del enlace químico, pero todavía se usa ampliamente en estudios elementales, donde proporciona una introducción heurística al tema.
En la década de 1930, Linus Pauling propuso que también existen enlaces covalentes polares, que son intermedios entre covalentes e iónicos, y que el grado de carácter iónico depende de la diferencia de electronegatividad de los dos átomos enlazados.
Pauling también consideró moléculas hipervalentes, en las que los elementos del grupo principal tienen valencias aparentes mayores que el máximo de 4 permitido por la regla del octeto. Por ejemplo, en la molécula de hexafluoruro de azufre (SF 6), Pauling consideró que el azufre forma 6 enlaces verdaderos de dos electrones utilizando orbitales atómicos híbridos sp d, que combinan un orbital s, tres p y dos d. Sin embargo, más recientemente, los cálculos de mecánica cuántica en esta y otras moléculas similares han demostrado que el papel de los orbitales d en el enlace es mínimo, y que la molécula de SF 6 debe describirse como que tiene 6 enlaces covalentes polares (en parte iónicos) hechos de solo cuatro orbitales sobre el azufre (uno s y tres p) de acuerdo con la regla del octeto, junto con seis orbitales sobre los flúor.Cálculos similares en moléculas de metales de transición muestran que el papel de los orbitales p es menor, de modo que un orbital s y cinco d en el metal son suficientes para describir el enlace.
Valencias comunes
Para los elementos de los principales grupos de la tabla periódica, la valencia puede variar entre 1 y 7.
| Grupo | Valencia 1 | Valencia 2 | Valencia 3 | Valencia 4 | Valencia 5 | Valencia 6 | Valencia 7 | Valencia 8 | Valencias típicas |
|---|---|---|---|---|---|---|---|---|---|
| 1 (yo) | NaCl | 1 | |||||||
| 2 (II) | MgCl2 _ | 2 | |||||||
| 13 (III) | BCl 3AlCl 3Al 2 O 3 | 3 | |||||||
| 14 (IV) | CO | Canal 4 | 4 | ||||||
| 15 (V) | NO | NH 3PH 3como 2 O 3 | Nº 2 | N 2 O 5PCl 5 | 3 y 5 | ||||
| 16 (VI) | H 2 OH 2 S | TAN 2 | TAN 3 | 2 y 6 | |||||
| 17 (VIII) | HCl | HClO2 _ | ClO2 _ | HClO3 _ | Cl 2 O 7 | 1 y 7 | |||
| 18 (VII) | Xeo 4 | 8 |
Muchos elementos tienen una valencia común relacionada con su posición en la tabla periódica, y hoy en día esto se racionaliza mediante la regla del octeto. Los prefijos numéricos griegos/latinos (mono-/uni-, di-/bi-, tri-/ter-, etc.) se utilizan para describir iones en los estados de carga 1, 2, 3, etc., respectivamente. La polivalencia o multivalencia se refiere a especies que no están restringidas a un número específico de enlaces de valencia. Las especies con una sola carga son univalentes (monovalentes). Por ejemplo, el catión Cs es un catión univalente o monovalente, mientras que el catión Ca es un catión divalente y el catión Fe es un catión trivalente. A diferencia de Cs y Ca, Fe también puede existir en otros estados de carga, en particular 2+ y 4+, y por lo tanto se conoce como un ion multivalente (polivalente). Los metales de transición y los metales de la derecha suelen ser multivalentes, pero no existe un patrón simple que prediga su valencia.
| Valencia | Adjetivo más común‡ | Adjetivo sinónimo menos común‡§ |
|---|---|---|
| 0-valente | cerovalente | no valente |
| 1-valente | monovalente | univalente |
| bivalente | bivalente | bivalente |
| trivalente | trivalente | tervalente |
| 4-valente | tetravalente | tetravalente |
| 5-valente | pentavalente | quinquevalente /quinquivalente |
| 6-valente | hexavalente | sexvalente |
| 7-valente | heptavalente | septival |
| 8-valente | octavalente | — |
| 9-valente | no avalente | — |
| 10-valente | decavalente | — |
| múltiple / muchos / variable | polivalente | multivalente |
| juntos | covalente | — |
| no juntos | no covalente | — |
† Los mismos adjetivos también se usan en medicina para referirse a la valencia de la vacuna, con la ligera diferencia de que en este último sentido, quadri- es más común que tetra-.
‡ Como lo demuestran los recuentos de visitas en la búsqueda web de Google y los corpus de búsqueda de Google Books (consultado en 2017).
§ Se pueden encontrar algunas otras formas en corpus extensos del idioma inglés (por ejemplo, *quintavalente, *quintivalent, *decivalente), pero no son las formas establecidas convencionalmente en inglés y, por lo tanto, no se ingresan en los principales diccionarios.
Valencia versus estado de oxidación
Debido a la ambigüedad del término valencia, actualmente se prefieren otras notaciones. Además del sistema de estados de oxidación (también llamados números de oxidación) como se usa en la nomenclatura estándar para compuestos de coordinación, y la notación lambda, como se usa en la nomenclatura de química inorgánica de la IUPAC, el estado de oxidación es una indicación más clara del estado electrónico de los átomos en una molécula
El estado de oxidación de un átomo en una molécula da el número de electrones de valencia que ha ganado o perdido. A diferencia del número de valencia, el estado de oxidación puede ser positivo (para un átomo electropositivo) o negativo (para un átomo electronegativo).
Los elementos en un alto estado de oxidación pueden tener una valencia superior a cuatro. Por ejemplo, en los percloratos, el cloro tiene siete enlaces de valencia; el rutenio, en el estado de oxidación +8 en tetróxido de rutenio, tiene ocho enlaces de valencia.
Ejemplos
| Compuesto | Fórmula | Valencia | Estado de oxidación |
|---|---|---|---|
| Cloruro de hidrogeno | HCl | H = 1 Cl = 1 | H = +1 Cl = −1 |
| Ácido perclórico * | HClO4 _ | H = 1 Cl = 7 O = 2 | H = +1 Cl = +7 O = −2 |
| hidruro de sodio | NaH | Na = 1 H = 1 | Na = +1 H = −1 |
| Óxido ferroso ** | Fe O | FE = 2 O = 2 | Fe = +2 O = −2 |
| Óxido férrico ** | Fe 2 O 3 | FE = 3 O = 2 | Fe = +3 O = −2 |
* El ion perclorato univalente (ClO4) tiene valencia 1.** El óxido de hierro aparece en una estructura cristalina, por lo que no se puede identificar una molécula típica. En el óxido ferroso, el Fe tiene el estado de oxidación II; en óxido férrico, estado de oxidación III.
| Compuesto | Fórmula | Valencia | Estado de oxidación |
|---|---|---|---|
| Cloro | Clase 2 | Cl = 1 | Cl = 0 |
| Peróxido de hidrógeno | H 2 O 2 | H = 1 O = 2 | H = +1 O = −1 |
| Acetileno | C 2 H 2 | C = 4 H = 1 | C = −1 H = +1 |
| Cloruro de mercurio(I) | Hg 2 Cl 2 | Hg = 2 Cl = 1 | Hg = +1 Cl = −1 |
Las valencias también pueden ser diferentes de los valores absolutos de los estados de oxidación debido a la diferente polaridad de los enlaces. Por ejemplo, en el diclorometano, CH 2 Cl 2, el carbono tiene valencia 4 pero estado de oxidación 0.
Definición de "Número máximo de bonos"
Frankland consideró que la valencia (utilizó el término "atomicidad") de un elemento era un valor único que correspondía al valor máximo observado. El número de valencias no utilizadas en los átomos de lo que ahora se denomina elementos del bloque p es generalmente uniforme, y Frankland sugirió que las valencias no utilizadas se saturaban entre sí. Por ejemplo, el nitrógeno tiene una valencia máxima de 5, al formar amoníaco se dejan dos valencias sin unir; el azufre tiene una valencia máxima de 6, en la formación de sulfuro de hidrógeno se dejan cuatro valencias sin unir.
La Unión Internacional de Química Pura y Aplicada (IUPAC) ha realizado varios intentos para llegar a una definición inequívoca de valencia. La versión actual, adoptada en 1994:El número máximo de átomos univalentes (originalmente átomos de hidrógeno o de cloro) que pueden combinarse con un átomo del elemento considerado, o con un fragmento, o que pueden sustituirse por un átomo de este elemento.
El hidrógeno y el cloro se usaron originalmente como ejemplos de átomos univalentes, debido a su naturaleza para formar un solo enlace simple. El hidrógeno tiene solo un electrón de valencia y puede formar solo un enlace con un átomo que tiene una capa externa incompleta. El cloro tiene siete electrones de valencia y solo puede formar un enlace con un átomo que dona un electrón de valencia para completar la capa exterior del cloro. Sin embargo, el cloro también puede tener estados de oxidación de +1 a +7 y puede formar más de un enlace donando electrones de valencia.
El hidrógeno tiene un solo electrón de valencia, pero puede formar enlaces con más de un átomo. En el ion bifluoruro ([HF2]), por ejemplo, forma un enlace de cuatro electrones de tres centros con dos átomos de fluoruro:[ F–HF ↔ F H–F ]
Otro ejemplo es el enlace de dos electrones de tres centros en diborano (B 2 H 6).
Contenido relacionado
Grupo de vinilo
Reacción de condensación
Hidronio