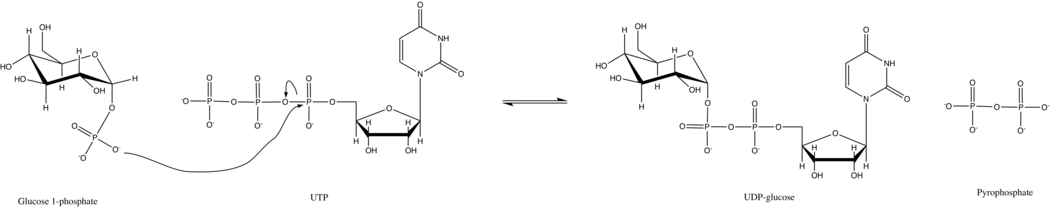
UTP—glucosa-1-fosfato uridiltransferasa
UTP—glucosa-1-fosfato uridililtransferasa también conocida como glucosa-1-fosfato uridililtransferasa (o UDP–glucosa pirofosforilasa) es una enzima que participa en el metabolismo de los carbohidratos. Sintetiza UDP-glucosa a partir de glucosa-1-fosfato y UTP; es decir,
- glucosa-1-fosfato + UTP UDP-glucosa + pirofosfato
La UTP-glucosa-1-fosfato uridiltransferasa es una enzima que se encuentra en los tres dominios (bacterias, eucariotas y arqueas) ya que es un actor clave en la glucogénesis y la síntesis de la pared celular. Su papel en el metabolismo del azúcar se ha estudiado ampliamente en plantas con el fin de comprender el crecimiento de las plantas y aumentar la producción agrícola. Recientemente, se ha estudiado y cristalizado la UTP-glucosa-1-fosfato uridiltransferasa humana, lo que revela un tipo de regulación diferente al de otros organismos estudiados previamente. Su importancia se deriva de los muchos usos de la UDP-glucosa, incluido el metabolismo de la galactosa, la síntesis de glucógeno, la síntesis de glucoproteínas y la síntesis de glucolípidos.
Estructura
La estructura de la UTP-glucosa-1-fosfato uridiltransferasa es significativamente diferente entre procariotas y eucariotas, pero dentro de los eucariotas, las estructuras primaria, secundaria y terciaria de la enzima están bastante conservadas. En muchas especies, la UTP-glucosa-1-fosfato uridiltransferasa se encuentra como un homopolímero que consiste en subunidades idénticas en una estructura cuaternaria simétrica. El número de subunidades varía entre especies: por ejemplo, en Escherichia coli, la enzima se encuentra como un tetrámero, mientras que en Burkholderia xenovorans, la enzima es dimérica. En humanos y en levaduras, la enzima es activa como un octámero que consiste en dos tetrámeros apilados uno sobre otro con residuos hidrofóbicos conservados en las interfaces entre las subunidades. En contraste, la enzima en plantas tiene residuos cargados conservados que forman la interfaz entre las subunidades.
En los seres humanos, cada subunidad enzimática contiene varios residuos (L113, N251 y N328) que están altamente conservados en los eucariotas. Un motivo de plegamiento de Rossman participa en la unión del nucleótido UTP y un dominio de unión al azúcar (residuos T286–G293) se coordina con el anillo de glucosa. Una mutación sin sentido (G115D) en la región de la enzima que contiene el sitio activo (que está conservada en los eucariotas) provoca una disminución drástica de la actividad enzimática in vitro.
- Estructura de cristal de UTP - glucosa-1-fosfato uridylyltransferase de Burkholderia xenovorans
- UTP humano: glucosa-1-fosfato uridylyltransferase isoform 1 subunidad con UDP-glucosa
Ejemplos
Los genes humanos que codifican proteínas con actividad UTP (glucosa-1-fosfato uridiltransferasa) incluyen dos isoformas con pesos moleculares de 56,9 y 55,7 kDa, respectivamente.
Función
La UTP-glucosa-1-fosfato uridiltransferasa es ubicua en la naturaleza debido a su importante papel en la generación de UDP-glucosa, un compuesto central en el metabolismo de los carbohidratos. En las hojas de las plantas, la UTP-glucosa-1-fosfato uridiltransferasa es una parte clave de la vía de biosíntesis de la sacarosa, suministrando uridina difosfato glucosa a la sacarosa-fosfato sintasa, que convierte la UDP-glucosa y la D-fructosa 6-fosfato en sacarosa-6-fosfato. También puede ser parcialmente responsable de la descomposición de la sacarosa en otros tejidos utilizando UDP-glucosa.
En los animales superiores, la enzima es muy activa en los tejidos implicados en la glucogénesis, incluidos el hígado y los músculos. Una excepción es el cerebro, que tiene altos niveles de glucógeno pero una baja actividad específica de UTP (glucosa-1-fosfato uridiltransferasa). En las células animales, la UTP (glucosa-1-fosfato uridiltransferasa) se encuentra predominantemente en el citoplasma.
La UTP-glucosa-1-fosfato uridiltransferasa también es necesaria para el metabolismo de la galactosa en animales y microorganismos. En el metabolismo de la galactosa, la enzima galactosa-1-fosfato uridiltransferasa transfiere un fosfato de UDP-glucosa a galactosa-1-fosfato para producir UDP-galactosa, que luego se convierte en UDP-glucosa. Las bacterias con UTP-glucosa-1-fosfato uridiltransferasa defectuosa no pueden incorporar galactosa en sus paredes celulares.
Mecanismo
En la reacción primaria de esta enzima, el grupo fosfato de la glucosa-1-fosfato reemplaza el enlace fosfoanhídrido del UTP. Esta reacción es fácilmente reversible y la energía libre de Gibbs es cercana a cero. Sin embargo, en condiciones celulares típicas, la pirofosfatasa inorgánica hidroliza rápidamente el producto pirofosfato e impulsa la reacción mediante el principio de Le Chatelier.
UTP—glucosa-1-fosfato uridiltransferasa utiliza un mecanismo Bi Bi secuencial ordenado tanto para las reacciones directas como para las inversas. En la levadura, la enzima sigue una cinética simple de Michaelis-Menten y no muestra cooperatividad entre las subunidades del octámero.
De manera similar a otras nucleotidiltransferasas de azúcar, la actividad de la UTP (uridiltransferasa de glucosa-1-fosfato) requiere dos cationes divalentes para estabilizar la unión de los grupos fosfato con carga negativa. El magnesio suele desempeñar esta función, pero otros iones como el manganeso (II), el cobalto (II) y el níquel (II) también pueden sustituirlo con una reducción de aproximadamente el 75 % de la actividad óptima. Los experimentos de cristalografía de rayos X han demostrado que un ion Mg2+ está coordinado por un oxígeno de fosforilo en la glucosa 1-fosfato y por un oxígeno de fosforilo α en la UTP. Además de estabilizar los fosfatos con carga negativa, se cree que el Mg2+ orienta la glucosa 1-fosfato para el ataque nucleofílico del fósforo α de la UTP.
Reglamento
Aunque funcionalmente son similares en todas las especies, la UDP-glucosa pirofosforilasa tiene diferentes estructuras y mecanismos de regulación en diferentes organismos.
Microorganismos
En la levadura, la UTP (glucosa-1-fosfato uridiltransferasa) está regulada por fosforilación por la cinasa PAS. Esta fosforilación es reversible y controla la distribución del flujo de azúcar hacia el glucógeno y la síntesis de la pared celular.
Plantas
La UTP (glucosa-1-fosfato uridiltransferasa) en las plantas se regula a través de la oligomerización y posiblemente de la fosforilación. En la cebada, se ha demostrado que la UDP-glucosa pirofosforilasa solo es activa en forma monomérica, pero forma fácilmente oligómeros, lo que sugiere que la oligomerización puede ser una forma de regulación de la enzima. En el arroz, el estrés por frío disminuye la N-glicosilación de la enzima, lo que se cree que altera la actividad de la enzima en respuesta al frío.
En Arabidopsis, existen dos isoenzimas de UTP (glucosa-1-fosfato uridiltransferasa): UGP1 y UGP2. Estas dos isoenzimas tienen actividades casi idénticas y difieren en solo 32 aminoácidos, todos ellos ubicados en la superficie externa de la proteína, lejos del sitio activo. Estas pequeñas diferencias pueden permitir una regulación alostérica diferencial de la actividad de las isoenzimas. UGP1 y UGP2 se expresan de manera diferencial en diferentes partes de la planta. La expresión de UGP1 se expresa ampliamente en la mayoría de los tejidos, mientras que UGP2 se expresa principalmente en las flores, lo que sugiere que UGP1 es la forma principal de la enzima y UGP2 cumple una función auxiliar. De hecho, la expresión de UGP2 aumenta en respuesta a factores estresantes como la deficiencia de fosfato, lo que indica que UGP2 probablemente funciona como respaldo de UGP1 cuando la planta está bajo estrés ambiental.
Animales
El control de la actividad de la UTP-glucosa-1-fosfato uridiltransferasa se logra principalmente por medios genéticos (es decir, regulación de la transcripción y la traducción). Al igual que la mayoría de las enzimas, la UTP-glucosa-1-fosfato uridiltransferasa es inhibida por su producto, la UDP-glucosa. Sin embargo, la enzima no está sujeta a una regulación alostérica significativa, lo cual es lógico dado el uso generalizado de la UDP-glucosa en una variedad de vías metabólicas.
Humanos
En los seres humanos, la UDP-glucosa pirofosforilasa es activa como un octámero. La actividad de la enzima también se modifica mediante la O-glicosilación. Al igual que en otras especies de mamíferos, existen dos isoformas diferentes en los seres humanos que se producen mediante el empalme alternativo del gen. Las isoformas difieren en solo 11 aminoácidos en el extremo N y no se han identificado diferencias significativas en su actividad funcional.
Importancia de la enfermedad
En los seres humanos, la galactosemia es un trastorno que afecta el desarrollo de los recién nacidos y los niños, ya que no pueden metabolizar adecuadamente el azúcar galactosa. Se especula que la sobreexpresión de la UDP-glucosa pirofosforilasa puede aliviar los síntomas en los seres humanos con galactosemia.
En las células cancerosas, que suelen tener tasas elevadas de glucólisis y un contenido reducido de glucógeno, la actividad de la UTP-glucosa-1-fosfato uridiltransferasa suele estar regulada a la baja hasta en un 50-60 % en comparación con las células normales. La actividad anormalmente baja de la UTP-glucosa-1-fosfato uridiltransferasa se debe a la disminución de los niveles de la enzima y a la regulación a la baja de otras enzimas en la vía glucogénica, incluidas la glucógeno sintasa y la fosfoglucomutasa.
Se ha descubierto que la UTP (glucosa-1-fosfato uridiltransferasa) es un importante factor de virulencia en una variedad de patógenos, entre ellos bacterias y protozoos. Por ejemplo, se ha descubierto que la enzima es necesaria para la biosíntesis del polisacárido capsular, un importante factor de virulencia de Streptococcus pneumoniae, una bacteria que causa neumonía, bronquitis y otros problemas respiratorios. Como resultado, la enzima ha atraído la atención como un objetivo potencial para productos farmacéuticos. Sin embargo, para lograr especificidad, los medicamentos deben diseñarse para dirigirse específicamente a sitios alostéricos en la superficie de la proteína porque el sitio activo está altamente conservado en todas las especies.
Recientemente se ha descubierto que la UDP-glucosa pirofosforilasa (UGP2) está implicada en un nuevo trastorno del desarrollo neurológico en humanos, también conocido como síndrome de Barakat-Perenthaler. Este trastorno se describió por primera vez en 22 individuos de 15 familias, que presentaban una encefalopatía epiléptica grave, retraso del desarrollo neurológico con ausencia de prácticamente todos los hitos del desarrollo, convulsiones intratables, microcefalia progresiva, alteración visual y dismorfismos menores similares. Barakat y sus colegas identificaron una mutación homocigótica recurrente en todos los individuos afectados (chr2:64083454A > G), que muta el sitio de inicio de la traducción de la isoforma proteica más corta de UGP2. Por lo tanto, la isoforma proteica más corta ya no se puede producir en pacientes que albergan la mutación homocigótica. Los estudios funcionales del mismo grupo mostraron que la isoforma proteica corta se expresa normalmente de forma predominante en el cerebro humano. Por lo tanto, la mutación recurrente conduce a una ausencia específica de tejido de UGP2 en el cerebro, lo que conduce a un metabolismo de glucógeno alterado, una respuesta de proteína desplegada regulada al alza y una diferenciación neuronal prematura. Otras mutaciones bialélicas de pérdida de función en UGP2 son probablemente letales, ya que las células madre embrionarias humanas que carecen de isoformas cortas y largas de UGP2 no logran diferenciarse en cardiomiocitos y células sanguíneas. Por lo tanto, la identificación de esta nueva enfermedad también muestra que las mutaciones de pérdida de inicio específicas de isoformas que causan la pérdida de expresión de una isoforma relevante para el tejido de una proteína esencial pueden causar una enfermedad genética, incluso cuando una ausencia de proteína en todo el organismo es incompatible con la vida. Actualmente no existe una terapia para el síndrome de Barakat-Perenthaler.Referencias
- ^ Sandhoff K, van Echten G, Schröder M, Schnabel D, Suzuki K (agosto de 1992). "Metabolismo de los glucólipidos: el papel de las proteínas de unión glucolípido en la función y la patobioquímica de los lysosomes". Transacciones de la Sociedad Bioquímica. 20 3): 695 –9. doi:10.1042/bst0200695. PMID 1426613.
- ^ Alonso MD, Lomako J, Lomako WM, Whelan WJ (septiembre de 1995). "Una nueva mirada a la biogénesis del glucógeno". FASEB Journal. 9 (12): 1126–37. doi:10.1096/fasebj.9.12.7672505. PMID 7672505. S2CID 40281321.
- ^ a b c Führing JI, Cramer JT, Schneider J, Baruch P, Gerardy-Schahn R, Fedorov R (abril de 2015). "Un mecanismo cuaternario permite las complejas funciones biológicas de la pirofosforilasa UDP-glucosa humana octava, una enzima clave en el metabolismo celular". Scientific Reports. 5 (1): 9618. Bibcode:2015NatSR...5E9618F. doi:10.1038/srep09618. PMC 5381698. PMID 25860585.
- ^ Kim H, Choi J, Kim T, Lokanath NK, Ha SC, Suh SW, Hwang HY, Kim KK (abril de 2010). "Base estructural para el mecanismo de reacción de la pirofosforilasa UDP-glucosa". Molecules y Celdas. 29 4): 397 –405. doi:10.1007/s10059-010-0047-6. PMID 20238176. S2CID 25022544.
- ^ a b c Thoden JB, Holden HM (julio de 2007). " Geometría activa del sitio de glucosa-1-fosfato uridylyltransferase". Protein Science. 16 (7): 1379–88. doi:10.1110/ps.072864707. PMC 2206702. PMID 17567737.
- ^ Enfermedad, Seattle Structural Genomics Center for Infectious (2016). "Crystal structure of UDP-glucose pyrophosporylase / UTP-glucose-1-phosphate uridylyltransferase from Burkholderia xenovorans". Worldwide Protein Data Bank. doi:10.2210/pdb5j49/pdb.
- ^ a b Yu Q, Zheng X (marzo de 2012). "La estructura cristalina de la pirofosforilasa UDP-glucosa humana revela un efecto de cierre que influye en la actividad enzimática". The Biochemical Journal. 442 2): 283 –91. doi:10.1042/BJ20111598. PMID 22132858.
- ^ a b Roeben A, Plitzko JM, Körner R, Böttcher UM, Siegers K, Hayer-Hartl M, Bracher A (diciembre de 2006). "Structural basis for subunit assembly in UDP-glucose pyrophosphorylase from Saccharomyces cerevisiae". Journal of Molecular Biology. 364 4): 551 –60. doi:10.1016/j.jmb.2006.08.079. PMID 17010990.
- ^ Kleczkowski LA, Geisler M, Fitzek E, Wilczynska M (noviembre de 2011). "Un plan estructural común para la planta de pirofosforilas que producen azúcar UDP". The Biochemical Journal. 439 3): 375–9. doi:10.1042/BJ20110730. PMID 21992098.
- ^ Flores-Díaz M, Alape-Girón A, Persson B, Pollesello P, Moos M, von Eichel-Streiber C, Thelestam M, Florin I (septiembre de 1997). "Deficiencia celular UDP-glucosa causada por una mutación de un solo punto en el gen de pirofosforilasa UDP-glucosa". El Diario de Química Biológica. 272 (38): 23784–91. doi:10.1074/jbc.272.38.23784. PMID 9295324.
- ^ a b "UGP2 - UTP--glucose-1-phosphate uridylyltransferase - Homo sapiens (Human) - UGP2 gene & protein". www.uniprot.org. Retrieved 2017-03-06.
- ^ Mendicino J (diciembre de 1960). "Sucrosa síntesis de fosfato en trigo germen y hojas verdes". El Diario de Química Biológica. 235 (12): 3347 –52. doi:10.1016/S0021-9258(18)64469-2. PMID 13769376.
- ^ Turnquist, Richard L.; Hansen, R. Gaurth (1973-01-01). "2 Uridine Diphosphoryl Glucose Pyrophosphorylase". En Boyer, Paul D. (ed.). Las Enzimas. Parte A: Nucleotidyl Transfer Nucleosidyl Transfer Acyl Transfer Phosphoryl Transfer. Vol. 8. Academic Press. pp. 51 –71. doi:10.1016/S1874-6047(08)60062-1. ISBN 97801227081.
- ^ Villar-Palasi C, Larner J (marzo de 1960). "Efecto mediado por la insulina en la actividad de transglucosylase de músculo UDPG-glycogen". Biochimica et Biophysica Acta. 39: 171–3. doi:10.1016/0006-3002(60)90142-6. PMID 13842294.
- ^ Bosch AM (agosto de 2006). "La galactosaemia clásica revisitada". Journal of Inherited Metabolic Disease. 29 4): 516 –25. doi:10.1007/s10545-006-0382-0. PMID 16838075. S2CID 16382462.
- ^ Sundararajan TA, Rapin AM, Kalckar HM (diciembre de 1962). "Observaciones bioquímicas sobre E. coli mutantes defectuosos en diphosphoglucose de uridina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 48 (12): 2187 –93. Bibcode:1962PNAS...48.2187S. doi:10.1073/pnas.48.12.2187. PMC 221142. PMID 13979281.
- ^ Tsuboi KK, Fukunaga K, Petricciani JC (febrero de 1969). "Purification and specific kinetic properties of erythrocyte uridine diphosphate glucose pyrophosphorylase". El Diario de Química Biológica. 244 3): 1008 –15. doi:10.1016/S0021-9258(18)91886-7. PMID 5782905.
- ^ Zea CJ, Camci-Unal G, Pohl NL (julio de 2008). "Thermodynamics of binding of divalent magnesium and manganese to uridine phosphates: implications for diabetes-related hipomagnesaemia and carbohydrate biocatalysis". Revista Central de Química. 2 1): 15. doi:10.1186/1752-153x-2-15. PMC 2490692. PMID 18627619.
- ^ Gustafson GL, Gander JE (marzo de 1972). "Uridine diphosphate glucose pyrophosphorylase from Sorghum vulgare. Purificación y propiedades cinéticas". El Diario de Química Biológica. 247 5): 1387 –97. doi:10.1016/S0021-9258(19)45571-3. PMID 5012314.
- ^ Sivaraman J, Sauvé V, Matte A, Cygler M (noviembre de 2002). "La estructura de cristal de Escherichia coli glucosa-1-fosfato timidlyltransferase (RffH) complejo con dTTP y Mg2+". El Diario de Química Biológica. 277 (46): 44214 –9. doi:10.1074/jbc.M206932200. PMID 12171937.
- ^ Rutter J, Probst BL, McKnight SL (octubre de 2002). "Regulación coordinada del flujo de azúcar y traducción por PAS kinase". Celular. 111 1): 17 –28. doi:10.1016/s0092-8674(02)00974-1PMID 12372297. S2CID 6883785.
- ^ Kleczkowski LA, Geisler M, Ciereszko I, Johansson H (marzo de 2004). "UDP-glucosa pirofosforilasa. Una vieja proteína con nuevos trucos". Fisiología vegetal. 134 3): 912 –8. doi:10.1104/pp.103.036053. PMC 523891. PMID 15020755.
- ^ Komatsu S, Yamada E, Furukawa K (enero de 2009). "El estrés clásico cambia el patrón de glucosilación positiva de concanavalina de proteínas expresadas en las partes basales de las cuchillas de arroz". Amino Acids. 36 1): 115 –23. doi:10.1007/s00726-008-0039-4. PMID 18278531. S2CID 1797342.
- ^ Meng M, Geisler M, Johansson H, Harholt J, Scheller HV, Mellerowicz EJ, Kleczkowski LA (mayo de 2009). "UDP-glucose pyrophosphorylase no es limitante de tasa, pero es esencial en Arabidopsis". Fisiología celular. 50 5): 998 –1011. doi:10.1093/pcp/pcp052. PMID 19366709.
- ^ Wells, Lance; Hart, Gerald W. (2003-07-03). "O-GlcNAc cumple veinte años: implicaciones funcionales para la modificación post-translacional de las proteínas nucleares y citosolicas con azúcar". Cartas FEBS. 546 1): 154–158. doi:10.1016/S0014-5793(03)00641-0. ISSN 1873-3468. PMID 128292 S2CID 24587552.
- ^ Duggleby RG, Chao YC, Huang JG, Peng HL, Chang HY (enero de 1996). "Diferencias de secuencia entre los cDNAs del músculo humano y el hígado para la pirofosforilasa UDPglucosa y propiedades cinéticas de las enzimas recombinantes expresadas en Escherichia coli". European Journal of Biochemistry. 235 ()1 –2): 173–9. doi:10.1111/j.1432-1033.1996.00173.x. PMID 8631325.
- ^ Lai K, Elsas LJ (mayo de 2000). "Overexpresión de la pirofosforilasa UDP-glucosa humana rescata galactosa-1-fosfato uridyltransferase- levadura deficiente". Biochemical and Biophysical Research Communications. 271 2): 392 –400. doi:10.1006/bbrc.2000.2629. PMID 10799308.
- ^ Nigam VN, Macdonald HL, Cantero A (febrero 1962). "Los factores de emisión para el almacenamiento de glucógeno en tumores. I. Limitación de enzimas". Cancer Research. 22 2): 131–8. PMID 14479721.
- ^ Jiang SS, Lin TY, Wang WB, Liu MC, Hsueh PR, Liaw SJ (mayo de 2010). "Caracterización de la deshidrogenasa UDP-glucosa y de los mutantes de Pyrofosforilasa UDP-glucosa de Proteus mirabilis: defectividad en la resistencia a la B polimixina, enjambre y virulencia". Agentes antimicrobianos y quimioterapia. 54 5): 2000–9. doi:10.1128/AAC.01384-09. PMC 2863647. PMID 20160049.
- ^ Klein KA, Fukuto HS, Pelletier M, Romanov G, Grabenstein JP, Palmer LE, Ernst R, Bliska JB (Febrero 2012). "Una pantalla de hibridación del sitio transposon identifica a galU y wecBC como importante para la supervivencia de Yersinia pestis en macrófagos murinos". Journal of Bacteriology. 194 3): 653 –62. doi:10.1128/JB.06237-11. PMC 3264090. PMID 22139502.
- ^ Bonofiglio L, García E, Mollerach M (octubre de 2005). "Caracterización bioquímica de la glucosa neumocócica 1-fosfato uridylyltransferase (GalU) esencial para la biosíntesis de la cápsula". Microbiología actual. 51 4): 217–21. doi:10.1007/s00284-005-4466-0. PMID 16132460. S2CID 13591083.
- ^ Perenthaler E, Nikoncuk A, Yousefi S, Berdowski WM, Alsagob M, Capo I, et al. (Marzo 2020). "La pérdida de UGP2 en el cerebro conduce a una encefalopatía epiléptica severa, enfatizando que las mutaciones de pérdida inicial biallélicas de los genes esenciales pueden causar enfermedades genéticas". Acta Neuropathologica. 139 3): 415–442. doi:10.1007/s00401-019-02109-6. PMC 7035241. PMID 31820119.
- ^ "#618744: Encefalopatía epiléptica, Infantil 83 temprano; EIEE83". Herencia Mendeliana en línea en el hombre (OMIM).
Enlaces externos
- UDP+Glucose+Pyrophosphorylase en la Biblioteca Nacional de Medicina de los EE.UU.


