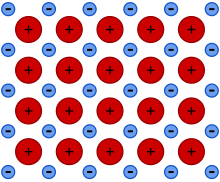
Unión metálica
Enlace metálico es un tipo de enlace químico que surge de la fuerza de atracción electrostática entre los electrones de conducción (en forma de una nube electrónica de electrones deslocalizados) y los iones metálicos cargados positivamente. Puede describirse como el intercambio de electrones libres entre una estructura de iones cargados positivamente (cationes). Los enlaces metálicos son responsables de muchas propiedades físicas de los metales, como la resistencia, la ductilidad, la resistividad y la conductividad térmica y eléctrica, la opacidad y el brillo.
El enlace metálico no es el único tipo de enlace químico que puede presentar un metal, incluso como sustancia pura. Por ejemplo, el galio elemental consta de pares de átomos unidos covalentemente tanto en estado líquido como sólido; estos pares forman una estructura cristalina con enlaces metálicos entre ellos. Otro ejemplo de enlace covalente metal-metal es el ion mercurioso (Hg2+
2).
Historia
A medida que la química se convirtió en una ciencia, quedó claro que los metales formaban la mayor parte de la tabla periódica de los elementos, y se logró un gran progreso en la descripción de las sales que se pueden formar en reacciones con ácidos. Con el advenimiento de la electroquímica, quedó claro que los metales generalmente se disuelven como iones cargados positivamente, y las reacciones de oxidación de los metales se entendieron bien en su serie electroquímica. Surgió una imagen de los metales como iones positivos unidos por un océano de electrones negativos.
Con el advenimiento de la mecánica cuántica, a esta imagen se le dio una interpretación más formal en la forma del modelo de electrones libres y su mayor extensión, el modelo de electrones casi libres. En ambos modelos, los electrones se ven como un gas que viaja a través de la estructura del sólido con una energía que es esencialmente isotrópica, ya que depende del cuadrado de la magnitud, no de la dirección del momento. vector k. En el espacio k tridimensional, el conjunto de puntos de los niveles más altos llenos (la superficie de Fermi) debería ser, por tanto, una esfera. En el modelo casi libre, las zonas de Brillouin en forma de caja se agregan al espacio k por el potencial periódico experimentado por la estructura (iónica), rompiendo así levemente la isotropía.
La llegada de la difracción de rayos X y el análisis térmico hizo posible estudiar la estructura de los sólidos cristalinos, incluidos los metales y sus aleaciones; y diagramas de fase fueron desarrollados. A pesar de todo este progreso, la naturaleza de los compuestos y aleaciones intermetálicas seguía siendo un misterio en gran medida y su estudio a menudo era meramente empírico. Los químicos generalmente se alejaban de cualquier cosa que no pareciera seguir las leyes de proporciones múltiples de Dalton; y el problema se consideró dominio de otra ciencia, la metalurgia.
El modelo de electrones casi libres fue adoptado con entusiasmo por algunos investigadores en este campo, especialmente Hume-Rothery, en un intento de explicar por qué se formaban ciertas aleaciones intermetálicas con ciertas composiciones y otras no. Inicialmente, los intentos de Hume-Rothery tuvieron bastante éxito. Su idea era agregar electrones para inflar el globo esférico de Fermi dentro de la serie de cajas de Brillouin y determinar cuándo una caja determinada estaría llena. Esto predijo una cantidad bastante grande de composiciones de aleación que se observaron más tarde. Tan pronto como se dispuso de la resonancia del ciclotrón y se pudo determinar la forma del globo, se descubrió que la suposición de que el globo era esférico no se sostenía, excepto quizás en el caso del cesio. Este hallazgo redujo muchas de las conclusiones a ejemplos de cómo un modelo a veces puede dar una serie completa de predicciones correctas y aún así estar equivocado.
La debacle de los electrones casi libres mostró a los investigadores que cualquier modelo que supusiera que los iones estaban en un mar de electrones libres necesitaba modificaciones. Por lo tanto, se desarrollaron una serie de modelos mecánicos cuánticos, como los cálculos de estructura de bandas basados en orbitales moleculares o la teoría funcional de la densidad. En estos modelos, uno se aparta de los orbitales atómicos de los átomos neutros que comparten sus electrones o (en el caso de la teoría funcional de la densidad) se aparta de la densidad electrónica total. Sin embargo, la imagen de los electrones libres sigue siendo dominante en la educación.
El modelo de estructura de banda electrónica se convirtió en un enfoque importante no solo para el estudio de los metales, sino aún más para el estudio de los semiconductores. Junto con los estados electrónicos, también se demostró que los estados vibracionales forman bandas. Rudolf Peierls demostró que, en el caso de una fila unidimensional de átomos metálicos, digamos, hidrógeno, tenía que surgir una inestabilidad que conduciría a la ruptura de dicha cadena en moléculas individuales. Esto despertó un interés en la pregunta general: ¿cuándo es estable el enlace metálico colectivo y cuándo ocupará su lugar una forma más localizada de enlace? Mucha investigación se centró en el estudio de la agrupación de átomos metálicos.
A pesar de que el concepto del modelo de estructura de banda demostró ser poderoso para describir el enlace metálico, tiene la desventaja de seguir siendo una aproximación de un electrón de un problema de muchos cuerpos. En otras palabras, los estados de energía de cada electrón se describen como si todos los demás electrones simplemente formaran un fondo homogéneo. Investigadores como Mott y Hubbard se dieron cuenta de que esto quizás era apropiado para electrones s y p fuertemente deslocalizados; pero para los electrones d, y aún más para los electrones f, la interacción con los electrones (y los desplazamientos atómicos) en el entorno local puede volverse más fuerte que la deslocalización que conduce a bandas anchas Por lo tanto, la transición de electrones no apareados localizados a electrones itinerantes que participan en enlaces metálicos se hizo más comprensible.
La naturaleza de la unión metálica
La combinación de dos fenómenos da lugar al enlace metálico: la deslocalización de electrones y la disponibilidad de un número mucho mayor de estados de energía deslocalizados que de electrones deslocalizados. Esto último podría llamarse deficiencia de electrones.
En 2D
El grafeno es un ejemplo de enlace metálico bidimensional. Sus enlaces metálicos son similares a los enlaces aromáticos en benceno, naftaleno, antraceno, ovaleno, etc.
En 3D
La aromaticidad del metal en grupos de metales es otro ejemplo de deslocalización, esta vez a menudo en disposiciones tridimensionales. Los metales llevan el principio de deslocalización al extremo, y se podría decir que un cristal de un metal representa una sola molécula sobre la cual todos los electrones de conducción están deslocalizados en las tres dimensiones. Esto significa que dentro del metal generalmente no se pueden distinguir moléculas, por lo que el enlace metálico no es ni intramolecular ni intermolecular. 'No molecular' tal vez sería un mejor término. El enlace metálico es en su mayoría no polar, porque incluso en las aleaciones hay poca diferencia entre las electronegatividades de los átomos que participan en la interacción del enlace (y, en los metales elementales puros, ninguna). Por lo tanto, el enlace metálico es una forma comunal extremadamente deslocalizada de enlace covalente. En cierto sentido, la unión metálica no es un 'nuevo' tipo de unión en absoluto. Describe el enlace solo como presente en un trozo de materia condensada: ya sea sólido cristalino, líquido o incluso vidrio. Los vapores metálicos, por el contrario, suelen ser atómicos (Hg) o, a veces, contienen moléculas, como Na2, unidas por un enlace covalente más convencional. Por eso no es correcto hablar de un solo 'enlace metálico'.
La deslocalización es más pronunciada para los electrones s y p. La deslocalización en el cesio es tan fuerte que los electrones se liberan virtualmente de los átomos de cesio para formar un gas limitado únicamente por la superficie del metal. Para el cesio, por lo tanto, la imagen de los iones Cs+ unidos por un gas de electrones con carga negativa no es inexacta. Para otros elementos, los electrones son menos libres, ya que todavía experimentan el potencial de los átomos metálicos, a veces con mucha fuerza. Requieren un tratamiento mecánico cuántico más complejo (por ejemplo, enlace fuerte) en el que los átomos se ven como neutros, al igual que los átomos de carbono en el benceno. Para los electrones d, y especialmente f, la deslocalización no es nada fuerte y esto explica por qué estos electrones pueden continuar comportándose como electrones desapareados que retienen su espín, lo que agrega interesantes propiedades magnéticas de estos metales.
Deficiencia de electrones y movilidad
Los átomos de metal contienen pocos electrones en sus capas de valencia en relación con sus periodos o niveles de energía. Son elementos deficientes en electrones y el intercambio comunitario no cambia eso. Quedan muchos más estados de energía disponibles que electrones compartidos. Por lo tanto, se cumplen ambos requisitos de conductividad: fuerte deslocalización y bandas de energía parcialmente llenas. Por lo tanto, tales electrones pueden cambiar fácilmente de un estado de energía a otro ligeramente diferente. Por lo tanto, no solo se deslocalizan, formando un mar de electrones que impregnan la estructura, sino que también pueden migrar a través de la estructura cuando se aplica un campo eléctrico externo, lo que genera conductividad eléctrica. Sin el campo, hay electrones que se mueven por igual en todas las direcciones. Dentro de dicho campo, algunos electrones ajustarán ligeramente su estado, adoptando un vector de onda diferente. En consecuencia, habrá más movimiento en un sentido que en otro y se producirá una corriente neta.
La libertad de los electrones para migrar también les da a los átomos de metal, o capas de ellos, la capacidad de deslizarse entre sí. Localmente, los enlaces pueden romperse fácilmente y reemplazarse por otros nuevos después de una deformación. Este proceso no afecta mucho a la unión metálica comunal, que da lugar a los metales' maleabilidad y ductilidad características. Esto es particularmente cierto para los elementos puros. En presencia de impurezas disueltas, las divisiones que normalmente se forman fácilmente pueden bloquearse y el material se vuelve más duro. El oro, por ejemplo, es muy blando en estado puro (24 quilates), por lo que se prefieren las aleaciones en joyería.
Los metales también suelen ser buenos conductores del calor, pero los electrones de conducción solo contribuyen en parte a este fenómeno. Las vibraciones colectivas (es decir, deslocalizadas) de los átomos, conocidas como fonones que viajan a través del sólido como una onda, contribuyen en mayor medida.
Sin embargo, una sustancia como el diamante, que conduce bastante bien el calor, no es un conductor eléctrico. Esto no es una consecuencia de la ausencia de deslocalización en el diamante, sino simplemente que el carbono no es deficiente en electrones.
La deficiencia de electrones es importante para distinguir los enlaces covalentes metálicos de los más convencionales. Por lo tanto, debemos enmendar la expresión anterior a: El enlace metálico es una forma comunal extremadamente deslocalizada de enlace covalente deficiente en electrones.
Radio metálico
El radio metálico se define como la mitad de la distancia entre los dos iones metálicos adyacentes en la estructura metálica. Este radio depende de la naturaleza del átomo, así como de su entorno, específicamente, del número de coordinación (CN), que a su vez depende de la temperatura y la presión aplicada.
Al comparar tendencias periódicas en el tamaño de los átomos, a menudo es deseable aplicar la llamada corrección de Goldschmidt, que convierte los radios atómicos a los valores que tendrían los átomos si estuvieran coordinados en 12. Dado que los radios metálicos son mayores para el número de coordinación más alto, la corrección para coordinaciones menos densas implica multiplicar por x, donde 0 < x < 1. En concreto, para CN = 4, x = 0,88; para CN = 6, x = 0,96 y para CN = 8, x = 0,97. La corrección lleva el nombre de Victor Goldschmidt, quien obtuvo los valores numéricos citados anteriormente.
Los radios siguen tendencias periódicas generales: disminuyen a lo largo del período debido al aumento de la carga nuclear efectiva, que no se compensa con el aumento del número de electrones de valencia; pero los radios aumentan hacia abajo en el grupo debido a un aumento en el número cuántico principal. Entre los elementos 4d y 5d, se observa la contracción de los lantánidos: hay un aumento muy pequeño del radio hacia abajo del grupo debido a la presencia de orbitales f mal protegidos.
Fuerza del vínculo
Los átomos en los metales tienen una fuerte fuerza de atracción entre ellos. Se requiere mucha energía para superarlo. Por lo tanto, los metales a menudo tienen puntos de ebullición altos, siendo el tungsteno (5828 K) extremadamente alto. Una notable excepción son los elementos del grupo del zinc: Zn, Cd y Hg. Sus configuraciones electrónicas terminan en...ns2, lo que se asemeja a una configuración de gas noble, como la del helio, cada vez más al descender en la tabla periódica, porque el el diferencial de energía a los orbitales np vacíos se vuelve más grande. Por lo tanto, estos metales son relativamente volátiles y se evitan en los sistemas de ultra alto vacío.
De lo contrario, la unión metálica puede ser muy fuerte, incluso en metales fundidos, como el galio. Aunque el galio se derrite con el calor de la mano justo por encima de la temperatura ambiente, su punto de ebullición no está muy lejos del del cobre. El galio fundido es, por lo tanto, un líquido muy no volátil, gracias a su fuerte enlace metálico.
El fuerte enlace de los metales en forma líquida demuestra que la energía de un enlace metálico no depende mucho de la dirección del enlace; esta falta de direccionalidad del enlace es una consecuencia directa de la deslocalización de electrones y se entiende mejor en contraste con el enlace direccional de los enlaces covalentes. Por lo tanto, la energía de un enlace metálico es principalmente una función del número de electrones que rodean al átomo metálico, como lo ejemplifica el modelo del átomo incrustado. Esto generalmente da como resultado que los metales asuman estructuras cristalinas compactas y relativamente simples, como FCC, BCC y HCP.
Con velocidades de enfriamiento lo suficientemente altas y una composición de aleación adecuada, la unión metálica puede ocurrir incluso en vidrios que tienen estructuras amorfas.
Gran parte de la bioquímica está mediada por la interacción débil de iones metálicos y biomoléculas. Tales interacciones y sus cambios conformacionales asociados se han medido mediante interferometría de polarización dual.
Solubilidad y formación de compuestos
Los metales son insolubles en agua o disolventes orgánicos, a menos que reaccionen con ellos. Por lo general, esta es una reacción de oxidación que roba a los átomos metálicos sus electrones itinerantes, destruyendo el enlace metálico. Sin embargo, los metales a menudo son fácilmente solubles entre sí mientras conservan el carácter metálico de su enlace. El oro, por ejemplo, se disuelve fácilmente en mercurio, incluso a temperatura ambiente. Incluso en metales sólidos, la solubilidad puede ser extensa. Si las estructuras de los dos metales son iguales, incluso puede haber una solubilidad sólida completa, como en el caso del electrum, una aleación de plata y oro. A veces, sin embargo, dos metales formarán aleaciones con estructuras diferentes a cualquiera de los dos padres. Uno podría llamar a estos materiales compuestos metálicos. Pero, debido a que los materiales con enlaces metálicos normalmente no son moleculares, la ley de proporciones integrales de Dalton no es válida; ya menudo se puede lograr un rango de relaciones estequiométricas. Es mejor abandonar conceptos tales como 'sustancia pura' o 'soluto' en tales casos y hablar de fases en su lugar. El estudio de tales fases ha sido tradicionalmente más el dominio de la metalurgia que de la química, aunque los dos campos se superponen considerablemente.
Localización y agrupamiento: de vinculación a vinculación
El enlace metálico en compuestos complejos no involucra necesariamente a todos los elementos constituyentes por igual. Es muy posible que uno o más elementos no participen en absoluto. Uno podría imaginarse los electrones de conducción fluyendo a su alrededor como un río alrededor de una isla o una gran roca. Es posible observar qué elementos participan: por ejemplo, observando los niveles centrales en un espectro de espectroscopía de fotoelectrones de rayos X (XPS). Si un elemento participa, sus picos tienden a estar sesgados.
Algunos materiales intermetálicos, por ejemplo, exhiben grupos de metales que recuerdan a las moléculas; y estos compuestos son más un tema de química que de metalurgia. La formación de los grupos podría verse como una forma de 'condensarse' (localizar) el enlace deficiente en electrones en enlaces de una naturaleza más localizada. El hidrógeno es un ejemplo extremo de esta forma de condensación. A altas presiones es un metal. Se podría decir que el núcleo del planeta Júpiter se mantiene unido por una combinación de enlaces metálicos y alta presión inducida por la gravedad. Sin embargo, a presiones más bajas, el enlace se localiza por completo en un enlace covalente regular. La localización es tan completa que resulta el (más familiar) gas H2. Un argumento similar vale para un elemento como el boro. Aunque es deficiente en electrones en comparación con el carbono, no forma un metal. En cambio, tiene una serie de estructuras complejas en las que dominan los grupos icosaédricos B12. Las ondas de densidad de carga son un fenómeno relacionado.
Como estos fenómenos implican el movimiento de los átomos acercándose o alejándose unos de otros, pueden interpretarse como el acoplamiento entre los estados electrónico y vibracional (es decir, los fonones) del material. Se cree que una interacción electrón-fonón diferente conduce a un resultado muy diferente a bajas temperaturas, el de la superconductividad. En lugar de bloquear la movilidad de los portadores de carga formando pares de electrones en enlaces localizados, se forman pares de Cooper que ya no experimentan ninguna resistencia a su movilidad.
Propiedades ópticas
La presencia de un océano de portadores de carga móviles tiene efectos profundos en las propiedades ópticas de los metales, que solo pueden entenderse considerando los electrones como un colectivo, en lugar de considerar los estados de los electrones individuales. involucrados en enlaces covalentes más convencionales.
La luz consiste en una combinación de un campo eléctrico y uno magnético. El campo eléctrico generalmente puede excitar una respuesta elástica de los electrones involucrados en el enlace metálico. El resultado es que los fotones no pueden penetrar mucho en el metal y, por lo general, se reflejan, aunque algunos también pueden absorberse. Esto se aplica por igual a todos los fotones del espectro visible, razón por la cual los metales suelen ser de color blanco plateado o grisáceo con el característico reflejo especular del brillo metálico. El equilibrio entre la reflexión y la absorción determina qué tan blanco o gris es un metal, aunque el deslustre de la superficie puede oscurecer el brillo. La plata, un metal de alta conductividad, es uno de los más blancos.
Las excepciones notables son el cobre rojizo y el oro amarillento. La razón de su color es que existe un límite superior a la frecuencia de la luz a la que los electrones metálicos pueden responder fácilmente: la frecuencia del plasmón. A la frecuencia del plasmón, la función dieléctrica dependiente de la frecuencia del gas de electrones libres va de negativa (reflexión) a positiva (transmisión); los fotones de mayor frecuencia no se reflejan en la superficie y no contribuyen al color del metal. Hay algunos materiales, como el óxido de indio y estaño (ITO), que son conductores metálicos (en realidad semiconductores degenerados) cuyo umbral está en el infrarrojo, por lo que son transparentes en el visible, pero buenos reflectores en el infrarrojo.
Para la plata, la frecuencia límite está en el ultravioleta lejano, pero para el cobre y el oro está más cerca del visible. Esto explica los colores de estos dos metales. En la superficie de un metal, pueden producirse efectos de resonancia conocidos como plasmones de superficie. Son oscilaciones colectivas de los electrones de conducción, como una onda en el océano electrónico. Sin embargo, incluso si los fotones tienen suficiente energía, por lo general no tienen suficiente impulso para poner en movimiento la onda. Por lo tanto, los plasmones son difíciles de excitar en un metal a granel. Esta es la razón por la que el oro y el cobre parecen metales lustrosos aunque con un toque de color. Sin embargo, en el oro coloidal, el enlace metálico se limita a una diminuta partícula metálica, lo que evita que la onda de oscilación del plasmón "se escape". Por lo tanto, la regla de selección del momento se rompe y la resonancia del plasmón provoca una absorción extremadamente intensa en el verde, con un color rojo púrpura resultante. Dichos colores son órdenes de magnitud más intensos que las absorciones ordinarias que se ven en los tintes y similares, que involucran electrones individuales y sus estados de energía.
Contenido relacionado
Química nuclear
Carbonato de potasio
Neurotransmisor monoamina