Triyoduro de nitrógeno
El triyoduro de nitrógeno es un compuesto inorgánico de fórmula NI3. Es un explosivo de contacto extremadamente sensible: pequeñas cantidades explotan con un chasquido fuerte y agudo cuando se tocan aunque sea ligeramente, liberando una nube púrpura de vapor de yodo; incluso puede ser detonado por radiación alfa. NI3 tiene una química estructural compleja que es difícil de estudiar debido a la inestabilidad de los derivados. Aunque el nitrógeno es más electronegativo que el yodo, el compuesto recibió ese nombre debido a su analogía con el compuesto tricloruro de nitrógeno.
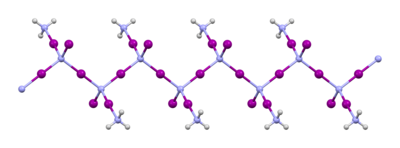
Estructura de NI3 y sus derivados
El triyoduro de nitrógeno se caracterizó por primera vez mediante espectroscopia Raman en 1990, cuando se preparó sin amoníaco. El nitruro de boro reacciona con monofluoruro de yodo en triclorofluorometano a -30 °C para producir NI3 puro con bajo rendimiento:
- BN + 3 IF → NI3 + BF3
NI3 es piramidal (simetría molecular C3v), al igual que los otros trihaluros de nitrógeno y el amoníaco.
El material que suele llamarse "triyoduro de nitrógeno" se prepara por reacción de yodo con amoníaco. Cuando esta reacción se lleva a cabo a bajas temperaturas en amoníaco anhidro, el producto inicial es NI3 · (NH3)5, pero este material pierde algo de amoníaco al calentar para dar el aducto 1:1 NI3 · NH3. Este aducto fue informado por primera vez por Bernard Courtois en 1812, y su fórmula finalmente fue determinada en 1905 por Oswald Silberrad. Su estructura de estado sólido consiste en cadenas de -NI2-I-NI2-I-NI2-I-. Las moléculas de amoníaco están situadas entre las cadenas. Cuando se mantiene frío en la oscuridad y húmedo con amoníaco, NI3 · NH3 es estable.
Descomposición y explosividad
La inestabilidad de NI3 y NI3 · NH3 se puede atribuir a la gran tensión estérica causada por los tres grandes átomos de yodo manteniéndose en proximidad entre sí alrededor del átomo de nitrógeno relativamente pequeño. Esto da como resultado una muy baja energía de activación para su descomposición, reacción aún más favorable debido a la gran estabilidad del N2. El triyoduro de nitrógeno no tiene ningún valor comercial práctico debido a su extrema sensibilidad a los golpes, lo que hace que sea imposible almacenarlo, transportarlo y utilizarlo para explosiones controladas. Mientras que la nitroglicerina pura es poderosa y también muy sensible a los golpes (aunque no tanto como el triyoduro de nitrógeno, que puede activarse con el toque de una pluma), la sensibilidad a los golpes de la nitroglicerina se debió únicamente a los flegmatizantes. reducido y se volvió más seguro de manejar y transportar en forma de dinamita.
La descomposición de NI3 procede de la siguiente manera para dar nitrógeno gaseoso y yodo:
- 2 NI3 s) → N2 g) + 3 I2 g) (290 kJ/mol)
Sin embargo, el material seco es un explosivo de contacto, descomponiéndose aproximadamente de la siguiente manera:
- 8 NI3 · NH3 → 5 N2 + 6 NH4I + 9 I2
De acuerdo con esta ecuación, estas explosiones dejan manchas de yodo de color naranja a púrpura, que se pueden eliminar con una solución de tiosulfato de sodio. Un método alternativo de eliminación de manchas es simplemente dejar que el yodo se sublime. A veces se sintetizan pequeñas cantidades de triyoduro de nitrógeno como una demostración para los estudiantes de química de secundaria o como un acto de "magia química". Para resaltar la sensibilidad del compuesto, generalmente se detona tocándolo con una pluma, pero incluso la más mínima corriente de aire, luz láser u otro movimiento puede causar la detonación. El triyoduro de nitrógeno también se destaca por ser el único explosivo químico conocido que detona cuando se expone a partículas alfa y productos de fisión nuclear.
Contenido relacionado
Energía libre de gibbs
Pisco
Haluro de oro