Metaloproteína
Metaloproteína es un término genérico para una proteína que contiene un cofactor de iones metálicos. Una gran proporción de todas las proteínas forman... (leer más)
Triptófano (símbolo Trp o W) es un α-aminoácido que se utiliza en la biosíntesis de proteínas. El triptófano contiene un grupo α-amino, un grupo de ácido α-carboxílico y un indol de cadena lateral, lo que lo convierte en una molécula polar con un sustituyente de carbono beta aromático no polar. El triptófano también es un precursor del neurotransmisor serotonina, la hormona melatonina y la vitamina B3. Está codificado por el codón UGG.
Al igual que otros aminoácidos, el triptófano es un zwitterión a pH fisiológico donde el grupo amino está protonado (–NH+
3; pKa = 9,39) y se desprotona el ácido carboxílico (–COO−; pKa = 2,38).
Los humanos y muchos animales no pueden sintetizar triptófano: necesitan obtenerlo a través de su dieta, convirtiéndolo en un aminoácido esencial.
Los aminoácidos, incluido el triptófano, se utilizan como componentes básicos en la biosíntesis de proteínas, y las proteínas son necesarias para sustentar la vida. El triptófano se encuentra entre los aminoácidos menos comunes que se encuentran en las proteínas, pero desempeña importantes funciones estructurales o funcionales cada vez que se presenta. Por ejemplo, los residuos de triptófano y tirosina juegan un papel especial en el "anclaje" Proteínas de membrana dentro de la membrana celular. El triptófano, junto con otros aminoácidos aromáticos, también es importante en las interacciones glucano-proteína. Además, el triptófano funciona como precursor bioquímico de los siguientes compuestos:
El trastorno de malabsorción de fructosa provoca una absorción inadecuada de triptófano en el intestino, niveles reducidos de triptófano en la sangre y depresión.
En las bacterias que sintetizan triptófano, los altos niveles celulares de este aminoácido activan una proteína represora, que se une al operón trp. La unión de este represor al operón de triptófano impide la transcripción del ADN aguas abajo que codifica las enzimas involucradas en la biosíntesis de triptófano. Así que los niveles altos de triptófano impiden la síntesis de triptófano a través de un ciclo de retroalimentación negativa, y cuando los niveles de triptófano de la célula vuelven a bajar, se reanuda la transcripción del operón trp. Esto permite respuestas rápidas y estrechamente reguladas a los cambios en los niveles de triptófano internos y externos de la célula.
metabolismo triptófano por microbiota gastrointestinal humano ()) |
En 2002, el Instituto de Medicina de EE. UU. estableció una cantidad diaria recomendada (RDA) de 5 mg/kg de peso corporal/día de triptófano para adultos de 19 años o más.
El triptófano está presente en la mayoría de los alimentos a base de proteínas o proteínas dietéticas. Es particularmente abundante en el chocolate, la avena, los dátiles secos, la leche, el yogur, el requesón, la carne roja, los huevos, el pescado, las aves, el sésamo, los garbanzos, las almendras, las semillas de girasol, las semillas de calabaza, las semillas de cáñamo, el trigo sarraceno, la espirulina y los cacahuetes. Contrariamente a la creencia popular de que el pavo cocido contiene una gran cantidad de triptófano, el contenido de triptófano en el pavo es típico de las aves de corral.
| Alimentos | Tryptophan [g/100 g de comida] | Proteína [g/100 g de comida] | Triptofan/proteína [%] |
|---|---|---|---|
| Huevo blanco, seco | 1.00 | 81.10 | 1.23 |
| Spirulina, seca | 0.92 | 57.47 | 1.62 |
| Cod, Atlántico, seco | 0 | 62.82 | 1.11 |
| Soybeans, raw | 0,59 | 36.49 | 1.62 |
| Queso, Parmesano | 0,56 | 37.90 | 1.47 |
| Semillas de chia, secas | 0.436 | 16,5 | 2.64 |
| semillas de sésamo | 0.37 | 17.00 | 2.17 |
| Queso, Cheddar | 0.32 | 24.90 | 1.29 |
| Semilla girasol | 0.30 | 17.20 | 1.74 |
| Pork, chop | 0,25 | 19.27 | 1.27 |
| Turquía | 0,244 | 21.89 | 1.11 |
| Pollo | 0,244 | 20.85 | 1.14 |
| Beef | 0.23 | 20.13 | 1.12 |
| Oats | 0.23 | 16.89 | 1.39 |
| Salmón | 0.22 | 19.84 | 1.12 |
| Cordero, pica. | 0.21 | 18.33 | 1.17 |
| Perch, Atlantic | 0.21 | 18.62 | 1.12 |
| Chickpeas, crudas | 0.19 | 19.30 | 0.96 |
| Egg | 0.17 | 12.58 | 1.33 |
| Harina de trigo, blanca | 0,13 | 10.33 | 1.23 |
| Chocolate horneado, sin azúcar | 0,13 | 12.9 | 1.23 |
| Milk | 0,08 | 3.22 | 2.34 |
| Arroz, blanco, mediano, cocinado | 0,028 | 2.38 | 1.18 |
| Quinoa, sin cocinar | 0.167 | 14.12 | 1.2 |
| Quinoa, cocinada | 0,052 | 4.40 | 1.1 |
| Patatas, russet | 0,02 | 2.14 | 0.84 |
| Tamarind | 0,018 | 2.80 | 0,644 |
| Banana | 0,01 | 1.03 | 0.87 |
Debido a que el triptófano se convierte en 5-hidroxitriptófano (5-HTP) que luego se convierte en el neurotransmisor serotonina, se ha propuesto que el consumo de triptófano o 5-HTP puede mejorar los síntomas de depresión al aumentar el nivel de serotonina en el cerebro.. El triptófano se vende sin receta en los Estados Unidos (después de haber sido prohibido en diversos grados entre 1989 y 2005) y el Reino Unido como suplemento dietético para usar como antidepresivo, ansiolítico y somnífero. También se comercializa como medicamento recetado en algunos países europeos para el tratamiento de la depresión mayor. Existe evidencia de que es poco probable que los niveles de triptófano en la sangre se alteren al cambiar la dieta, pero consumir triptófano purificado aumenta el nivel de serotonina en el cerebro, mientras que comer alimentos que contienen triptófano no lo hace.
En 2001 se publicó una revisión Cochrane sobre el efecto del 5-HTP y el triptófano en la depresión. Los autores incluyeron solo estudios de alto rigor e incluyeron tanto el 5-HTP como el triptófano en su revisión debido a los datos limitados sobre ambos. De 108 estudios de 5-HTP y triptófano sobre la depresión publicados entre 1966 y 2000, solo dos conocieron a los autores. estándares de calidad para la inclusión, totalizando 64 participantes del estudio. Las sustancias fueron más efectivas que el placebo en los dos estudios incluidos, pero los autores afirman que "la evidencia fue de calidad insuficiente para ser concluyente" y tenga en cuenta que "debido a que existen antidepresivos alternativos que han demostrado ser efectivos y seguros, la utilidad clínica del 5-HTP y el triptófano es limitada en la actualidad". El uso de triptófano como terapia adyuvante además del tratamiento estándar para los trastornos del estado de ánimo y de ansiedad no está respaldado por evidencia científica.
Las pautas de práctica clínica de 2017 de la Academia Estadounidense de Medicina del Sueño recomendaron no usar triptófano en el tratamiento del insomnio debido a su escasa eficacia.
Los posibles efectos secundarios de la suplementación con triptófano incluyen náuseas, diarrea, somnolencia, aturdimiento, dolor de cabeza, boca seca, visión borrosa, sedación, euforia y nistagmo (movimientos oculares involuntarios).
El triptófano tomado como suplemento dietético (como en forma de tabletas) tiene el potencial de causar el síndrome serotoninérgico cuando se combina con antidepresivos de la clase IMAO o ISRS u otros medicamentos altamente serotoninérgicos. Debido a que la suplementación con triptófano no se ha estudiado a fondo en un entorno clínico, sus interacciones con otros medicamentos no se conocen bien.
Frederick Hopkins informó por primera vez sobre el aislamiento del triptófano en 1901. Hopkins recuperó el triptófano de la caseína hidrolizada, recuperando de 4 a 8 g de triptófano de 600 g de caseína cruda.
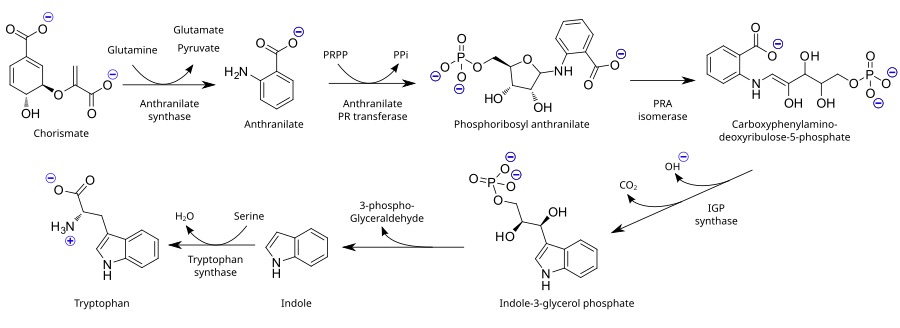
Como aminoácido esencial, el triptófano no se sintetiza a partir de sustancias más simples en humanos y otros animales, por lo que debe estar presente en la dieta en forma de proteínas que contengan triptófano. Las plantas y los microorganismos suelen sintetizar triptófano a partir de ácido shikímico o antranilato: el antranilato se condensa con fosforribosilpirofosfato (PRPP), generando pirofosfato como subproducto. El anillo del resto de ribosa se abre y se somete a descarboxilación reductora, produciendo fosfato de indol-3-glicerol; éste, a su vez, se transforma en indol. En el último paso, la triptófano sintasa cataliza la formación de triptófano a partir de indol y el aminoácido serina.
La producción industrial de triptófano también es biosintética y se basa en la fermentación de serina e indol utilizando bacterias de tipo salvaje o modificadas genéticamente como B. amyloliquefaciens, B. subtilis, C. glutamicum o E. coli. Estas cepas portan mutaciones que impiden la recaptación de aminoácidos aromáticos u operones trp múltiples/sobreexpresados. La conversión es catalizada por la enzima triptófano sintasa.
Hubo un gran brote de síndrome de eosinofilia-mialgia (EMS) en los EE. UU. en 1989, con más de 1500 casos informados a los CDC y al menos 37 muertes. Después de que una investigación preliminar revelara que el brote estaba relacionado con la ingesta de triptófano, la Administración de Drogas y Alimentos de los Estados Unidos (FDA) retiró los suplementos de triptófano en 1989 y prohibió la mayoría de las ventas públicas en 1990, y otros países siguieron su ejemplo.
Estudios posteriores sugirieron que el EMS estaba relacionado con lotes específicos de L-triptófano suministrados por un solo gran fabricante japonés, Showa Denko. Eventualmente quedó claro que lotes recientes de L-triptófano de Showa Denko estaban contaminados con trazas de impurezas, que posteriormente se pensó que eran responsables del brote de EMS de 1989. Sin embargo, otra evidencia sugiere que el triptófano en sí mismo puede ser un factor contribuyente potencialmente importante en EMS. También hay afirmaciones de que un precursor alcanzó concentraciones suficientes para formar un dímero tóxico.
La FDA relajó sus restricciones sobre las ventas y la comercialización de triptófano en febrero de 2001, pero continuó limitando la importación de triptófano que no estaba destinado a un uso exento hasta 2005.
El hecho de que las instalaciones de Showa Denko hayan utilizado bacterias modificadas genéticamente para producir los lotes contaminados de L-triptófano que más tarde se descubrió que causaron el brote del síndrome de eosinofilia-mialgia se ha citado como prueba de la necesidad de una "vigilancia estrecha". de la pureza química de los productos derivados de la biotecnología". Aquellos que piden el monitoreo de la pureza, a su vez, han sido criticados como activistas anti-OGM que pasan por alto las posibles causas de contaminación que no son OGM y amenazan el desarrollo de la biotecnología.
Una afirmación común en los EE. UU. es que el consumo excesivo de carne de pavo provoca somnolencia debido a los altos niveles de triptófano que contiene el pavo. Sin embargo, la cantidad de triptófano en el pavo es comparable a la que contienen otras carnes. La somnolencia después de comer puede ser causada por otros alimentos que se comen con el pavo, en particular los carbohidratos. La ingestión de una comida rica en carbohidratos desencadena la liberación de insulina. La insulina, a su vez, estimula la absorción de grandes aminoácidos de cadena ramificada neutra (BCAA), pero no de triptófano, en el músculo, lo que aumenta la proporción de triptófano a BCAA en el torrente sanguíneo. El aumento de la proporción de triptófano resultante reduce la competencia en el gran transportador de aminoácidos neutros (que transporta tanto BCAA como aminoácidos aromáticos), lo que da como resultado una mayor absorción de triptófano a través de la barrera hematoencefálica hacia el líquido cefalorraquídeo (LCR). Una vez en el LCR, el triptófano se convierte en serotonina en los núcleos del rafe por la vía enzimática normal. La serotonina resultante se metaboliza aún más en melatonina por la glándula pineal. Por lo tanto, estos datos sugieren que la 'somnolencia inducida por la comida', o somnolencia posprandial, puede ser el resultado de una comida pesada rica en carbohidratos, lo que indirectamente aumenta la producción de melatonina en el cerebro y, por lo tanto, promueve el sueño.
En 1912, Felix Ehrlich demostró que la levadura metaboliza los aminoácidos naturales esencialmente separando el dióxido de carbono y reemplazando el grupo amino con un grupo hidroxilo. Por esta reacción, el triptófano da lugar al triptofol.
El triptófano afecta la síntesis de serotonina en el cerebro cuando se administra por vía oral en forma purificada y se usa para modificar los niveles de serotonina para la investigación. El bajo nivel de serotonina en el cerebro es inducido por la administración de proteína pobre en triptófano en una técnica llamada depleción aguda de triptófano. Los estudios que utilizan este método han evaluado el efecto de la serotonina en el estado de ánimo y el comportamiento social y han encontrado que la serotonina reduce la agresión y aumenta la amabilidad.
El triptófano es una importante sonda fluorescente intrínseca (aminoácido), que se puede utilizar para estimar la naturaleza del microambiente alrededor del residuo de triptófano. La mayoría de las emisiones de fluorescencia intrínseca de una proteína plegada se deben a la excitación de los residuos de triptófano.