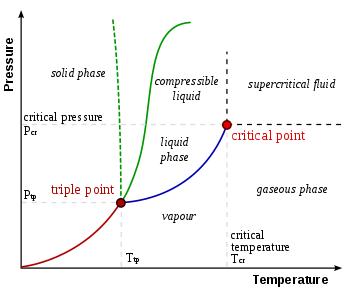
Triple punto
En termodinámica, el punto triple de una sustancia es la temperatura y la presión a las que las tres fases (gas, líquido y sólido) de esa sustancia coexisten en equilibrio termodinámico. Es esa temperatura y presión a la que se encuentran la curva de sublimación, la curva de fusión y la curva de vaporización. Por ejemplo, el punto triple del mercurio se produce a una temperatura de −38,8 °C (−37,8 °F) y una presión de 0,165 mPa.
Además del punto triple para las fases sólida, líquida y gaseosa, un punto triple puede involucrar más de una fase sólida, para sustancias con múltiples polimorfos. El helio-4 es un caso especial que presenta un punto triple que involucra dos fases fluidas diferentes (punto lambda).
El punto triple del agua se utilizó para definir el kelvin, la unidad base de temperatura termodinámica en el Sistema Internacional de Unidades (SI). El valor del punto triple del agua se fijó por definición, en lugar de medirse, pero eso cambió con la redefinición de las unidades base del SI en 2019. Los puntos triples de varias sustancias se utilizan para definir puntos en la escala internacional de temperatura ITS-90, que van desde el punto triple del hidrógeno (13,8033 K) hasta el punto triple del agua (273,16 K, 0,01 °C o 32,018 °F).
El término "punto triple" fue acuñado en 1873 por James Thomson, hermano de Lord Kelvin.
Punto triple del agua
Punto triple gas-líquido-sólido
La combinación única de presión y temperatura a la que el agua líquida, el hielo sólido y el vapor de agua pueden coexistir en un equilibrio estable se produce exactamente a 273,1600 K (0,0100 °C; 32,0180 °F) y una presión de vapor parcial de 611,657 pascales (6,11657 mbar; 0,00603659 atm). En ese punto, es posible cambiar toda la sustancia a hielo, agua o vapor haciendo cambios arbitrariamente pequeños en la presión y la temperatura. Incluso si la presión total de un sistema está muy por encima del punto triple del agua, siempre que la presión parcial del vapor de agua sea de 611,657 pascales, entonces el sistema aún puede llevarse al punto triple del agua. Estrictamente hablando, las superficies que separan las diferentes fases también deben ser perfectamente planas, para anular los efectos de la tensión superficial.
El punto triple gas-líquido-sólido del agua corresponde a la presión mínima a la que puede existir agua líquida. A presiones por debajo del punto triple (como en el espacio exterior), el hielo sólido, cuando se calienta a presión constante, se convierte directamente en vapor de agua en un proceso conocido como sublimación. Por encima del punto triple, el hielo sólido cuando se calienta a presión constante primero se derrite para formar agua líquida y luego se evapora o hierve para formar vapor a una temperatura más alta.
Para la mayoría de las sustancias, el punto triple gas-líquido-sólido es también la temperatura mínima a la que puede existir el líquido. Para el agua, sin embargo, esto no es cierto porque el punto de fusión del hielo ordinario disminuye en función de la presión, como lo muestra la línea verde discontinua en el diagrama de fase. A temperaturas justo por debajo del punto triple, la compresión a temperatura constante transforma el vapor de agua primero en sólido y luego en líquido (el hielo de agua tiene menor densidad que el agua líquida, por lo que el aumento de la presión conduce a una licuefacción).
La presión del punto triple del agua se utilizó durante la misión Mariner 9 a Marte como punto de referencia para definir el "nivel del mar". Misiones más recientes usan altimetría láser y mediciones de gravedad en lugar de presión para definir la elevación en Marte.
Fases de alta presión
A altas presiones, el agua tiene un diagrama de fase complejo con 15 fases de hielo conocidas y varios puntos triples, incluidos 10 cuyas coordenadas se muestran en el diagrama. Por ejemplo, el punto triple a 251 K (−22 °C) y 210 MPa (2070 atm) corresponde a las condiciones de coexistencia de hielo Ih (hielo ordinario), hielo III y agua líquida, todos en equilibrio. También hay puntos triples para la coexistencia de tres fases sólidas, por ejemplo hielo II, hielo V y hielo VI a 218 K (−55 °C) y 620 MPa (6120 atm).
Para aquellas formas de hielo de alta presión que pueden existir en equilibrio con líquido, el diagrama muestra que los puntos de fusión aumentan con la presión. A temperaturas superiores a 273 K (0 °C), el aumento de la presión sobre el vapor de agua da como resultado primero agua líquida y luego una forma de hielo a alta presión. En el rango 251–273 K, primero se forma hielo I, seguido de agua líquida y luego hielo III o ice V, seguidas de otras formas de alta presión aún más densas.
| Fases en equilibrio estable | Presión | Temperatura |
|---|---|---|
| agua líquida, hielo y vapor de agua | 611.657 Pa | 273.16 K (0.01 °C) |
| agua líquida, hieloh, y hielo III | 209.9 MPa | 251 K (−22 °C) |
| agua líquida, hielo III y hielo V | 350.1 MPa | −17.0 °C |
| agua líquida, hielo V y hielo VI | 632.4 MPa | 0.16 °C |
| hielohhielo III | 213 MPa | −35 °C |
| hielo II, hielo III y hielo V | 344 MPa | −24 °C |
| hielo II, hielo V y hielo VI | 626 MPa | −70 °C |
Células de triple punto
Las celdas de punto triple se utilizan en la calibración de termómetros. Para trabajos exigentes, las celdas de punto triple generalmente se llenan con una sustancia química altamente pura como hidrógeno, argón, mercurio o agua (dependiendo de la temperatura deseada). La pureza de estas sustancias puede ser tal que solo una parte en un millón sea un contaminante, llamado "seis nueves" porque es 99.9999% puro. Se utiliza una composición isotópica específica (para el agua, VSMOW) porque las variaciones en la composición isotópica provocan pequeños cambios en el punto triple. Las celdas de punto triple son tan efectivas para lograr temperaturas reproducibles altamente precisas que un estándar de calibración internacional para termómetros llamado ITS-90 se basa en celdas de punto triple de hidrógeno, neón, oxígeno, argón, mercurio y agua para delinear seis de sus puntos de temperatura definidos.
Tabla de puntos triples
Esta tabla enumera los puntos triples gas-líquido-sólido de varias sustancias. A menos que se indique lo contrario, los datos provienen de la Oficina Nacional de Estándares de EE. UU. (ahora NIST, Instituto Nacional de Estándares y Tecnología).
| Sustancia | T [K] (°C) | p [kPa]* (atm) |
|---|---|---|
| Acetileno | 192.4 K (−80.7 °C) | 120 kPa (1,2 atm) |
| Amoníaco | 195.40 K (−77.75 °C) | 6.060 kPa (0.05981 atm) |
| Argon | 83.8058 K (189.3442 °C) | 68,9 kPa (0,680 atm) |
| Arsenic | 1,090 K (820 °C) | 3.628 kPa (35.81 atm) |
| Butane | 134.6 K (−138.6 °C) | 7×10−4kPa (6.9×10−6am) |
| Carbon (graphite) | 4,765 K (4,492 °C) | 10,132 kPa (100.00 atm) |
| Dióxido de carbono | 216.55 K (56.60 °C) | 517 kPa (5.10 atm) |
| Monóxido de carbono | 68.10 K (−205.05 °C) | 15.37 kPa (0.1517 atm) |
| Cloroformo | 175.43 K (−97.72 °C) | 0.870 kPa (0.00859 atm) |
| Deuterium | 18.63 K (−254.52 °C) | 17.1 kPa (0.169 atm) |
| Ethane | 89.89 K (−183.26 °C) | 1.1×10−3kPa (1.1×10; 5 -am) |
| Ethanol | 150 K (−123 °C) | 4.3×10−7kPa (4.2×10−9am) |
| Etileno | 104.0 K (−169.2 °C) | 0.12 kPa (0.0012 atm) |
| Ácido formico | 281.40 K (8.25 °C) | 2.2 kPa (0.022 am) |
| Helio-4 (punto de lambda) | 2.1768 K (−270.9732 °C) | 5.048 kPa (0.04982 atm) |
| Helio-4 (hcp−bcc−He-II) | 1.463 K (−271.687 °C) | 26.036 kPa (0.25696 atm) |
| Helio-4 (bcc—He-I—He-II) | 1.762 K (−271.388 °C) | 29.725 kPa (0.29336 atm) |
| Helium-4 (hcp−bcc−He-I) | 1.772 K (−271.378 °C) | 30.016 kPa (0.29623 atm) |
| Hexafluoroetano | 173.08 K−100.07 °C) | 26.60 kPa (0.2625 atm) |
| Hidrogen | 13.8033 K (−259.3467 °C) | 7.04 kPa (0.0695 atm) |
| Cloruro de hidrógeno | 158.96 K (−114.19 °C) | 13.9 kPa (0.137 atm) |
| Yodo | 386.65 K (113.50 °C) | 12.07 kPa (0.1191 a.m.) |
| Isobutane | 113.55 K (−159.60 °C) | 1.9481×10; 5 -kPa (1,9226×10−7am) |
| Krypton | 115.76 K (−157.39 °C) | 74.12 kPa (0.7315 atm) |
| Mercurio | 234.3156 K− (38.8344 °C) | 1.65×10−7kPa (1,63)×10−9am) |
| Metano | 90.68 K (−182.47 °C) | 11.7 kPa (0.115 atm) |
| Neon | 24.5561 K (−248.5939 °C) | 43.332 kPa (0.42765 atm) |
| Óxido métrico | 109.50 K (−163.65 °C) | 21.92 kPa (0.2163 atm) |
| Nitrogen | 63.18 K (−209.97 °C) | 12.6 kPa (0.124 atm) |
| Óxido nitroso | 182.34 K (−90.81 °C) | 87.85 kPa (0.8670 atm) |
| Oxygen | 54.3584 K (−218.7916 °C) | 0.14625 kPa (0.0014434 atm) |
| Palladium | 1,825 K (1,552 °C) | 3.5×10−3kPa (3.5×10; 5 -am) |
| Platino | 2.045 K (1.772 °C) | 2×10−4kPa (2,0×10−6am) |
| Radon | 202 K (−71 °C) | 70 kPa (0,69 atm) |
| (mono)Silane | 88.48 K (−184.67 °C) | 0,019644 kPa (0.00019387 atm) |
| Dióxido de azufre | 197.69 K−75.46 °C) | 1.67 kPa (0.0165 atm) |
| Titanio | 1,941 K (1,668 °C) | 5.3×10−3kPa (5.2×10; 5 -am) |
| Hexafluoruro de uranio | 337.17 K (64.02 °C) | 151.7 kPa (1.497 atm) |
| Agua | 273.16 K (0.01 °C) | 0.611657 kPa (0.00603659 atm) |
| Xenon | 161.3 K (−111,8 °C) | 81.5 kPa (0.804 atm) |
| Zinc | 692.65 K (419.50 °C) | 0,065 kPa (0.00064 atm) |
Notas:
- Para comparación, la presión atmosférica típica es 101.325 kPa (1 atm).
- Antes de la nueva definición de unidades SI, el triple punto del agua, 273.16 K, era un número exacto.
Contenido relacionado
Materia degenerada
Proceso endotérmico
Eje óptico