Triángulo de fuego

El triángulo de fuego o triángulo de combustión es un modelo simple para entender los ingredientes necesarios para la mayoría de los incendios.
El triángulo ilustra los tres elementos que un fuego necesita para encenderse: calor, combustible y un agente oxidante (normalmente oxígeno). Un incendio ocurre naturalmente cuando los elementos están presentes y combinados en la mezcla adecuada. Un incendio se puede prevenir o extinguir eliminando cualquiera de los elementos del triángulo de fuego. Por ejemplo, cubrir un incendio con una manta ignífuga bloquea el oxígeno y puede extinguir el fuego. En incendios grandes en los que se llama a los bomberos, disminuir la cantidad de oxígeno no suele ser una opción porque no existe una forma eficaz de lograrlo en un área extensa.
Tetraedro de fuego
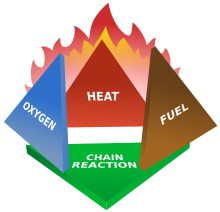
El tetraedro del fuego representa la adición de la reacción química en cadena a las tres ya presentes en el triángulo del fuego.
La combustión es una reacción química que alimenta un fuego más calor y le permite continuar. Una vez iniciado el fuego, la reacción de cadena exotérmica resultante sostiene el fuego y le permite continuar hasta o a menos que se bloquee al menos uno de los elementos del fuego:
- espuma se puede utilizar para negar el fuego el oxígeno que necesita
- El agua se puede utilizar para bajar la temperatura del combustible debajo del punto de encendido, o para eliminar o dispersar el combustible.
- El halón se puede utilizar para eliminar los radicales libres y crear una barrera de gas inerte en un ataque directo a la reacción química responsable del fuego.
Cuando el fuego implica quemar metales como litio, magnesio, titanio, etc. (conocido como fuego de clase D), se vuelve aún más importante considerar la liberación de energía. Debido a que los metales reaccionan más rápido con el agua que con el oxígeno y, por lo tanto, se libera más energía, al echar agua sobre un fuego de este tipo, el fuego se calienta o incluso explota. Los extintores de dióxido de carbono son ineficaces contra ciertos metales como el titanio. Por lo tanto, se deben utilizar agentes inertes (por ejemplo, arena seca) para romper la reacción en cadena de la combustión metálica.
De la misma manera, tan pronto como uno de los cuatro elementos del tetraedro se elimina (por completo), la combustión se detiene.
Oxidante
El oxidante es el otro reactivo de la reacción química. En la mayoría de los casos se trata del aire ambiente y, en particular, de uno de sus componentes, el oxígeno (O2). Privando un fuego de aire se puede extinguir el fuego, como cuando se cubre la llama de una vela pequeña con un vaso vacío. Por el contrario, si se sopla aire sobre un fuego de leña (como ocurre con los fuelles), el fuego se activa al introducir más aire.
Algunas sustancias químicas, como el gas flúor, las sales de perclorato como el perclorato de amonio o el trifluoruro de cloro, actúan como oxidantes, a veces más potentes que el propio oxígeno. Un incendio basado en una reacción con estos oxidantes puede ser muy difícil de apagar hasta que se agote el oxidante; ese cateto del triángulo del fuego no puede romperse por medios normales (es decir, privarlo de aire no lo sofocará).
En ciertos casos, como en algunos explosivos, el oxidante y el combustible son los mismos (por ejemplo, nitroglicerina, una molécula inestable que tiene partes oxidantes en la misma molécula que las partes oxidables).
La reacción se inicia mediante una energía activadora; en la mayoría de los casos, es calor. Varios ejemplos incluyen la fricción, como en el caso de las cerillas, el calentamiento de un cable eléctrico, una llama (propagación del fuego) o una chispa (de un encendedor o de cualquier dispositivo eléctrico de arranque). También hay muchas otras formas de generar suficiente energía de activación, incluidas la electricidad, la radiación y la presión, todas las cuales conducirán a un aumento de temperatura. En la mayoría de los casos, la producción de calor permite la autosostenibilidad de la reacción y permite que crezca una reacción en cadena. La temperatura a la que un líquido produce suficiente vapor para obtener una mezcla inflamable con combustión autosostenible se llama punto de inflamación.
Extinción del incendio
Para detener una reacción de combustión, se debe eliminar uno de los tres elementos del triángulo de fuego.
Sin suficiente calor, un incendio no puede comenzar ni continuar. El calor se puede eliminar mediante la aplicación de una sustancia que reduzca la cantidad de calor disponible para la reacción del fuego. Suele ser agua, que absorbe calor para el cambio de fase de agua a vapor. Introducir cantidades y tipos suficientes de polvo o gas en la llama reduce de la misma manera la cantidad de calor disponible para la reacción del fuego. Raspar las brasas de una estructura en llamas también elimina la fuente de calor. Cortar la electricidad en un incendio eléctrico elimina la fuente de ignición.
Sin combustible, el incendio se detendrá. El combustible se puede eliminar de forma natural, cuando el fuego ha consumido todo el combustible combustible, o manualmente, eliminando mecánica o químicamente el combustible del fuego. La separación de combustible es un factor importante en la extinción de incendios forestales y es la base de la mayoría de las tácticas importantes, como las quemas controladas. El fuego se detiene porque una menor concentración de vapor de combustible en la llama provoca una disminución de la liberación de energía y una temperatura más baja. De este modo, eliminar el combustible disminuye el calor.
Sin suficiente oxígeno, un incendio no puede comenzar ni continuar. Con una menor concentración de oxígeno, el proceso de combustión se ralentiza. Se puede negar oxígeno a un incendio utilizando un extintor de dióxido de carbono, una manta ignífuga o agua.
Papel del agua en la extinción de incendios
El agua puede tener dos funciones diferentes. En el caso de un combustible sólido, el combustible sólido produce productos pirolizantes bajo la influencia del calor, comúnmente radiación. Este proceso se detiene mediante la aplicación de agua, ya que el agua se evapora más fácilmente que el combustible se piroliza. De este modo se elimina energía de la superficie del combustible, se enfría y se detiene la pirólisis, eliminando el suministro de combustible a las llamas. En la lucha contra incendios, esto se denomina enfriamiento de la superficie.
En fase gaseosa, es decir en las llamas o en el humo, el combustible no puede separarse del comburente, y la única acción posible consiste en enfriarse. En este caso, las gotas de agua se evaporan en la fase gaseosa, lo que reduce la temperatura y agrega vapor de agua, lo que hace que la mezcla de gases no sea combustible. Esto requiere gotas de un tamaño inferior a aproximadamente 0,2 mm. En la lucha contra incendios, esto se denomina enfriamiento por gas o enfriamiento por humo.
También existen casos en los que el factor de ignición no es la energía de activación. Por ejemplo, una explosión de humo es una combustión muy violenta de gases no quemados contenidos en el humo creada por una entrada repentina de aire fresco (entrada de oxidante). El intervalo en el que una mezcla de aire y gas puede arder está limitado por los límites explosivos del aire. Este intervalo puede ser muy pequeño (queroseno) o grande (acetileno).
No se puede utilizar agua en cierto tipo de incendios:
- Fuegos donde la electricidad viva está presente – como el agua conduce la electricidad presenta un peligro de electrocución.
- Fuegos hidrocarburos – ya que sólo extenderá el fuego debido a la diferencia en densidad/hidrofobia. Por ejemplo, añadir agua a un fuego con una fuente de aceite hará que el aceite se disemine, ya que el aceite y el agua no se mezclan. Sin embargo, el uso de una mezcla de espuma/agua en un método de aplicación específico es aceptable.
- Fuegos metálicos – ya que estos incendios producen enormes cantidades de energía (hasta 7.550 calorías/kg para aluminio) y el agua también puede crear reacciones químicas violentas con metal quema (posiblemente incluso servir como agente oxidante adicional).
Dado que estas reacciones se conocen bien, ha sido posible crear aditivos de agua específicos que permitirán:
- Una mejor absorción de calor con una mayor densidad que el agua.
- Llevando a los cazas radicales libres en el fuego.
- Llevar agentes de espuma para permitir que el agua permanezca en la superficie de un fuego líquido y evitar la liberación de gas.
- Llevar reactivos específicos que reaccionen y cambien la naturaleza del material quema.
Los aditivos para agua generalmente están diseñados para ser efectivos en varias categorías de incendios (clase A + clase B o incluso clase A + clase B + clase F [Clase K en América del Norte]), lo que significa un mejor rendimiento y usabilidad global de un solo extintor en muchos tipos diferentes de incendios (o incendios que involucran varias clases diferentes de materiales).
Triángulos de fuego multiescala para incendios forestales

En el contexto de los incendios forestales, el triángulo del fuego se puede ampliar para aplicarlo a la propagación del fuego en paisajes (escalas de días y varios kilómetros) y a la recurrencia del fuego a lo largo del tiempo (escalas de décadas y cientos de kilómetros). Por lo tanto, si bien el calor es importante para encender una llama, la topografía es importante para ayudar a la propagación del fuego, especialmente mediante el precalentamiento de los combustibles cuesta arriba, y las fuentes de ignición son importantes para ayudar a explicar la recurrencia en escalas de tiempo más largas. De manera similar, si bien el oxígeno es relevante para sostener una llama, el clima y los vientos asociados alimentan con oxígeno el fuego que se propaga, y el patrón climático a largo plazo se resume como clima. Por último, combustibles es el término que describe lo que se quema en una sola llama hasta la variedad de materiales quemados en un incendio forestal que se propaga, pero los combustibles varían en escalas espaciales y temporales más grandes en lo que se llama vegetación.
En la escala más pequeña, el triángulo del fuego de combustión, las partículas individuales de combustible se encienden una vez a una temperatura crítica y el fuego transfiere energía al entorno más cercano. Los eventos de combustión varían en la escala de varios segundos a un par de días y sus efectos se monitorean en la escala de cuadrante. La escala más grande, por el contrario, describe el concepto de régimen de incendios. El cambio climático global impulsa muchos de los factores involucrados en los 'incendios forestales' y el 'régimen de incendios' triangulos. Por ejemplo, con respecto al régimen de incendios, un tipo particular de vegetación sustentará un incendio característico en términos de recurrencia, intensidad, estacionalidad y efectos biológicos; un cambio en el tipo de vegetación tendrá implicaciones para un régimen de incendios cambiante.
Contenido relacionado
Selenocisteína
Estados de la materia
Svante Arrhenius
Plasma (física)
Materia