Transglutaminasa tisular
La transglutaminasa tisular (abreviada como tTG o TG2) es una enzima dependiente del calcio de 78 kDa (EC 2.3.2.13) de la familia de las γ-glutamiltransferasas de proteína-glutamina (o simplemente familia de las transglutaminasas). Al igual que otras transglutaminasas, reticula proteínas entre un grupo ε-amino de un residuo de lisina y un grupo γ-carboxamida de un residuo de glutamina, creando un enlace intermolecular o intramolecular que es altamente resistente a la proteólisis (degradación de proteínas). Además de su función de reticulación, la tTG cataliza otros tipos de reacciones, incluidas la desamidación, la unión/hidrolización de GTP y las actividades de isopeptidasa. A diferencia de otros miembros de la familia de las transglutaminasas, la tTG se puede encontrar tanto en el espacio intracelular como en el extracelular de varios tipos de tejidos y se encuentra en muchos órganos diferentes, incluidos el corazón, el hígado y el intestino delgado. La tTG intracelular es abundante en el citosol, pero también se pueden encontrar cantidades más pequeñas en el núcleo y las mitocondrias. Se cree que la tTG intracelular desempeña un papel importante en la apoptosis. En el espacio extracelular, la tTG se une a las proteínas de la matriz extracelular (ECM), uniéndose particularmente fuerte a la fibronectina. La tTG extracelular se ha relacionado con la adhesión celular, la estabilización de la ECM, la cicatrización de heridas, la señalización de receptores, la proliferación celular y la motilidad celular.
El tTG es el autoantígeno de la enfermedad celíaca, una enfermedad crónica en la que el consumo de gluten en la dieta provoca una respuesta inmunitaria patológica que provoca la inflamación del intestino delgado y la consiguiente atrofia de las vellosidades. También se lo ha relacionado con la fisiopatología de muchas otras enfermedades, entre ellas muchos tipos de cáncer y enfermedades neurodegenerativas.
Estructura
Gene
El gen tTG humano se encuentra en el cromosoma 20 (20q11.2-q12).
Proteína
TG2 es una enzima multifuncional que pertenece a las transglutaminasas que catalizan la reticulación de proteínas mediante enlaces isopeptídicos épsilon-(gamma-glutamil)lisina. De manera similar a otras transglutaminasas, tTG consta de un sitio de unión de GTP/GDP, un dominio catalítico, dos barriles beta y un sándwich beta. Las estructuras cristalinas de TG2 con GDP, GTP o ATP unidos han demostrado que estas formas de TG2 adoptan una conformación "cerrada", mientras que TG2 con el sitio activo ocupado por un péptido inhibidor imitador del gluten u otros inhibidores similares adopta una conformación "abierta". En la conformación abierta, los cuatro dominios de TG2 están dispuestos en una configuración extendida, lo que permite la actividad catalítica, mientras que en la conformación cerrada, los dos dominios C-terminales están plegados sobre el dominio central catalítico que incluye el residuo Cys-277. El dominio N-terminal solo muestra cambios estructurales menores entre las dos conformaciones diferentes.
Mecanismo
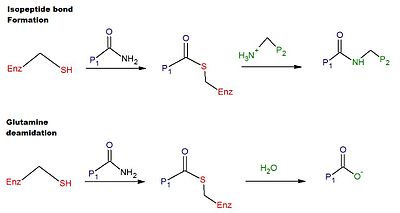
El mecanismo catalítico de la reticulación en la tTG humana implica el grupo tiol de un residuo de Cys en el sitio activo de la tTG. El grupo tiol ataca la carboxamida de un residuo de glutamina en la superficie de un sustrato proteico o peptídico, liberando amoníaco y produciendo un intermedio tioéster. El intermedio tioéster puede ser atacado entonces por la amina superficial de un segundo sustrato (normalmente de un residuo de lisina). El producto final de la reacción es un enlace isopeptídico estable entre los dos sustratos (es decir, reticulación). Alternativamente, el intermedio tioéster puede hidrolizarse, lo que da como resultado la conversión neta del residuo de glutamina en ácido glutámico (es decir, desamidación). Se cree que la desamidación de los residuos de glutamina catalizada por la tTG está vinculada a la respuesta inmunitaria patológica al gluten en la enfermedad celíaca. En la Figura 1 se proporciona un esquema de las reacciones de reticulación y desamidación.
Reglamento
La expresión de tTG se regula a nivel transcripcional en función de complejas cascadas de señales. Una vez sintetizada, la mayor parte de la proteína se encuentra en el citoplasma, la membrana plasmática y la matriz extracelular, pero una pequeña fracción se transloca al núcleo, donde participa en el control de su propia expresión a través de la regulación de factores de transcripción.
La actividad de reticulación de la tTG requiere la unión de iones Ca2+. Múltiples Ca2+ pueden unirse a una sola molécula de tTG. Específicamente, la tTG se une a hasta 6 iones de calcio en 5 sitios de unión diferentes. Las mutaciones en estos sitios de unión que causan una menor afinidad por el calcio disminuyen la actividad de transglutaminasa de la enzima. Por el contrario, la unión de una molécula de GTP o GDP inhibe la actividad de reticulación de la enzima. Por lo tanto, la tTG intracelular es mayormente inactiva debido a la concentración relativamente alta de GTP/GDP y los bajos niveles de calcio dentro de la célula. Aunque se espera que la tTG extracelular sea activa debido a la baja concentración de nucleótidos de guanina y los altos niveles de calcio en el espacio extracelular, la evidencia ha demostrado que la tTG extracelular es mayormente inactiva. Estudios recientes sugieren que la tTG extracelular se mantiene inactiva por la formación de un enlace disulfuro entre dos residuos de cisteína vecinales, concretamente Cys 370 y Cys 371. Cuando se forma este enlace disulfuro, la enzima permanece en una confirmación abierta pero se vuelve catalíticamente inactiva. La oxidación/reducción del enlace disulfuro sirve como un tercer mecanismo regulador alostérico (junto con GTP/GDP y Ca2+) para la activación de la tTG. Se ha demostrado que la tiorredoxina-1 activa la tTG extracelular mediante la reducción del enlace disulfuro. Se puede formar otro enlace disulfuro en la tTG, entre los residuos Cys-230 y Cys-370. Si bien este enlace no existe en el estado nativo de la enzima, aparece cuando la enzima se inactiva mediante oxidación. La presencia de calcio protege contra la formación de ambos enlaces disulfuro, lo que hace que la enzima sea más resistente a la oxidación.

Estudios recientes han sugerido que el interferón-γ puede actuar como activador de la tTG extracelular en el intestino delgado; estos estudios tienen una implicación directa en la patogénesis de la enfermedad celíaca. Se ha demostrado que la activación de la tTG está acompañada de grandes cambios conformacionales, pasando de una conformación compacta (inactiva) a una conformación extendida (activa). (Ver Figura 3)

En la matriz extracelular, la TG2 se encuentra "desactivada", debido principalmente a la actividad oxidante de la proteína 57 del retículo endoplasmático (ERp57). Por lo tanto, la tTG está regulada alostéricamente por dos proteínas separadas, Erp57 y TRX-1. (Véase la Figura 4).

Función
La tTG se expresa de forma ubicua y está presente en varios compartimentos celulares, como el citosol, el núcleo y la membrana plasmática. Requiere calcio como cofactor para la actividad de transamidación. La transcripción aumenta con el ácido retinoico. Entre sus muchas funciones supuestas, parece desempeñar un papel en la cicatrización de heridas, la apoptosis y el desarrollo de la matriz extracelular, así como en la diferenciación y la adhesión celular. Se ha observado que la tTG puede tener una actividad muy diferente en diferentes tipos de células. Por ejemplo, en las neuronas, la tTG favorece la supervivencia de las células sometidas a una lesión, mientras que en los astrocitos la supresión de la expresión génica de la tTG es beneficiosa para la supervivencia celular.
Se cree que la tTG participa en la regulación del citoesqueleto mediante la reticulación de varias proteínas del citoesqueleto, entre ellas la miosina, la actina y la espectrina. Hay pruebas de que la tTG intracelular se reticula con la miosina. También se cree que la tTG puede estabilizar la estructura de las células moribundas durante la apoptosis mediante la polimerización de los componentes del citoesqueleto, evitando así la fuga de los contenidos celulares al espacio extracelular.
La tTG también tiene actividad GTPasa: en presencia de GTP, se ha sugerido que funciona como una proteína G que participa en los procesos de señalización. Además de su actividad transglutaminasa, se ha propuesto que la tTG también actúa como quinasa, proteína disulfuro isomerasa y deamidasa. Esta última actividad es importante en la desamidación de los péptidos de gliadina, por lo que desempeña un papel importante en la patología de la enfermedad celíaca.
La tTG también presenta actividad PDI (Proteína Disulfuro Isomerasa). Basándose en su actividad PDI, la tTG juega un papel importante en la regulación de la proteostasis, al catalizar la trimerización del HSF1 (Factor de Choque Térmico 1) y, por lo tanto, la respuesta del organismo al choque térmico. En ausencia de tTG, la respuesta al choque térmico se ve afectada ya que no se forma el trímero necesario.
Significado clínico
La tTG es la transglutaminasa más estudiada y se la ha asociado con muchas enfermedades. Sin embargo, ninguna de estas enfermedades está relacionada con una deficiencia enzimática. De hecho, hasta ahora no se ha atribuido ninguna enfermedad a la falta de actividad de la tTG y esto se ha comprobado mediante el estudio de ratones deficientes en tTG.
Enfermedad celíaca
La tTG es más conocida por su vínculo con la enfermedad celíaca. Se asoció por primera vez con la enfermedad celíaca en 1997, cuando se descubrió que la enzima era el antígeno reconocido por los anticuerpos específicos de la enfermedad celíaca. Los anticuerpos antitransglutaminasa dan lugar a una forma de sensibilidad al gluten en la que una respuesta celular a los glutenes de Triticeae que están reticulados con la tTG pueden estimular respuestas de células B específicas de la transglutaminasa que finalmente dan lugar a la producción de anticuerpos antitransglutaminasa IgA e IgG. La tTG desamida específicamente los residuos de glutamina creando epítopos que aumentan la afinidad de unión del péptido del gluten a las células T presentadoras de antígeno, lo que inicia una respuesta inmunitaria adaptativa.
Cáncer
Estudios recientes sugieren que la tTG también desempeña un papel en la inflamación y la biología tumoral. La expresión de tTG está elevada en múltiples tipos de células cancerosas y está implicada en la resistencia a los fármacos y la metástasis debido a su capacidad para promover la transición mesenquimal y propiedades similares a las de las células madre. En su forma unida a GTP, la tTG contribuye a la supervivencia de las células cancerosas y parece ser un impulsor del cáncer. La tTG está regulada positivamente en las células y tejidos cancerosos en muchos tipos de cáncer, incluidos la leucemia, el cáncer de mama, el cáncer de próstata, el cáncer de páncreas y el cáncer de cuello uterino. Una mayor expresión de tTG también se correlaciona con mayores casos de metástasis, resistencia a la quimioterapia, menores tasas de supervivencia y, en general, un mal pronóstico. Las células cancerosas pueden eliminarse aumentando los niveles de calcio a través de la activación de la actividad de transamidación de tTG. Los ensayos preclínicos han demostrado ser prometedores en el uso de inhibidores de tTG como agentes terapéuticos contra el cáncer. Sin embargo, otros estudios han señalado que la actividad de transamidación de tTG podría estar relacionada con la inhibición de la invasividad de las células tumorales.
Otras enfermedades
Se cree que la tTG contribuye a varios trastornos neurodegenerativos, entre ellos las enfermedades de Alzheimer, Parkinson y Huntington, al afectar la transcripción, la diferenciación, la migración y la adhesión. Estas enfermedades neurológicas se caracterizan en parte por la agregación anormal de proteínas debido a la mayor actividad de reticulación de proteínas en el cerebro afectado. Además, se ha descubierto que proteínas específicas asociadas con estos trastornos son sustratos in vivo e in vitro de la tTG. Aunque la tTG se regula positivamente en las áreas del cerebro afectadas por la enfermedad de Huntington, un estudio reciente demostró que el aumento de los niveles de tTG no afecta la aparición y/o progresión de la enfermedad en ratones. Estudios recientes muestran que la tTG puede no estar involucrada en la EA, ya que los estudios muestran que está asociada con la lisis de eritrocitos y es una consecuencia de la enfermedad en lugar de una causa.
La tTG también se ha relacionado con la patogénesis de la fibrosis en varios órganos, incluidos los pulmones y los riñones. En concreto, en la fibrosis renal, la tTG contribuye a la estabilización y acumulación de la matriz extracelular, lo que afecta a la actividad del factor de crecimiento beta (TGF beta).
Diagnostico
La serología para anticuerpos anti-tTG ha reemplazado a las pruebas serológicas más antiguas (antiendomisio, antigliadina y antirreticulina) y tiene una gran sensibilidad (99%) y especificidad (>90%) para identificar la enfermedad celíaca. Los ensayos anti-tTG modernos se basan en una proteína recombinante humana como antígeno.
Terapéutica
El uso de tTG como una forma de pegamento quirúrgico todavía es experimental. También se está estudiando como atenuador de la metástasis en ciertos tumores. La tTG parece prometedora como posible diana terapéutica para tratar la fibrosis cardíaca, a través de la actividad de un inhibidor de tTG altamente selectivo. También se ha demostrado que los inhibidores de tTG inhiben la formación de inclusiones tóxicas relacionadas con enfermedades neurodegenerativas. Esto indica que los inhibidores de tTG también podrían servir como una herramienta para mitigar la progresión de las enfermedades cerebrales relacionadas con tTG.
Interacciones
TG2 participa en interacciones tanto enzimáticas como no enzimáticas. Las interacciones enzimáticas se forman entre TG2 y sus proteínas sustrato que contienen los grupos donantes de glutamina y lisina en presencia de calcio. Se sabe que los sustratos de TG2 afectan la actividad de TG2, lo que le permite posteriormente ejecutar diversas funciones biológicas en la célula. Sin embargo, aún no se ha revelado la importancia de las interacciones no enzimáticas en la regulación de las actividades de TG2. Estudios recientes indican que las interacciones no enzimáticas desempeñan funciones fisiológicas y permiten diversas funciones de TG2 de una manera específica del contexto.
Erp57
La proteína 57 del retículo endoplasmático (Erp57) es una molécula chaperona que participa en la carga de péptidos en las moléculas del MHC de clase I en el retículo endoplasmático.
La transglutaminasa 2 (TG2) es una proteína que se expresa de forma ubicua (tanto intracelular como extracelular) y que posee múltiples modos de regulación postraduccional, incluido un enlace disulfuro alostérico entre Cys-370 y Cys-371 que vuelve inactiva a la enzima en la matriz extracelular.
La proteína 57 residente en el retículo endoplasmático (RE) (ERp57), una proteína del RE que promueve el plegamiento de proteínas nacientes y que también está presente en el entorno extracelular, tiene las características celulares y bioquímicas para inactivar TG2. Descubrimos que ERp57 se colocaliza con TG2 extracelular en células endoteliales de vena umbilical humana cultivadas (HUVEC). ERp57 oxidó TG2 con una constante de velocidad que fue 400-2000 veces mayor que la de los oxidantes de moléculas pequeñas antes mencionados. Además, su especificidad para TG2 también fue notablemente mayor que la de otras proteínas redox secretadas, incluidas la proteína disulfuro isomerasa (PDI), ERp72, TRX y la quiescina sulfhidrilo oxidasa 1 (QSOX1).
Referencias
- ^ a b c GRCh38: Ensembl release 89: ENSG00000198959 – Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00037820 – Ensembl, mayo 2017
- ^ "Human PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Referencia:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b Király R, Demény M, Fésüs L (diciembre de 2011). "Transamidación de proteínas por transglutaminase 2 en células: una acción controvertida Ca2+-dependiente de una proteína multifuncional". The FEBS Journal. 278 (24): 4717–39. doi:10.1111/j.1742-4658.2011.08345.x. PMID 21902809. S2CID 19217277.
- ^ a b c d e f g h Klöck C, Diraimondo TR, Khosla C (julio de 2012). "Role of transglutaminase 2 in celiac disease pathogenesis". Seminarios en Inmunopatología. 34 (4): 513–22. doi:10.1007/s00281-012-0305-0. PMC 3712867. PMID 22437759.
- ^ a b c Facchiano F, Facchiano A, Facchiano AM (mayo de 2006). "El papel de la transglutaminase-2 y sus sustratos en las enfermedades humanas". Frontiers in Bioscience. 11: 1758–73. doi:10.2741/1921. PMID 16368554.
- ^ McConkey DJ, Orrenius S (octubre de 1997). "El papel del calcio en la regulación de la apoptosis". Biochemical and Biophysical Research Communications. 239 (2): 357–66. CiteSeerX 10.1.1.483.2738. doi:10.1006/bbrc.1997.7409. PMID 9344835. S2CID 11242870.
- ^ Lortat-Jacob H, Burhan I, Scarpellini A, Thomas A, Imberty A, Vivès RR, Johnson T, Gutierrez A, Verderio EA (mayo de 2012). "Traglutaminase-2 interacción con la heparina: identificación de un sitio de unión heparina que regula la adherencia celular a la matriz fibronectina-transglutaminase-2". El Diario de Química Biológica. 287 (22): 18005-17. doi:10.1074/jbc.M111.337089. PMC 3365763. PMID 22442151.
- ^ Akimov SS, Krylov D, Fleischman LF, Belkin AM (febrero 2000). "La transglutaminasa de tejido es un Coreceptor de adherencia de unión integrina para la fibronectina". The Journal of Cell Biology. 148 (4): 825–38. doi:10.1083/jcb.148.4.825. PMC 2169362. PMID 10684262.
- ^ a b c d Griffin M, Casadio R, Bergamini CM (diciembre de 2002). "Transglutaminas: colas biológicas de la naturaleza". The Biochemical Journal. 368 (Pt 2): 377–96. doi:10.1042/BJ20021234. PMC 1223021. PMID 12366374.
- ^ a b c d e f Diraimondo TR, Klöck C, Khosla C (abril de 2012). "Interferon-γ activa la transglutaminase 2 a través de una vía dependiente de fosfatidylinositol-3-kinasa: implicaciones para la terapia de espinas celíacas". The Journal of Pharmacology and Experimental Therapeutics. 341 (1): 104–14. doi:10.1124/jpet.111.187385. PMC 3310700. PMID 22228808.
- ^ a b Di Sabatino A, Vanoli A, Giuffrida P, Luinetti O, Solcia E, Corazza GR (agosto 2012). "La función de la transglutaminasa de tejido en la enfermedad celíaca". Reseñas de autoinmunidad. 11 (10): 746–53. doi:10.1016/j.autrev.2012.01.007. PMID 22326684.
- ^ a b c d Király R, Csosz E, Kurtán T, Antus S, Szigeti K, Simon-Vecsei Z, Korponay-Szabó IR, Keresztessy Z, Fésüs L (diciembre de 2009). "Importancia positiva de cinco sitios no canónicos Ca2+ de unión de transglutaminase humana 2 caracterizados por mutagénesis dirigida por el sitio". The FEBS Journal. 276 (23): 7083–96. doi:10.1111/j.1742-4658.2009.07420.x. PMID 19878304. S2CID 21883387.
- ^ "Entrez Gene: TGM2 transglutaminase 2".
- ^ a b Hitomi K, Kojima S, Fesus L (2015). Transglutaminas: múltiples modificadores funcionales y objetivos para el nuevo descubrimiento de drogas. Tokio. ISBN 9784431558255. OCLC 937392418.
{{cite book}}: CS1 maint: localización desaparecido editor (link) - ^ Pinkas DM, Strop P, Brunger AT, Khosla C (diciembre de 2007). "Transglutaminase 2 sufre un gran cambio conformacional a la activación". PLOS Biología. 5 (12): e327. doi:10.1371/journal.pbio.0050327. PMC 2140088. PMID 18092889.
- ^ Liu S, Cerione RA, Clardy J (marzo de 2002). "Base estructural para la actividad de unión de nucleótidos guaninos de la transglutaminasa del tejido y su regulación de la actividad de transamidación". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 99 (5): 2743–7. Bibcode:2002 PNAS...99.2743L. doi:10.1073/pnas.042454899. PMC 122418. PMID 11867708.
- ^ Han BG, Cho JW, Cho YD, Jeong KC, Kim SY, Lee BI (agosto de 2010). "La estructura de cristal de la transglutaminasa humana 2 en complejo con triphosfato adenosina". International Journal of Biological Macromolecules. 47 (2): 190-5. doi:10.1016/j.ijbiomac.2010.04.023. PMID 20450932.
- ^ a b c Stamnaes J, Pinkas DM, Fleckenstein B, Khosla C, Sollid LM (agosto 2010). "Regulación de redox de la actividad transglutaminase 2". El Diario de Química Biológica. 285 (33): 25402-9. doi:10.1074/jbc.M109.097162. PMC 2919103. PMID 20547769.
- ^ Chen X, Hnida K, Graewert MA, Andersen JT, Iversen R, Tuukkanen A, Svergun D, Sollid LM (agosto de 2015). "Structural Basis for Antigen Recognition by Transglutaminase 2-specific Autoantibodies in Celiac Disease". El Diario de Química Biológica. 290 (35): 21365–75. doi:10.1074/jbc.M115.669895. PMC 4571865. PMID 26160175.
- ^ Bianchi N, Beninati S, Bergamini CM (mayo de 2018). "Spotlight on the transglutaminase 2 gene: a focus on genomic and transcriptional aspects" (PDF). The Biochemical Journal. 475 (9): 1643-1667. doi:10.1042/BCJ20170601. hdl:11392/2388638. PMID 29764956.
- ^ a b c d e Jin X, Stamnaes J, Klöck C, DiRaimondo TR, Sollid LM, Khosla C (octubre de 2011). "Activación de transglutaminase extracelular 2 por tioredoxina". El Diario de Química Biológica. 286 (43): 37866–73. doi:10.1074/jbc.M111.287490. PMC 3199528. PMID 21908620.
- ^ a b c d e Yi MC, Melkonian AV, Ousey JA, Khosla C (febrero 2018). "Proteína reticulosa endoplasmática 57 (ERp57) inactiva oxidativamente la transglutaminasa humana 2". El Diario de Química Biológica. 293 (8): 2640–2649. doi:10.1074/jbc.RA117.001382. PMC 5827427. PMID 29305423.
- ^ Pinkas DM, Strop P, Brunger AT, Khosla C (diciembre de 2007). "Transglutaminase 2 sufre un gran cambio conformacional a la activación". PLOS Biología. 5 (12): e327. doi:10.1371/journal.pbio.0050327. PMC 2140088. PMID 18092889.
- ^ Colak G, Keillor JW, Johnson GV (enero de 2011). Polymenis M (ed.). "Cytosolic guanine nucledotide binding de forma deficiente de transglutaminase 2 (R580a) potencia la muerte celular en la privación de glucosa de oxígeno". PLOS ONE. 6 (1): e16665. Bibcode:2011PLoSO...616665C. doi:10.1371/journal.pone.0016665. PMC 3031627. PMID 21304968.
- ^ Quinn BR, Yunes-Medina L, Johnson GV (Julio 2018). "Transglutaminase 2: Amigo o enemigo? El papel discordante en neuronas y astrocitos". Journal of Neuroscience Research. 96 (7): 1150–1158. doi:10.1002/jnr.24239. PMC 5980740. PMID 29570839.
- ^ Nurminskaya MV, Belkin AM (2012). Funciones celulares de transglutaminase del tejido. International Review of Cell and Molecular Biology. Vol. 294. pp. 1–97. doi:10.1016/B978-0-12-394305-7.00001-X. ISBN 9780123943057. PMC 3746560. PMID 22364871.
- ^ Fesus L, Piacentini M (octubre de 2002). "Transglutaminase 2: una enzima enigmática con diversas funciones". Tendencias en Ciencias Bioquímicas. 27 (10): 534–9. doi:10.1016/S0968-0004(02)02182-5. PMID 12368090.
- ^ Mishra S, Murphy LJ (junio de 2004). "La transglutaminasa de tejido tiene actividad intrínseca de la cinasa: identificación de la transglutaminase 2 como una proteína de unión de factor de crecimiento similar a la insulina-3 kinase". El Diario de Química Biológica. 279 (23): 23863-8. doi:10.1074/jbc.M3119200. PMID 15069073.
- ^ Hasegawa G, Suwa M, Ichikawa Y, Ohtsuka T, Kumagai S, Kikuchi M, Sato Y, Saito Y (agosto de 2003). "Una función novedosa de transglutaminasa tipo tejido: isomerasa de disulfuro de proteínas". The Biochemical Journal. 373 (Pt 3): 793–803. doi:10.1042/BJ20021084. PMC 1223550. PMID 12737632.
- ^ Sakly W, Thomas V, Quash G, El Alaoui S (diciembre de 2006). "Un papel para la transglutaminasa tisular en citotoxicidad alfa-gliadina". Inmunología clínica y experimental. 146 (3): 550–8. doi:10.1111/j.1365-2249.2006.03236.x. PMC 1810403. PMID 17100777.
- ^ a b Tabolacci C, De Martino A, Mischiati C, Feriotto G, Beninati S (enero 2019). "El papel de la transglutaminasa de tejido en la iniciación, supervivencia y progresión de células cancerosas". Ciencias médicas. 7 2): 19. doi:10.3390/medsci7020019. PMC 6409630. PMID 30691081.
- ^ a b Rossin F, Villella VR, D'Eletto M, Farrace MG, Esposito S, Ferrari E, Monzani R, Occhigrossi L, Pagliarini V, Sette C, Cozza G, Barlev NA, Falasca L, Fimia GM, Kroemer G, Raia V, Maiuri L, Piacentini M (Julio 2018). "TG2 regula la respuesta de calor-shock por la modificación post-translacional de HSF1". EMBO Informes. 19 (7): e45067. doi:10.15252/embr.201745067. PMC 6030705. PMID 29752334.
- ^ a b c Lorand L, Iismaa SE (enero 2019). "Las enfermedades de la transglutaminación: de la bioquímica a la cama". FASEB Journal. 33 (1): 3–12. doi:10.1096/fj.201801544RPMID 30593123. S2CID 58551851.
- ^ Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, Schuppan D (julio de 1997). "Identificación de la transglutaminasa tisular como el autoantigeno de la enfermedad celíaca". Nature Medicine. 3 (7): 797–801. doi:10.1038/nm0797-797. S2CID 20033968.
- ^ Murray JA, Frey MR, Oliva-Hemker M (junio 2018). "La enfermedad celíaca". Gastroenterología. 154 8): 2005–2008. doi:10.1053/j.gastro.2017.12.026. 6203336. PMID 29550590.
- ^ Eckert, Richard L. (2019-01-29). "Transglutaminase 2 toma el estadio central como factor de supervivencia de células cancerosas y objetivo de terapia: Transglutaminase in cancer". Carcinogénesis molecular. 58 (6): 837–853. doi:10.1002/mc.22986. 7754084. PMID 30693974. S2CID 59341070.
- ^ Wilhelmus MM, Verhaar R, Andringa G, Bol JG, Cras P, Shan L, Hoozemans JJ, Drukarch B (marzo 2011). "La presencia de transglutaminasa tisular en reticulum endoplasmático granular es característica de las neuronas melanizadas en el cerebro de la enfermedad de Parkinson". Brain Pathology. 21 (2): 130–9. doi:10.1111/j.1750-3639.2010.00429.x. PMC 8094245PMID 20731657. S2CID 586174.
- ^ Ricotta M, Iannuzzi M, Vivo GD, Gentile V (mayo de 2010). "Los roles psicopatológicos de las reacciones de transglutaminase-catalyzed". World Journal of Biological Chemistry. 1 (5): 181–7. doi:10.4331/wjbc.v1.i5.181. PMC 3083958. PMID 21541002.
- ^ Martin A, Giuliano A, Collaro D, De Vivo G, Sedia C, Serretiello E, Gentile V (enero de 2013). "Posible implicación de reacciones de transglutaminase-catalyzed en la fisiopatología de las enfermedades neurodegenerativas". Amino Acids. 44 (1): 111–8. doi:10.1007/s00726-011-1081-1. PMID 21938398. S2CID 16143202.
- ^ Kumar A, Kneynsberg A, Tucholski J, Perry G, van Groen T, Detloff PJ, Lesort M (septiembre de 2012). "La sobreexpresión de la transglutaminasa del tejido no modifica el fenotipo de enfermedad del modelo del ratón R6/2 de la enfermedad de Huntington". Neurología experimental. 237 (1): 78–89. doi:10.1016/j.expneurol.2012.05.015. PMC 3418489. PMID 22698685.
- ^ Sblattero D, Berti I, Trevisiol C, Marzari R, Tommasini A, Bradbury A, Fasano A, Ventura A, No T (Mayo 2000). "El tejido recombinante humano transglutaminase ELISA: un ensayo diagnóstico innovador para la enfermedad celíaca". El American Journal of Gastroenterology. 95 (5): 1253–7. doi:10.1111/j.1572-0241.2000.02018.x. PMID 10811336. S2CID 11018740.
- ^ Wang Z, Stuckey DJ, Murdoch CE, Camelliti P, Lip GY, Griffin M (abril 2018). "La fibrosis cardiaca se puede atenuar bloqueando la actividad de la transglutaminasa 2 utilizando un inhibidor selectivo de moléculas pequeñas". Muerte celular. 9 (6): 613. doi:10.1038/s41419-018-0573-2. PMC 5966415. PMID 29795262.
- ^ a b Min B, Chung KC (enero 2018). "Nuevo conocimiento de la transglutaminasa 2 y enlace a las enfermedades neurodegenerativas". BMB Reports. 51 (1): 5–13. doi:10.5483/BMBRep.2018.51.1.227. PMC 5796628. PMID 29187283.
- ^ Kanchan K, Fuxreiter M, Fésüs L (agosto de 2015). "Physiological, pathological, and structural implications of non-enzymatic protein-protein interactions of the multifunctional human transglutaminase 2". Ciencias de la vida celular y molecular. 72 (16): 3009–35. doi:10.1007/s00018-015-1909-z. PMC 11113818. PMID 25943306. S2CID 14849506.
Enlaces externos
- Anticuerpos endomysial Archivado 2021-05-12 en la máquina Wayback
- Una colección de sustratos y socios de interacción de TG2 es accesible en el TRANSDAB, una base de datos interactiva de sustrato de transglutaminase.