Cuantización
Cuantización es el proceso de restringir una entrada de un conjunto de valores continuo o grande a un conjunto discreto (como los números enteros). El... (leer más)
Transferencia horizontal de genes (HGT) o transferencia lateral de genes (LGT) es el movimiento de material genético entre organismos unicelulares y/o multicelulares que no sea por la transmisión ("vertical") de ADN de padres a hijos (reproducción). HGT es un factor importante en la evolución de muchos organismos. HGT está influyendo en la comprensión científica de la evolución de orden superior al tiempo que cambia de manera más significativa las perspectivas sobre la evolución bacteriana.
La transferencia horizontal de genes es el mecanismo principal para la propagación de la resistencia a los antibióticos en las bacterias y desempeña un papel importante en la evolución de las bacterias que pueden degradar compuestos novedosos como los pesticidas creados por humanos y en la evolución, el mantenimiento y la transmisión de virulencia. A menudo involucra bacteriófagos templados y plásmidos. Los genes responsables de la resistencia a los antibióticos en una especie de bacteria pueden transferirse a otra especie de bacteria a través de varios mecanismos de HGT, como la transformación, la transducción y la conjugación, lo que posteriormente arma a los genes resistentes a los antibióticos. receptor contra los antibióticos. La rápida propagación de genes de resistencia a los antibióticos de esta manera se está convirtiendo en un desafío para manejar en el campo de la medicina. Los factores ecológicos también pueden desempeñar un papel en la HGT de los genes resistentes a los antibióticos.
La transferencia horizontal de genes se reconoce como un proceso evolutivo generalizado que distribuye genes entre linajes procariotas divergentes y también puede involucrar a eucariotas. Se postula que HGT promueve el mantenimiento de una bioquímica vital universal y, posteriormente, la universalidad del código genético.
El experimento de Griffith, informado en 1928 por Frederick Griffith, fue el primer experimento que sugirió que las bacterias son capaces de transferir información genética a través de un proceso conocido como transformación. Los hallazgos de Griffith fueron seguidos por una investigación a fines de la década de 1930 y principios de la de 1940 que aisló el ADN como el material que comunica esta información genética.
La transferencia genética horizontal se describió en Seattle en 1951, en un artículo que demostraba que la transferencia de un gen viral a Corynebacterium diphtheriae creaba una cepa virulenta a partir de una cepa no virulenta, y también resolvía simultáneamente el enigma de la difteria (que los pacientes pueden estar infectados con la bacteria pero no tener ningún síntoma, y luego convertirse repentinamente más tarde o nunca), y dar el primer ejemplo de la relevancia del ciclo lisogénico. La transferencia de genes interbacterianos se describió por primera vez en Japón en una publicación de 1959 que demostró la transferencia de resistencia a los antibióticos entre diferentes especies de bacterias. A mediados de la década de 1980, Syvanen postuló que la transferencia lateral de genes biológicamente significativa ha existido desde el comienzo de la vida en la Tierra y ha estado involucrada en la configuración de toda la historia evolutiva.
Como lo expresaron Jian, Rivera y Lake (1999): "Cada vez más, los estudios de genes y genomas indican que ha ocurrido una transferencia horizontal considerable entre procariotas" (ver también Lake y Rivera, 2007). El fenómeno parece haber tenido algún significado también para los eucariotas unicelulares. Como Baptiste et al. (2005) observan, "evidencia adicional sugiere que la transferencia de genes también podría ser un mecanismo evolutivo importante en la evolución de los protistas".
El injerto de una planta a otra puede transferir cloroplastos (orgánulos en las células vegetales que realizan la fotosíntesis), ADN mitocondrial y todo el núcleo celular que contiene el genoma para crear potencialmente una nueva especie. Algunos lepidópteros (por ejemplo, las mariposas monarca y los gusanos de seda) han sido modificados genéticamente mediante la transferencia horizontal de genes del bracovirus de la avispa. Las picaduras de insectos de la familia Reduviidae (insectos asesinos) pueden, a través de un parásito, infectar a los humanos con la enfermedad de Chagas tripanosómica, que puede insertar su ADN en el genoma humano. Se ha sugerido que la transferencia lateral de genes a humanos desde bacterias puede desempeñar un papel en el cáncer.
Aaron Richardson y Jeffrey D. Palmer afirman: "La transferencia horizontal de genes (HGT, por sus siglas en inglés) ha jugado un papel importante en la evolución bacteriana y es bastante común en ciertos eucariotas unicelulares. Sin embargo, la prevalencia y la importancia de la HGT en la evolución de los eucariotas multicelulares siguen sin estar claras."
Debido a la creciente cantidad de evidencia que sugiere la importancia de estos fenómenos para la evolución (ver más abajo), biólogos moleculares como Peter Gogarten han descrito la transferencia horizontal de genes como "Un nuevo paradigma para la biología".
Existen varios mecanismos para la transferencia horizontal de genes:
Un elemento transponible (TE) (también llamado transposón o gen saltador) es un segmento móvil de ADN que a veces puede tomar un gen de resistencia e insertarlo en un plásmido o cromosoma, lo que induce la transferencia horizontal de genes de resistencia a los antibióticos.
La transferencia horizontal de transposones (HTT) se refiere al paso de fragmentos de ADN que se caracterizan por su capacidad para moverse de un locus a otro entre genomas por medios distintos a la herencia de padres a hijos. Durante mucho tiempo se pensó que la transferencia horizontal de genes era crucial para la evolución procariótica, pero hay una cantidad creciente de datos que muestran que la HTT también es un fenómeno común y generalizado en la evolución eucariota. En el lado de los elementos transponibles, la propagación entre genomas a través de la transferencia horizontal puede verse como una estrategia para escapar de la purga debida a la selección purificadora, la descomposición mutacional y/o los mecanismos de defensa del huésped.
HTT puede ocurrir con cualquier tipo de elementos transponibles, pero es más probable que los transposones de ADN y los retroelementos LTR sean capaces de HTT porque ambos tienen un intermedio de ADN bicatenario estable que se cree que es más resistente que el ARN monocatenario. intermedio de retroelementos no LTR, que pueden ser altamente degradables. Es menos probable que los elementos no autónomos se transfieran horizontalmente en comparación con los elementos autónomos porque no codifican las proteínas necesarias para su propia movilización. La estructura de estos elementos no autónomos consiste generalmente en un gen sin intrones que codifica una proteína transposasa y puede tener o no una secuencia promotora. Aquellos que no tienen secuencias promotoras codificadas dentro de la región móvil dependen de los promotores anfitriones adyacentes para la expresión. Se cree que la transferencia horizontal juega un papel importante en el ciclo de vida de TE.
Se ha demostrado que HTT ocurre entre especies y en todos los continentes tanto en plantas como en animales (Ivancevic et al. 2013), aunque se ha demostrado que algunos TE colonizan con más éxito los genomas de ciertas especies que otros. Se ha propuesto la proximidad espacial y taxonómica de las especies para favorecer los HTT en plantas y animales. Se desconoce cómo la densidad de una población puede afectar la tasa de eventos de HTT dentro de una población, pero se ha propuesto que la proximidad debido al parasitismo y la contaminación cruzada debido al hacinamiento favorecen la HTT tanto en plantas como en animales. La transferencia exitosa de un elemento transponible requiere la entrega de ADN del donante a la célula huésped (ya la línea germinal para organismos multicelulares), seguida de la integración en el genoma del huésped receptor. Aunque se desconoce el mecanismo real para el transporte de TE desde las células del donante a las células huésped, se ha establecido que el ADN y el ARN desnudos pueden circular en los fluidos corporales. Muchos vectores propuestos incluyen artrópodos, virus, caracoles de agua dulce (Ivancevic et al. 2013), bacterias endosimbióticas y bacterias parasitarias intracelulares. En algunos casos, incluso los TE facilitan el transporte de otros TE.
La llegada de un nuevo TE en el genoma de un huésped puede tener consecuencias perjudiciales porque la movilidad del TE puede inducir una mutación. Sin embargo, HTT también puede ser beneficioso al introducir nuevo material genético en un genoma y promover la mezcla de genes y dominios TE entre anfitriones, que pueden ser cooptados por el genoma del huésped para realizar nuevas funciones. Además, la actividad de transposición aumenta el número de copias de TE y genera puntos críticos de reordenamiento cromosómico. La detección de HTT es una tarea difícil porque es un fenómeno continuo que cambia constantemente en la frecuencia de aparición y la composición de los TE dentro de los genomas del huésped. Además, se han analizado pocas especies para HTT, lo que dificulta establecer patrones de eventos de HTT entre especies. Estos problemas pueden conducir a la subestimación o sobreestimación de los eventos HTT entre especies eucariotas ancestrales y actuales.
La transferencia horizontal de genes generalmente se infiere utilizando métodos bioinformáticos, ya sea mediante la identificación de firmas de secuencias atípicas (métodos "paramétricos") o mediante la identificación de fuertes discrepancias entre la historia evolutiva de secuencias particulares en comparación con la de sus anfitriones. El gen transferido (xenólogo) que se encuentra en la especie receptora está más estrechamente relacionado con los genes de la especie donante de lo que cabría esperar.
El virus llamado Mimivirus infecta las amebas. Otro virus, llamado Sputnik, también infecta a las amebas, pero no puede reproducirse a menos que el mimivirus ya haya infectado la misma célula. El genoma de 'Sputnik' revela más información sobre su biología. Aunque 13 de sus genes muestran poca similitud con cualquier otro gen conocido, tres están estrechamente relacionados con los genes de mimivirus y mamavirus, quizás canibalizados por el pequeño virus mientras empaquetaba partículas en algún momento de su historia. Esto sugiere que el virus satélite podría realizar una transferencia horizontal de genes entre virus, de forma paralela a la forma en que los bacteriófagos transportan genes entre bacterias. También se observa transferencia horizontal entre geminivirus y plantas de tabaco.
La transferencia horizontal de genes es común entre bacterias, incluso entre parientes muy lejanos. Se cree que este proceso es una causa importante del aumento de la resistencia a los medicamentos cuando una célula bacteriana adquiere resistencia y los genes de resistencia se transfieren a otras especies. La transposición y la transferencia horizontal de genes, junto con fuertes fuerzas selectivas naturales, han dado lugar a cepas de S resistentes a múltiples fármacos. aureus y muchas otras bacterias patógenas. La transferencia horizontal de genes también desempeña un papel en la propagación de factores de virulencia, como exotoxinas y exoenzimas, entre las bacterias. Un excelente ejemplo sobre la propagación de exotoxinas es la evolución adaptativa de las toxinas Shiga en E. coli a través de la transferencia horizontal de genes a través de la transducción con especies de bacterias Shigella. Se han propuesto estrategias para combatir ciertas infecciones bacterianas dirigiéndose a estos factores de virulencia específicos y elementos genéticos móviles. Por ejemplo, los elementos genéticos transferidos horizontalmente juegan un papel importante en la virulencia de E. coli, Salmonella, Streptococcus y Clostridium perfringens.
En procariotas, se sabe que los sistemas de restricción-modificación brindan inmunidad contra la transferencia horizontal de genes y en la estabilización de elementos genéticos móviles. Se ha informado que los genes que codifican sistemas de modificación de restricción se mueven entre genomas procarióticos dentro de elementos genéticos móviles (MGE) como plásmidos, profagos, secuencias de inserción/transposones, elementos conjugativos integradores (ICE) e integrones. Aún así, son más frecuentemente una barrera cromosómica codificada para MGE que una herramienta codificada por MGE para la infección celular.
Se ha informado sobre la transferencia lateral de genes a través de un elemento genético móvil, a saber, el elemento conjugativo integrado (ICE) Bs1 por su papel en la respuesta SOS al daño global del ADN del grampositivo Bacillus subtilis . Además, se ha relacionado con la resistencia a la radiación y la desecación de las esporas de Bacillus pumilus SAFR-032, aisladas de las instalaciones de salas limpias de naves espaciales.
Se ha informado que los elementos de inserción de transposones aumentan la aptitud de E gramnegativo. coli a través de transposiciones importantes o reordenamientos del genoma, y aumento de las tasas de mutación. En un estudio sobre los efectos de la exposición a largo plazo de la microgravedad simulada en la E. coli, los resultados mostraron que las inserciones de transposones ocurren en los loci, vinculados a la respuesta al estrés SOS. Cuando el mismo E. coli fue expuesta a una combinación de microgravedad simulada y niveles traza (de fondo) de antibiótico (de amplio espectro) (cloranfenicol), los resultados mostraron reordenamientos mediados por transposones (TMR), alterando los genes involucrados en la adhesión bacteriana y eliminando un segmento completo de varios genes involucrados con la motilidad y la quimiotaxis. Ambos estudios tienen implicaciones para el crecimiento microbiano, la adaptación y la resistencia a los antibióticos en condiciones espaciales en tiempo real.
La transferencia horizontal de genes es particularmente activa en los genomas bacterianos en torno a la producción de metabolitos secundarios o especializados. Esto se muestra claramente dentro de ciertos grupos de bacterias incluyendo P. aeruginosa y actinomycetales, un orden de Actinomycetota. Las policétido sintasas (PKS) y los grupos de genes biosintéticos proporcionan organizaciones modulares de genes asociados, lo que hace que estas bacterias estén bien adaptadas para adquirir y desechar módulos útiles modificaciones a través de HGT. Ciertas áreas de genes conocidas como puntos críticos aumentan aún más la probabilidad de que los genes productores de metabolitos secundarios se transfieran horizontalmente. La promiscuidad de las enzimas es un tema recurrente en este teatro en particular.
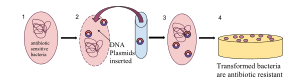
La transformación natural es una adaptación bacteriana para la transferencia de ADN (HGT) que depende de la expresión de numerosos genes bacterianos cuyos productos son los responsables de este proceso. En general, la transformación es un proceso de desarrollo complejo que requiere energía. Para que una bacteria se una, tome y recombine el ADN exógeno en su cromosoma, debe volverse competente, es decir, entrar en un estado fisiológico especial. El desarrollo de competencias en Bacillus subtilis requiere la expresión de unos 40 genes. El ADN integrado en el cromosoma huésped normalmente (pero con excepciones poco frecuentes) se deriva de otra bacteria de la misma especie y, por lo tanto, es homólogo al cromosoma residente. La capacidad de transformación natural se da en al menos 67 especies procarióticas. La competencia para la transformación es típicamente inducida por una alta densidad celular y/o una limitación nutricional, condiciones asociadas con la fase estacionaria del crecimiento bacteriano. La competencia parece ser una adaptación para la reparación del ADN. La transformación en bacterias puede verse como un proceso sexual primitivo, ya que implica la interacción de ADN homólogo de dos individuos para formar ADN recombinante que se transmite a las generaciones sucesivas. Aunque la transducción es la forma de HGT más comúnmente asociada con los bacteriófagos, ciertos fagos también pueden promover la transformación.
Conjugación en Mycobacterium smegmatis, como conjugación en E. coli, requiere un contacto estable y prolongado entre una cepa donante y una receptora, es resistente a la ADNasa y el ADN transferido se incorpora al cromosoma receptor mediante recombinación homóloga. Sin embargo, a diferencia de E. coli alta frecuencia de conjugación de recombinación (Hfr), la conjugación micobacteriana es un tipo de HGT que se basa en cromosomas en lugar de plásmidos. Además, en contraste con E. coli (Hfr) conjugación, en M. smegmatis todas las regiones del cromosoma se transfieren con eficiencias comparables. Se encontró una mezcla sustancial de los genomas parentales como resultado de la conjugación, y se consideró que esta mezcla recordaba a la observada en los productos meióticos de la reproducción sexual.
El archaeon Sulfolobus solfataricus, cuando se irradia con UV, induce fuertemente la formación de pili tipo IV que luego facilita la agregación celular. La exposición a agentes químicos que dañan el ADN también induce la agregación celular. Otros estresores físicos, como el cambio de temperatura o el pH, no inducen la agregación, lo que sugiere que el daño del ADN es un inductor específico de la agregación celular.
La agregación celular inducida por UV media el intercambio de marcadores HGT cromosómicos intercelulares con alta frecuencia, y los cultivos inducidos por UV muestran tasas de recombinación que superan las de los cultivos no inducidos en hasta tres órdenes de magnitud. S. solfataricus se agregan preferentemente con otras células de su propia especie. Frols et al. y Ajon et al. sugirió que la transferencia de ADN inducible por UV es probablemente un mecanismo importante para proporcionar una mayor reparación del ADN dañado a través de la recombinación homóloga. Este proceso puede considerarse como una forma simple de interacción sexual.
Otra especie termófila, Sulfolobus acidocaldarius, es capaz de someterse a la HGT. S. acidocaldarius puede intercambiar y recombinar marcadores cromosómicos a temperaturas de hasta 84 °C. La exposición a los rayos UV induce la formación de pili y la agregación celular. Las células con la capacidad de agregarse tienen una mayor supervivencia que las mutantes que carecen de pili y que no pueden agregarse. La frecuencia de la recombinación aumenta por el daño del ADN inducido por la radiación UV y por los productos químicos que dañan el ADN.
El operón ups, que contiene cinco genes, es altamente inducido por la radiación ultravioleta. Las proteínas codificadas por el operón ups se emplean en el ensamblaje de pili inducido por UV y la agregación celular que conduce al intercambio de ADN intercelular y la recombinación homóloga. Dado que este sistema aumenta la aptitud de S. acidocaldarius células después de la exposición a los rayos UV, Wolferen et al. consideró que la transferencia de ADN probablemente tiene lugar para reparar los daños en el ADN inducidos por UV mediante recombinación homóloga.
"Las comparaciones de secuencias sugieren una transferencia horizontal reciente de muchos genes entre diversas especies, incluso a través de los límites de los 'dominios' filogenéticos. Por lo tanto, la determinación de la historia filogenética de una especie no se puede hacer de manera concluyente mediante la determinación de árboles evolutivos para genes individuales."
A través de la investigación sobre el creciente problema de la resistencia a los antibióticos, se ha observado que ciertos compuestos promueven la transferencia horizontal de genes. Se sabe que los antibióticos administrados a las bacterias a niveles no letales son una causa de la resistencia a los antibióticos, pero la investigación emergente ahora muestra que ciertos fármacos no antibióticos (ibuprofeno, naproxeno, gemfibrozilo, diclofenaco, propranolol, etc.) también tienen un papel en promover la resistencia a los antibióticos a través de su capacidad para promover la transferencia horizontal de genes (HGT) de los genes responsables de la resistencia a los antibióticos. La transferencia de genes de resistencia a los antibióticos (ARG) a través de la conjugación se acelera significativamente cuando las células donantes con plásmidos y las células receptoras se introducen entre sí en presencia de uno de los productos farmacéuticos. También se descubrió que los productos farmacéuticos no antibióticos causan algunas respuestas en las bacterias similares a las respuestas a los antibióticos, como el aumento de la expresión de los genes lexA, umuC, umuD y soxR involucrados en la respuesta SOS de las bacterias, así como también otros genes. expresada durante la exposición a los antibióticos. Estos hallazgos son de 2021 y, debido al uso generalizado de productos farmacéuticos no antibióticos, es necesario realizar más investigaciones para comprender mejor el problema.
Junto a los productos farmacéuticos no antibióticos, se han probado otros compuestos relevantes para la resistencia a los antibióticos, como el verde de malaquita, el etilbenceno, el estireno, la 2,4-dicloroanilina, el trioximetileno, las soluciones de o-xileno, el p-nitrofenol (PNP), el p-aminofenol (PAP) y fenol (PhOH). Es una preocupación mundial que se hayan encontrado ARG en plantas de tratamiento de aguas residuales. Se ha descubierto que las aguas residuales textiles contienen una abundancia de elementos genéticos móviles de 3 a 13 veces mayor que otras muestras de aguas residuales. La causa de esto son los compuestos orgánicos utilizados para teñir textiles (o-xileno, etilbenceno, trioximetileno, estireno, 2,4-dicloroanilina y verde de malaquita) que aumentan la frecuencia de transferencia conjugativa cuando se introducen bacterias y plásmidos (con donante) en la presencia de estas moléculas. Cuando las aguas residuales textiles se combinan con las aguas residuales de las aguas residuales domésticas, los ARG presentes en las aguas residuales se transfieren a un ritmo mayor debido a la adición de compuestos de tintura textil que aumentan la aparición de HGT.
Otros contaminantes orgánicos que se encuentran comúnmente en las aguas residuales han sido objeto de experimentos similares. Un estudio de 2021 usó métodos similares de usar plásmido en un donante y mezclarlo con un receptor en presencia de un compuesto para probar la transferencia horizontal de genes de genes de resistencia a los antibióticos, pero esta vez en presencia de compuestos fenólicos. Los compuestos fenólicos se encuentran comúnmente en las aguas residuales y se ha descubierto que cambian las funciones y estructuras de las comunidades microbianas durante el proceso de tratamiento de aguas residuales. Además, la HGT aumenta en frecuencia en presencia de los compuestos p-nitrofenol (PNP), p-aminofenol (PAP) y fenol. Estos compuestos dan como resultado un aumento de 2 a 9 veces en HGT (el p-nitrofenol se encuentra en el lado inferior de los aumentos de 2 veces y el p-aminofenol y el fenol tienen un aumento máximo de 9 veces). Este aumento en HGT es en promedio menor que los compuestos ibuprofeno, naproxeno, gemfibrozilo, diclofenaco, propranolol, o-xileno, etilbenceno, trioximetileno, estireno, 2,4-dicloroanilina y verde de malaquita, pero sus aumentos siguen siendo significativos. El estudio que llegó a esta conclusión es similar al estudio sobre la transferencia horizontal de genes y los productos farmacéuticos no antibióticos en el sentido de que se realizó en 2021 y deja espacio para más investigación, específicamente en el enfoque del estudio, que son los lodos activados.
También se ha descubierto que los metales pesados promueven la transferencia conjugativa de genes de resistencia a los antibióticos. El artículo que condujo al descubrimiento de esto se realizó en 2017 durante el campo emergente de la transferencia horizontal de genes que ayuda a la investigación de compuestos. Los metales ayudan en la propagación de la resistencia a los antibióticos a través de mecanismos tanto de corresistencia como de resistencia cruzada. En cantidades relevantes para el medio ambiente, Cu(II), Ag(I), Cr(VI) y Zn(II) promueven la HGT de cepas donantes y receptoras de E. coli. La presencia de estos metales desencadenó la respuesta SOS de las células bacterianas y las hizo más permeables. Estos son los mecanismos que hacen que incluso los niveles bajos de contaminación por metales pesados en el medio ambiente tengan un impacto en la HGT y, por lo tanto, en la propagación de los ARG.
La ingeniería genética es esencialmente una transferencia genética horizontal, aunque con casetes de expresión sintética. El sistema de transposones Sleeping Beauty (SB) se desarrolló como un agente de transferencia de genes sintético que se basó en las capacidades conocidas de los transposones Tc1/mariner para invadir genomas de especies extremadamente diversas. El sistema SB se ha utilizado para introducir secuencias genéticas en una amplia variedad de genomas animales.
La transferencia horizontal de genes es un posible factor de confusión al inferir árboles filogenéticos basados en la secuencia de un gen. Por ejemplo, dadas dos bacterias lejanamente relacionadas que han intercambiado un gen, un árbol filogenético que incluya esas especies mostrará que están estrechamente relacionadas porque ese gen es el mismo aunque la mayoría de los otros genes sean diferentes. Por esta razón, a menudo es ideal usar otra información para inferir filogenias sólidas, como la presencia o ausencia de genes o, más comúnmente, incluir una gama de genes tan amplia como sea posible para el análisis filogenético.
Por ejemplo, el gen más común que se usa para construir relaciones filogenéticas en procariotas es el gen del ARN ribosómico 16S, ya que sus secuencias tienden a conservarse entre miembros con distancias filogenéticas cercanas, pero lo suficientemente variables como para que se puedan medir las diferencias. Sin embargo, en los últimos años también se ha argumentado que los genes 16s rRNA también pueden transferirse horizontalmente. Aunque esto puede ser poco frecuente, la validez de los árboles filogenéticos construidos con ARNr 16s debe reevaluarse.
El biólogo Johann Peter Gogarten sugiere que "la metáfora original de un árbol ya no se ajusta a los datos de investigaciones genómicas recientes" por lo tanto, "los biólogos deberían usar la metáfora de un mosaico para describir las diferentes historias combinadas en genomas individuales y usar la metáfora de una red para visualizar el rico intercambio y los efectos cooperativos de la HGT entre los microbios". Existen varios métodos para inferir tales redes filogenéticas.
Usando genes individuales como marcadores filogenéticos, es difícil rastrear la filogenia del organismo en presencia de transferencia horizontal de genes. La combinación del modelo de coalescencia simple de cladogénesis con eventos raros de transferencia horizontal de genes HGT sugiere que no hubo un solo ancestro común más reciente que contuviera todos los genes ancestrales a los compartidos entre los tres dominios de la vida. Cada molécula contemporánea tiene su propia historia y se remonta a un antecesor de molécula individual. Sin embargo, es probable que estos ancestros moleculares estuvieran presentes en diferentes organismos en diferentes momentos."
La transferencia horizontal de genes plantea un posible desafío al concepto del último ancestro común universal (LUCA) en la raíz del árbol de la vida formulado por primera vez por Carl Woese, que lo llevó a proponer Archaea como un tercer dominio de la vida. De hecho, fue mientras se examinaba la nueva visión de la vida de los tres dominios que la transferencia horizontal de genes surgió como un tema complicado: Archaeoglobus fulgidus fue visto como una anomalía con respecto a un árbol filogenético basado en la codificación de la enzima HMGCoA reductasa: el organismo en cuestión es un Archaean definido, con todos los lípidos celulares y la maquinaria de transcripción que se espera de un Archaean, pero cuyos genes HMGCoA son de origen bacteriano. Los científicos están ampliamente de acuerdo con la simbiogénesis, que las mitocondrias en los eucariotas derivan de células alfa-proteobacterianas y que los cloroplastos provienen de cianobacterias ingeridas, y otras transferencias de genes pueden haber afectado a los primeros eucariotas. (En contraste, los eucariotas multicelulares tienen mecanismos para prevenir la transferencia horizontal de genes, incluidas las células germinales separadas). Si hubiera habido una transferencia de genes continua y extensa, habría una red compleja con muchos ancestros, en lugar de un árbol de la vida con linajes claramente definidos. que conduce de nuevo a un LUCA. Sin embargo, se puede identificar un LUCA, por lo que las transferencias horizontales deben haber sido relativamente limitadas.
Se ha señalado que, a pesar de las complicaciones, la detección de transferencias horizontales de genes aporta valiosa información filogenética y de datación.
Recientemente se ha confirmado el potencial de HGT para fechar filogenias.
La adquisición de nuevos genes tiene el potencial de desorganizar los otros elementos genéticos y obstaculizar la función de la célula bacteriana, afectando así la competitividad de las bacterias. En consecuencia, la adaptación bacteriana radica en un conflicto entre las ventajas de adquirir genes beneficiosos y la necesidad de mantener la organización del resto de su genoma. Los genes transferidos horizontalmente generalmente se concentran en solo ~ 1% del cromosoma (en regiones llamadas puntos de acceso). Esta concentración aumenta con el tamaño del genoma y con la tasa de transferencia. Los hotspots se diversifican por la rápida renovación de genes; su distribución cromosómica depende de los contextos locales (genes centrales vecinos) y del contenido en elementos genéticos móviles. Los hotspots concentran la mayoría de los cambios en los repertorios de genes, reducen el compromiso entre la diversificación y la organización del genoma, y deberían ser tesoros ocultos de genes adaptativos específicos de cepas. La mayoría de los elementos genéticos móviles y los genes de resistencia a los antibióticos se encuentran en puntos críticos, pero muchos puntos críticos carecen de elementos genéticos móviles reconocibles y exhiben una recombinación homóloga frecuente en los genes centrales flanqueantes. La sobrerrepresentación de puntos críticos con menos elementos genéticos móviles en bacterias naturalmente transformables sugiere que la recombinación homóloga y la transferencia horizontal de genes están estrechamente vinculadas en la evolución del genoma.
Existe evidencia de transferencia horizontal histórica de los siguientes genes:
Cuantización es el proceso de restringir una entrada de un conjunto de valores continuo o grande a un conjunto discreto (como los números enteros). El... (leer más)
El Estado del mundo fue una serie de libros publicados anualmente desde 1984 hasta 2017 por el Worldwatch Institute con sede en EE. UU., un grupo de expertos... (leer más)
Genético puede referirse... (leer más)