Toxina del cólera

La toxina del cólera (también conocida como choleragen y a veces abreviada como CTX, Ctx o CT) es un complejo proteico multimérico AB5 secretado por la bacteria Vibrio cholerae. La CTX es responsable de la diarrea acuosa masiva característica de la infección del cólera. Es un miembro de la familia de las enterotoxinas termolábiles.
Historia
Robert Koch, un médico y microbiólogo alemán, fue la primera persona en postular la existencia de la toxina del cólera. En 1886, Koch propuso que Vibrio cholerae secretaba una sustancia que causaba los síntomas del cólera. La postulación de Koch fue confirmada por el microbiólogo indio Sambhu Nath De, quien en 1951 estudió y documentó los efectos de inyectar a conejos bacterias del cólera muertas por calor. De concluyó a partir de este experimento que una endotoxina liberada al desintegrarse la bacteria era la causa de los síntomas del cólera. En 1959, De realizó otro experimento, esta vez utilizando un filtrado de cultivo libre de bacterias de V. Cholera inyectado en el intestino delgado de conejos. La acumulación de líquido resultante en los intestinos demostró de manera concluyente la existencia de una toxina.
Estructura
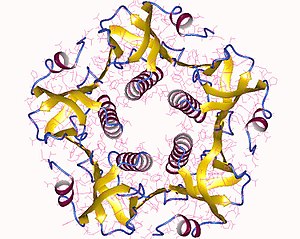
La toxina completa es un hexámero formado por una única copia de la subunidad A (parte A, enzimática, P01555) y cinco copias de la subunidad B (parte B, de unión al receptor, P01556), denominada AB5. La subunidad B se une mientras que la subunidad A activa la proteína G, que activa la adenilato ciclasa. La estructura tridimensional de la toxina fue determinada mediante cristalografía de rayos X por Zhang et al. en 1995.
Las cinco subunidades B, cada una con un peso de 11 kDa, forman un anillo de cinco miembros. La subunidad A, que pesa 28 kDa, tiene dos segmentos importantes. La porción A1 de la cadena (CTA1) es una carga enzimática globular que ribosila las proteínas G, mientras que la cadena A2 (CTA2) forma una hélice alfa extendida que se asienta cómodamente en el poro central del anillo de la subunidad B.
Esta estructura es similar en forma, mecanismo y secuencia a la enterotoxina termolábil secretada por algunas cepas de la bacteria Escherichia coli.
Patogenesis
La toxina del cólera actúa mediante el siguiente mecanismo: primero, el anillo de la subunidad B de la toxina del cólera se une a los gangliósidos GM1 en la superficie de las células diana. Si una célula carece de GM1, lo más probable es que la toxina se una a otros tipos de glicanos, como Lewis Y y Lewis X, unidos a proteínas en lugar de lípidos. Una vez unida, todo el complejo de la toxina es endocitado por la célula y la reducción de un puente disulfuro libera la cadena de la toxina del cólera A1 (CTA1). El endosoma se traslada al aparato de Golgi, donde la proteína A1 es reconocida por la chaperona del retículo endoplasmático (RE), la proteína disulfuro isomerasa. Luego, la cadena A1 se desdobla y se envía a la membrana, donde Ero1 desencadena la liberación de la proteína A1 por oxidación del complejo de proteína disulfuro isomerasa. A medida que la proteína A1 se desplaza desde el RE hacia el citoplasma a través del canal Sec61, se repliega y evita la desactivación como resultado de la ubiquitinación.
CTA1 queda entonces libre para unirse a una proteína asociada humana llamada ARF6 (factor 6 de ribosilación de ADP); la unión a Arf6 impulsa un cambio en la forma de CTA1 que expone su sitio activo y permite su actividad catalítica. El fragmento CTA1 cataliza la ribosilación de ADP de las proteínas de la subunidad alfa Gs (Gαs) utilizando NAD. La ribosilación de ADP hace que la subunidad Gαs pierda su actividad catalítica de hidrólisis de GTP en GDP + Pi, manteniendo así a Gαs en su estado activado. El aumento de la activación de Gαs conduce a un aumento de la actividad de la adenilato ciclasa, que aumenta la concentración intracelular de 3',5'-AMP cíclico (cAMP) a más de 100 veces por encima de lo normal y sobreactiva la PKA citosólica. Estas PKA activas fosforilan entonces las proteínas del canal de cloruro del regulador de la conductancia transmembrana de la fibrosis quística (CFTR), lo que conduce a un eflujo mediado por ATP de iones de cloruro y a la secreción de H2O, Na+, K+ y HCO3− en el lumen intestinal. Además, disminuye la entrada de Na+ y, en consecuencia, la entrada de agua en los enterocitos. Los efectos combinados dan como resultado una rápida pérdida de líquido del intestino, hasta 2 litros por hora, lo que conduce a una deshidratación grave y otros factores asociados con el cólera, incluida una deposición de agua de arroz.
La toxina pertussis (también una proteína AB5) producida por Bordetella pertussis actúa de manera similar, con la excepción de que ADP-ribosila la subunidad Gαi, lo que la vuelve incapaz de inhibir la producción de AMPc.
Origen

El gen que codifica la toxina del cólera se introdujo en V. cholerae mediante transferencia horizontal de genes. Las cepas virulentas de V. cholerae (los serogrupos O1 y O139) contienen genes de un virus conocido como bacteriófago CTXφ. El gen CTXφ integrado contiene muchos de los genes de RS1, un fago "satélite" filamentoso, incluidos elementos para la replicación (RstA), la integración (RstB) y la regulación de la expresión génica (RstR), así como genes que codifican proteínas necesarias para el empaquetamiento y la secreción del fago (Psh, Cep, OrfU, Ace y Zot), que son muy similares a los genes de los colifagos filamentosos Ff. Estos genes (y otros) permiten la replicación y posterior secreción del bacteriófago CTXφ, así como la codificación de CTX, lo que permite la transferencia horizontal de genes de CTXφ a otras células susceptibles.
Aplicaciones
Dado que la subunidad B parece ser relativamente no tóxica, los investigadores han encontrado varias aplicaciones para ella en biología celular y molecular. Se utiliza rutinariamente como trazador neuronal.
El tratamiento de células madre neuronales cultivadas de roedores con toxina del cólera induce cambios en la localización del factor de transcripción Hes3 y aumenta su número.
Los gangliósidos GM1 se encuentran en las balsas lipídicas de la superficie celular. Los complejos de subunidades B marcados con marcadores fluorescentes o posteriormente dirigidos con anticuerpos se pueden utilizar para identificar las balsas.
Vacuna
Actualmente existen dos vacunas contra el cólera: Dukoral y Shanchol. Ambas vacunas utilizan células enteras muertas de V. cholerae; sin embargo, Dukoral también contiene toxina colérica β recombinante (rCTB). Algunos estudios sugieren que la inclusión de rCTB puede mejorar la eficacia de la vacuna en niños pequeños (2-10) y aumentar la duración de la protección. Esto se ve contrarrestado por los costos de protección y almacenamiento de rCTB contra la degradación.
Vacuna adyuvante
Otra aplicación de la subunidad CTB puede ser como adyuvante de vacunas para otras vacunas. Se ha demostrado que la combinación de CTB y antígenos mejora la respuesta de la vacuna. Actualmente, el potencial adyuvante de CTB se ha demostrado en modelos animales grandes, por lo que se necesita más investigación. Esto puede permitir que CTB se utilice como adyuvante para vacunar contra muchos tipos de enfermedades, entre ellas, infecciones bacterianas y víricas, alergias y diabetes. Cabe destacar que, como se ha demostrado que CTB induce respuestas inmunitarias humorales de las mucosas, las vacunas contra virus de las mucosas, como el VIH, son un objetivo potencial.
Biología Membrane
Lipid rafts
Dado que se ha demostrado que la toxina del cólera se une preferentemente a los gangliósidos GM1, esta característica se puede utilizar para estudios de membranas. Las balsas lipídicas son difíciles de estudiar, ya que varían en tamaño y duración, además de ser parte de un componente extremadamente dinámico de las células. Usando la toxina del cólera β como marcador, podemos obtener una mejor comprensión de las propiedades y funciones de las balsas lipídicas.
Endocitosis
La endocitosis se divide en dos grandes grupos: el proceso dependiente de la clatrina y el proceso independiente de la clatrina, y la toxina del cólera utiliza ambas vías. Se ha demostrado que la toxina del cólera entra en las células a través de la endocitosis en múltiples vías. Estas vías incluyen caveolas, fosas recubiertas de clatrina, transportadores independientes de clatrina (CLIC), la vía de los compartimentos endocíticos enriquecidos con GPI (GEEC), la endocitosis mediada por ARF6 y la endocitosis rápida mediada por endofilina (FEME). No se entiende por completo cómo la toxina del cólera desencadena estas vías de endocitosis, pero el hecho de que la toxina del cólera desencadene estas vías muestra el uso de la toxina como un marcador importante para investigar estos mecanismos.
Tráfico de retrógrado
Uno de los aspectos más importantes de la toxina del cólera es el mecanismo de tráfico retrógrado que transporta la toxina desde la membrana celular de vuelta a la red trans-Golgi y al retículo endoplasmático. Dado que tanto la toxina del cólera como las especies GM1 pueden marcarse con marcadores fluorescentes, se puede controlar el mecanismo de tráfico retrógrado. Esto abre la posibilidad de controlar el mecanismo en tiempo real. Esto puede abrir la puerta a nuevos descubrimientos sobre cómo funciona el transporte intracelular y cómo funciona la clasificación de proteínas y lípidos en la vía endocítica.
Véase también
- Enterotoxin
- Ganglioside
Referencias
- ^ Ryan KJ; Ray CG, eds. (2004). Sherris Medical Microbiology (4a edición). McGraw Hill. p. 375. ISBN 978-0-8385-8529-0.
- ^ Faruque, Shah M; Nair, G. Balakrish, eds. (Julio de 2008). Vibrio cholerae: Genómica y biología molecular. Caister Academic Press. ISBN 978-1-904455-33-2.
- ^ Aizpurua-Olaizola, Oier; Sastre Torano, Javier; Pukin, Aliaksei; Fu, Ou; Boons, Geert Jan; de Jong, Gerhardus J.; Pieters, Roland J. (2018). " Electroforesis capilar de afinidad para la evaluación de la afinidad vinculante de los inhibidores de la toxina de cólera a base de carbohidratos". Electroforesis. 39 (2): 344–347. doi:10.1002/elps.201700207. ISSN 1522-2683. S2CID 33657660.
- ^ Bharati, Kaushik; Ganguly, Nirmal K. (Febrero de 2011). "Toxina de cúpula: paradigma de una proteína multifuncional". The Indian Journal of Medical Research. 133 (2): 179–187. ISSN 0971-5916. PMC 3089049. PMID 21415492.
- ^ a b De, S. N.; Sarkar, J. K.; Tribedi, B. P. (1951). "Un estudio experimental de la acción de la toxina cólera". The Journal of Pathology and Bacteriology. 63 (4): 707-717. doi:10.1002/path.1700630417. PMID 14898376.
- ^ De, S. N. (1959-05-30). "Enterotoxicidad de la cultura sin bacterias llena de cólera Vibrio". Naturaleza. 183 (4674): 1533–1534. doi:10.1038/1831533a0. ISSN 0028-0836. PMID 13666809.
- ^ Bharati, Kaushik; Ganguly, Nirmal K. (Febrero de 2011). "Toxina de cúpula: paradigma de una proteína multifuncional". The Indian Journal of Medical Research. 133 (2): 179–187. ISSN 0971-5916. PMC 3089049. PMID 21415492.
- ^ Zhang R, Scott D, Westbrook M, Nance S, Spangler B, Shipley G, Westbrook E (1995). "La estructura tridimensional de cristal de cólera toxina". J Mol Biol. 251 (4): 563–73. doi:10.1006/jmbi.1995.0456. PMID 7658473.
- ^ De Haan L, Hirst TR (2004). "Cholera toxin: un paradigma para el compromiso multifuncional de los mecanismos celulares (Review)". Mol. Biol. 21 (2): 77–92. doi:10.1080/09687680410001663267PMID 15204437. S2CID 22270979.
- ^ Amberlyn M Wands; Akiko Fujita (octubre de 2015). "La policosislación y la glucosilación de proteínas crean receptores funcionales para la toxina del cólera". eLife. 4: e09545. doi:10.7554/eLife.09545. PMC 4686427. PMID 26512888.
- ^ Cervin J, Wands AM, Casselbrant A, Wu H, Krishnamurthy S, Cvjetkovic A, et al. (2018). "GM1 ganglioside-independiente intoxicación por toxina de Cholera". PLOS Patógenos. 14 (2): e1006862. doi:10.1371/journal.ppat.1006862. PMC 5825173. PMID 29432456.
- ^ Wands AM, Cervin J, Huang H, Zhang Y, Youn G, Brautigam CA, Matson Dzebo M, Björklund P, Wallenius V, Bright DK, Bennett CS, Witung-Stafshede P, Sampson NS, Yrlid U, Kohler JJ (7 de febrero de 2018). "Molas fucosiladas Competitivamente interfieren con la cólera Toxin Binding a Host Cells". ACS Enfermedades Infecciosas. 4 (5): 758-770. doi:10.1021/acsinfecdis.7b00085. PMC 5948155. PMID 29411974.
- ^ Tsai, Billy; Rapoport, Tom A. (2002). "La toxina de cólera no desarrollada se transfiere a la membrana ER y se libera de la isomerasa de desulfido de proteínas sobre la oxidación por Ero1". Journal of Cell Biology. 159 (2): 207–216. doi:10.1083/jcb.200207120. PMC 2173060PMID 12403808. S2CID 3111310.
- ^ O'Neal C, Jobling M, Holmes R, Hol W (2005). "Base estructural para la activación de la toxina de cólera por ARF6-GTP humano". Ciencia. 309 (5737): 1093–6. Código: 2005 Sci...309.1093O. doi:10.1126/science.1113398. PMID 16099990. S2CID 8669389.
- ^ Joaquín Sánchez; Jan Holmgren (febrero de 2011). "Cholera toxin – A foe & a friend" (PDF). Indian Journal of Medical Research. 133: 158. Archivado desde el original (PDF) on 2013-02-03. Retrieved 2013-06-09.
- ^ Boron, W. F., " Boulpaep, E. L. (2009). Fisiología médica: un enfoque celular y molecular (2a edición). Philadelphia, Pennsylvania: Saunders/Elsevier.
- ^ a b c d Davis, Brigid M; Waldor, Matthew K (2003-02-01). "Filamentous phages linked to virulence of Vibrio cholerae". Opinión actual en microbiología. 6 (1): 35–42. doi:10.1016/S1369-5274(02)00005-X. ISSN 1369-5274.
- ^ Pierre-Hervé Luppi. "El descubrimiento de la cólera toxina como una poderosa herramienta neuroanatómica". Retrieved 2011-03-23.
- ^ Androutsellis-Theotokis A, Walbridge S, Park DM, Lonser RR, McKay RD (2010). "Cholera toxin regula una vía de señalización crítica para la expansión de las culturas de células madre neuronales del cerebro fetal y adulto roedor". PLOS ONE. 5 (5): e10841. Bibcode:2010PLoSO...510841A. doi:10.1371/journal.pone.0010841. PMC 2877108. PMID 20520777.
- ^ a b Baldauf, Keegan; Royal, Joshua; Hamorsky, Krystal; Matoba, Nobuyuki (2015). "Cholera Toxin B: One Subunit with Many Pharmaceutical Applications". Toxinas. 7 (3): 974–996. doi:10.3390/toxins7030974. PMC 4379537. PMID 25802972.
- ^ a b c Kenworthy, Anne K.; Schmieder, Stefanie S.; Raghunathan, Krishnan; Tiwari, Ajit; Wang, Ting; Kelly, Christopher V.; Lencer, Wayne I. (2021). "Cholera Toxin como una sonda para la biología de Membrane". Toxinas. 13 (8): 543. doi:10.3390/toxinas13080543. PMC 8402489. PMID 34437414.
Enlaces externos
- De, Sambhu Nath. Enterotoxicidad del filtro de cultivo libre de bacterias de Vibrio cholerae. Naturaleza. 30 de mayo de 1959. 183:1533-4.
- McDowall, Jennifer (Sep 2005). "Cholera toxin". Proteína del Mes (POTM). Protein Data Bank in Europe (PDBe). Archivado desde el original el 27 de abril de 2019.
- Goodsell, David (Sep 2005). "Cholera Toxin". RCSB Proteína Data Bank. Molécula del Mes (MOTM). Protein Data Bank (PDB). doi:10.2210/rcsb_pdb/mom_2005_9. Archivado desde el original el 25 de octubre de 2011.
- Cholera+Toxin en la Biblioteca Nacional de Medicina de EE.UU.
- Reseña de toda la información estructural disponible en el PDB para UniProt: P01555 (Cholera enterotoxin subunit A) en el PDBe-KB.
- Reseña de toda la información estructural disponible en el PDB para UniProt: P01556 (Cholera enterotoxin subunit B) en el PDBe-KB.