Toxicidad por oxígeno
La toxicidad del oxígeno es una afección resultante de los efectos nocivos de respirar oxígeno molecular (O
2) a presiones parciales aumentadas. Los casos graves pueden provocar daño celular y muerte, y los efectos se observan con mayor frecuencia en el sistema nervioso central, los pulmones y los ojos. Históricamente, la condición del sistema nervioso central se llamó efecto Paul Bert, y la condición pulmonar, efecto Lorrain Smith, en honor a los investigadores que fueron pioneros en los descubrimientos y descripciones a finales del siglo XIX. siglo. La toxicidad del oxígeno es una preocupación para los buceadores submarinos, aquellos que reciben altas concentraciones de oxígeno suplementario y aquellos que se someten a oxigenoterapia hiperbárica.
El resultado de respirar presiones parciales aumentadas de oxígeno es la hiperoxia, un exceso de oxígeno en los tejidos del cuerpo. El cuerpo se ve afectado de diferentes maneras según el tipo de exposición. La toxicidad del sistema nervioso central es causada por una exposición breve a altas presiones parciales de oxígeno superiores a la presión atmosférica. La toxicidad pulmonar y ocular resulta de una exposición más prolongada a niveles elevados de oxígeno a presión normal. Los síntomas pueden incluir desorientación, problemas respiratorios y cambios en la visión como miopía. La exposición prolongada a presiones parciales de oxígeno por encima de lo normal, o exposiciones más cortas a presiones parciales muy altas, pueden causar daño oxidativo a las membranas celulares, colapso de los alvéolos de los pulmones, desprendimiento de retina y convulsiones. La toxicidad del oxígeno se controla reduciendo la exposición a niveles elevados de oxígeno. Los estudios demuestran que, a largo plazo, es posible una recuperación sólida de la mayoría de los tipos de toxicidad por oxígeno.
Existen protocolos para evitar los efectos de la hiperoxia en campos donde se respira oxígeno a presiones parciales más altas de lo normal, incluido el buceo submarino utilizando gases respirables comprimidos, la medicina hiperbárica, la atención neonatal y los vuelos espaciales tripulados. Estos protocolos han dado como resultado una rareza cada vez mayor de las convulsiones debidas a la toxicidad del oxígeno, y el daño pulmonar y ocular se limita en gran medida a los problemas del manejo de los bebés prematuros.
En los últimos años, el oxígeno está disponible para uso recreativo en bares de oxígeno. La Administración de Alimentos y Medicamentos de EE. UU. ha advertido a quienes padecen afecciones como enfermedades cardíacas o pulmonares que no utilicen barras de oxígeno. Los buceadores utilizan gases respirables que contienen hasta un 100% de oxígeno y deben tener una formación específica en el uso de dichos gases.
Clasificación

Los efectos de la toxicidad del oxígeno se pueden clasificar según los órganos afectados, produciéndose tres formas principales:
- Sistema nervioso central, caracterizado por convulsiones seguidas por la inconsciencia, que ocurre bajo condiciones hiperbáricas;
- Pulmonar (pulmonares), caracterizado por dificultad para respirar y dolor dentro del tórax, que ocurre al respirar mayores presiones de oxígeno durante períodos prolongados;
- Ocular (condiciones retinopáticas), caracterizada por alteraciones a los ojos, que ocurren al respirar mayores presiones de oxígeno durante períodos prolongados.
La toxicidad del oxígeno en el sistema nervioso central puede causar convulsiones, breves períodos de rigidez seguidos de convulsiones e inconsciencia, y es motivo de preocupación para los buceadores que se encuentran con presiones superiores a la atmosférica. La toxicidad pulmonar por oxígeno provoca daño a los pulmones, provocando dolor y dificultad para respirar. El daño oxidativo al ojo puede provocar miopía o desprendimiento parcial de la retina. Es más probable que se produzcan daños pulmonares y oculares cuando se administra oxígeno suplementario como parte de un tratamiento, especialmente a los recién nacidos, pero también son una preocupación durante la terapia con oxígeno hiperbárico.
El daño oxidativo puede ocurrir en cualquier célula del cuerpo, pero los efectos en los tres órganos más susceptibles serán la principal preocupación. También puede estar implicado en daños a los glóbulos rojos (hemólisis), al hígado, al corazón, a las glándulas endocrinas (glándulas suprarrenales, gónadas y tiroides) o a los riñones, y al daño celular general.
En circunstancias inusuales, se pueden observar efectos en otros tejidos: se sospecha que durante los vuelos espaciales, las altas concentraciones de oxígeno pueden contribuir al daño óseo. La hiperoxia también puede causar indirectamente narcosis por dióxido de carbono en pacientes con enfermedades pulmonares como la enfermedad pulmonar obstructiva crónica o con depresión respiratoria central. La hiperventilación del aire atmosférico a presiones atmosféricas no causa toxicidad por oxígeno, porque el aire al nivel del mar tiene una presión parcial de oxígeno de 0,21 bar (21 kPa), mientras que la toxicidad no ocurre por debajo de 0,3 bar (30 kPa).
Signos y síntomas
| Exposición (mins.) | Número de temas | Síntomas |
|---|---|---|
| 96 | 1 | Boquilla prolongada; vómitos espasmódicos severos |
| 60 a 69 | 3 | Severidad de labio; euforia; náusea y vértigo; rama del brazo |
| 50-55 | 4 | Severidad de labios; deslumbramiento; ruborización de labios; dormido; deslumbrado |
| 31 a 35 | 4 | Nausea, vértigo, lip-twitching; convulsion |
| 21 a 30 | 6 | Convulso; somnolencia; estrechamiento de labios severos; aura epigástrica; brazo de twitch L; amnesia |
| 16 a 20 | 8 | Convulso; vértigo y agitación de labios severos; aura epigástrica; respiración espasmódica; |
| 11 a 15 | 4 | Predominio inspirador; lip-twitching y sincope; náuseas y confusión |
| 6 a 10 | 6 | Dazed and lip-twitching; paraesthesiae; vertigo; "espasmo diafragmático"; náuseas severas |
Sistema nervioso central
La toxicidad por oxígeno en el sistema nervioso central se manifiesta como síntomas como cambios visuales (especialmente visión de túnel), zumbidos en los oídos (tinnitus), náuseas, espasmos (especialmente en la cara), cambios de comportamiento (irritabilidad, ansiedad, confusión) y mareo. A esto puede seguirle una convulsión tónico-clónica que consta de dos fases: se produce una contracción muscular intensa durante varios segundos (fase tónica); seguidos de espasmos rápidos de relajación y contracción muscular alternas que producen sacudidas convulsivas (fase clónica). La convulsión termina con un período de inconsciencia (el estado postictal). El inicio de la convulsión depende de la presión parcial de oxígeno en el gas respirable y de la duración de la exposición. Sin embargo, el tiempo de exposición antes de su aparición es impredecible, ya que las pruebas han demostrado una amplia variación, tanto entre individuos como en el mismo individuo de un día a otro. Además, muchos factores externos, como la inmersión bajo el agua, la exposición al frío y el ejercicio, disminuirán el tiempo hasta la aparición de los síntomas del sistema nervioso central. La disminución de la tolerancia está estrechamente relacionada con la retención de dióxido de carbono. Otros factores, como la oscuridad y la cafeína, aumentan la tolerancia en animales de prueba, pero estos efectos no se han demostrado en humanos.
Pulmones
La exposición a presiones de oxígeno superiores a 0,5 bar, como durante el buceo, la respiración previa de oxígeno antes del vuelo o la terapia hiperbática, se asocia con la aparición de síntomas de toxicidad pulmonar. Los síntomas de toxicidad pulmonar son el resultado de una inflamación que comienza en las vías respiratorias que conducen a los pulmones y luego se propaga a los pulmones (árbol traqueobronquial). Los síntomas aparecen en la región superior del tórax (regiones subesternal y carinal). Esto comienza como un leve cosquilleo al inhalar y progresa a tos frecuente. Si continúa respirando presiones parciales aumentadas de oxígeno, los sujetos experimentan un leve ardor al inhalar junto con tos incontrolable y dificultad para respirar ocasional (disnea). Los hallazgos físicos relacionados con la toxicidad pulmonar incluyen sonidos burbujeantes que se escuchan a través de un estetoscopio (estertores burbujeantes), fiebre y aumento del flujo sanguíneo al revestimiento de la nariz (hiperemia de la mucosa nasal). Inicialmente, hay una fase exudativa que resulta en enfermedad pulmonar. edema. En el examen histológico se puede observar un aumento en el ancho del espacio intersticial. Las radiografías de los pulmones muestran pocos cambios a corto plazo, pero la exposición prolongada conduce a un aumento de la sombra difusa en ambos pulmones. Las mediciones de la función pulmonar se reducen, como lo indica una reducción en la cantidad de aire que los pulmones pueden retener (capacidad vital) y cambios en la función espiratoria y la elasticidad pulmonar. La capacidad de difusión pulmonar disminuye, lo que eventualmente conduce a hipoxemia. Las pruebas en animales han indicado una variación en la tolerancia similar a la encontrada en la toxicidad del sistema nervioso central, así como variaciones significativas entre especies. Cuando la exposición al oxígeno por encima de 0,5 bar (50 kPa) es intermitente, permite que los pulmones se recuperen y retrasa la aparición de la toxicidad. Una progresión similar es común a todas las especies de mamíferos. Si no se ha producido la muerte por hipoxemia después de la exposición durante varios días se produce una fase proliferativa, desarrollándose un engrosamiento crónico de la membrana alveolar y una disminución de la capacidad de difusión pulmonar. Estos cambios son en su mayoría reversibles al regresar a la normoxia, pero se desconoce el tiempo necesario para una recuperación completa.
Ojos
En los bebés prematuros, los signos de daño ocular (retinopatía del prematuro o ROP) se observan mediante un oftalmoscopio como una demarcación entre las regiones vascularizadas y no vascularizadas de la retina del bebé. El grado de esta demarcación se utiliza para designar cuatro etapas: (I) la demarcación es una línea; (II) la demarcación se convierte en una cresta; (III) se produce el crecimiento de nuevos vasos sanguíneos alrededor de la cresta; (IV) la retina comienza a desprenderse de la pared interna del ojo (coroides).
Causas
La toxicidad por oxígeno es causada por hiperoxia, exposición al oxígeno a presiones parciales mayores que aquellas a las que el cuerpo está normalmente expuesto. Esto ocurre en tres entornos principales: buceo submarino, oxigenoterapia hiperbárica y suministro de oxígeno suplementario, en cuidados intensivos y para el tratamiento a largo plazo de trastornos crónicos, y en particular de bebés prematuros. En cada caso, los factores de riesgo son marcadamente diferentes.
Bajo presiones ambientales normales o reducidas, los efectos de la hiperoxia se limitan inicialmente a los pulmones, que están directamente expuestos, pero después de una exposición prolongada o a presiones hiperbáricas, otros órganos pueden estar en riesgo. A presiones parciales normales de oxígeno inhalado, la mayor parte del oxígeno transportado en la sangre es transportado por la hemoglobina, pero la cantidad de oxígeno disuelto aumentará a presiones parciales de oxígeno arterial superiores a 100 milímetros de mercurio (0,13 bar), cuando la saturación de oxihemoglobina está casi completo. En concentraciones más altas, los efectos de la hiperoxia están más extendidos en los tejidos del cuerpo más allá de los pulmones.
Toxicidad del sistema nervioso central
Las exposiciones, de minutos a unas pocas horas, a presiones parciales de oxígeno superiores a aproximadamente 1,6 bares (160 kPa), aproximadamente ocho veces la presión parcial atmosférica normal, generalmente se asocian con toxicidad por oxígeno en el sistema nervioso central y es más probable que ocurran entre pacientes sometidos a oxigenoterapia hiperbárica y buzos. Dado que la presión atmosférica al nivel del mar es de aproximadamente 1 bar (100 kPa), la toxicidad del sistema nervioso central sólo puede ocurrir en condiciones hiperbáricas, donde la presión ambiental está por encima de lo normal. Los buzos que respiran aire a profundidades superiores a los 60 m (200 pies) se enfrentan a un riesgo cada vez mayor de sufrir un "golpe" de toxicidad por oxígeno. (convulsión). Los buzos que respiran una mezcla de gases enriquecidos con oxígeno, como el nitrox, aumentan de manera similar el riesgo de sufrir una convulsión a profundidades menores, si descienden por debajo de la profundidad operativa máxima aceptada para la mezcla. La toxicidad del SNC se ve agravada por una alta presión parcial de dióxido de carbono, estrés, fatiga y frío, todo lo cual es mucho más probable en el buceo que en la terapia hiperbárica.
Toxicidad pulmonar
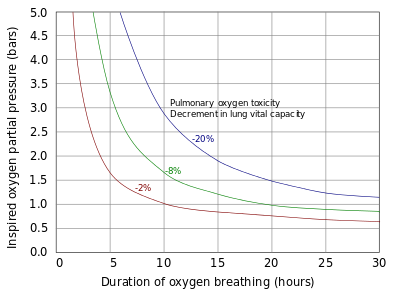
Los pulmones y el resto del tracto respiratorio están expuestos a la mayor concentración de oxígeno en el cuerpo humano y, por lo tanto, son los primeros órganos en mostrar toxicidad. La toxicidad pulmonar se produce sólo con la exposición a presiones parciales de oxígeno superiores a 0,5 bar (50 kPa), lo que corresponde a una fracción de oxígeno del 50 % a presión atmosférica normal. Los primeros signos de toxicidad pulmonar comienzan con evidencia de traqueobronquitis o inflamación de las vías respiratorias superiores, después de un período asintomático de entre 4 y 22 horas con más del 95% de oxígeno, y algunos estudios sugieren que los síntomas generalmente comienzan después de aproximadamente 14 horas a este nivel de oxígeno. oxígeno.
A presiones parciales de oxígeno de 2 a 3 bar (200 a 300 kPa) (100 % oxígeno a 2 a 3 veces la presión atmosférica), estos síntomas pueden comenzar tan pronto como 3 horas después de la exposición al oxígeno. Los experimentos con ratas que respiran oxígeno a presiones entre 1 y 3 bares (100 y 300 kPa) sugieren que las manifestaciones pulmonares de toxicidad por oxígeno pueden no ser las mismas en condiciones normobáricas que en condiciones hiperbáricas. La evidencia de disminución de la función pulmonar medida mediante pruebas de función pulmonar puede ocurrir tan pronto como 24 horas de exposición continua a oxígeno al 100%, con evidencia de daño alveolar difuso y la aparición del síndrome de dificultad respiratoria aguda que generalmente ocurre después de 48 horas con oxígeno al 100%.. Respirar oxígeno al 100% también conduce eventualmente al colapso de los alvéolos (atelectasia), mientras que, a la misma presión parcial de oxígeno, la presencia de presiones parciales significativas de gases inertes, típicamente nitrógeno, evitará este efecto.
Se sabe que los recién nacidos prematuros tienen un mayor riesgo de sufrir displasia broncopulmonar con una exposición prolongada a altas concentraciones de oxígeno. Otros grupos con mayor riesgo de toxicidad por oxígeno son los pacientes con ventilación mecánica con exposición a niveles de oxígeno superiores al 50% y los pacientes expuestos a sustancias químicas que aumentan el riesgo de toxicidad por oxígeno, como el agente quimioterapéutico bleomicina. Por lo tanto, las pautas actuales para pacientes con ventilación mecánica en cuidados intensivos recomiendan mantener la concentración de oxígeno por debajo del 60%. Asimismo, los buceadores que se someten a tratamiento por enfermedad de descompresión tienen un mayor riesgo de toxicidad por oxígeno, ya que el tratamiento implica la exposición a largos períodos de respiración de oxígeno en condiciones hiperbáricas, además de cualquier exposición al oxígeno durante la inmersión.
Toxicidad ocular
La exposición prolongada a altas fracciones inspiradas de oxígeno causa daño a la retina. El daño al ojo en desarrollo de los bebés expuestos a una alta fracción de oxígeno a presión normal tiene un mecanismo y efecto diferentes del daño ocular experimentado por los buceadores adultos en condiciones hiperbáricas. La hiperoxia puede ser un factor que contribuya al trastorno llamado fibroplasia retrolental o retinopatía del prematuro (ROP) en los bebés. En los bebés prematuros, la retina a menudo no está completamente vascularizada. La retinopatía del prematuro ocurre cuando se detiene el desarrollo de la vasculatura retiniana y luego se desarrolla de manera anormal. Asociado con el crecimiento de estos nuevos vasos hay tejido fibroso (tejido cicatricial) que puede contraerse y causar desprendimiento de retina. La exposición al oxígeno suplementario, si bien es un factor de riesgo, no es el principal factor de riesgo para el desarrollo de esta enfermedad. Restringir el uso de oxígeno suplementario no necesariamente reduce la tasa de retinopatía del prematuro y puede aumentar el riesgo de complicaciones sistémicas relacionadas con la hipoxia.
Se ha producido miopía hiperóxica en buceadores con rebreather de oxígeno de circuito cerrado con exposiciones prolongadas. También ocurre con frecuencia en quienes se someten a oxigenoterapia hiperbárica repetida. Esto se debe a un aumento en el poder refractivo del cristalino, ya que las lecturas de longitud axial y queratometría no revelan una base corneal o de longitud para un cambio miope. Suele ser reversible con el tiempo.
Un posible efecto secundario de la terapia con oxígeno hiperbárico es el desarrollo inicial o posterior de cataratas, que son un aumento de la opacidad del cristalino del ojo que reduce la agudeza visual y, eventualmente, puede provocar ceguera. Este es un evento poco común, asociado con la exposición de por vida a concentraciones elevadas de oxígeno, y es posible que no se informe lo suficiente ya que se desarrolla muy lentamente. La causa no se comprende completamente, pero la evidencia sugiere que los niveles elevados de oxígeno pueden causar un deterioro acelerado del humor vítreo debido a la degradación de las cristalinas del cristalino mediante reticulación, formando agregados capaces de dispersar la luz. Esto puede ser un desarrollo final del cambio miope observado más comúnmente asociado con el tratamiento hiperbárico.
Mecanismo

La base bioquímica de la toxicidad del oxígeno es la reducción parcial del oxígeno por uno o dos electrones para formar especies reactivas de oxígeno, que son subproductos naturales del metabolismo normal del oxígeno y tienen funciones importantes en la señalización celular. Una especie producida por el cuerpo, el anión superóxido (O−
2), posiblemente esté involucrado en la adquisición de hierro. Concentraciones de oxígeno más altas de lo normal conducen a mayores niveles de especies reactivas de oxígeno. El oxígeno es necesario para el metabolismo celular y la sangre lo suministra a todas las partes del cuerpo. Cuando se respira oxígeno a presiones parciales elevadas, se propaga rápidamente un estado hiperóxico, siendo los tejidos más vascularizados los más vulnerables. En momentos de estrés ambiental, los niveles de especies reactivas de oxígeno pueden aumentar dramáticamente, lo que puede dañar las estructuras celulares y producir estrés oxidativo.
Si bien aún no se comprenden completamente todos los mecanismos de reacción de estas especies dentro del cuerpo, uno de los productos más reactivos del estrés oxidativo es el radical hidroxilo (·OH), que puede iniciar una reacción en cadena dañina de peroxidación lipídica en los lípidos insaturados dentro de las membranas celulares. Las altas concentraciones de oxígeno también aumentan la formación de otros radicales libres, como el óxido nítrico, el peroxinitrito y el trioxidano, que dañan el ADN y otras biomoléculas. Aunque el cuerpo tiene muchos sistemas antioxidantes, como el glutatión, que protegen contra el estrés oxidativo, estos sistemas eventualmente se ven abrumados por concentraciones muy altas de oxígeno libre, y la tasa de daño celular excede la capacidad de los sistemas que lo previenen o reparan. Entonces se produce daño celular y muerte celular.
Diagnóstico
El diagnóstico de la toxicidad del oxígeno en el sistema nervioso central en buceadores antes de la convulsión es difícil ya que los síntomas de alteraciones visuales, problemas de oído, mareos, confusión y náuseas pueden deberse a muchos factores comunes al entorno submarino, como narcosis, congestión y frío.. Sin embargo, estos síntomas pueden ser útiles para diagnosticar las primeras etapas de la toxicidad del oxígeno en pacientes sometidos a oxigenoterapia hiperbárica. En cualquier caso, a menos que haya antecedentes de epilepsia o las pruebas indiquen hipoglucemia, una convulsión que se produce al respirar oxígeno a presiones parciales superiores a 1,4 bar (140 kPa) sugiere un diagnóstico de toxicidad por oxígeno.
El diagnóstico de displasia broncopulmonar en recién nacidos con dificultades respiratorias es difícil en las primeras semanas. Sin embargo, si la respiración del bebé no mejora durante este tiempo, se pueden utilizar análisis de sangre y radiografías para confirmar la displasia broncopulmonar. Además, un ecocardiograma puede ayudar a eliminar otras posibles causas como defectos cardíacos congénitos o hipertensión arterial pulmonar.
El diagnóstico de retinopatía del prematuro en bebés suele ser sugerido por el entorno clínico. La prematuridad, el bajo peso al nacer y los antecedentes de exposición al oxígeno son los principales indicadores, aunque no se ha demostrado que ningún factor hereditario produzca un patrón.
Diagnóstico diferencial
El diagnóstico clínico se puede confirmar con los niveles de oxígeno arterial. Varias otras afecciones pueden confundirse con la toxicidad del oxígeno, entre las que se incluyen:
- Intoxicación por monóxido de carbono
- Cerebrovascular event (stroke)
- Envenomación o ingestión toxínica
- Hypercapnia (Carbon dioxide narcosis)
- Hiperventilación
- Hipoglucemia
- Infección
- Migraine
- Esclerosis múltiple
- Trastorno de incautación (epilepsia)
Prevención

La prevención de la toxicidad del oxígeno depende completamente del entorno. Tanto bajo el agua como en el espacio, las precauciones adecuadas pueden eliminar los efectos más perniciosos. Los bebés prematuros suelen necesitar oxígeno suplementario para tratar las complicaciones del parto prematuro. En este caso, la prevención de la displasia broncopulmonar y la retinopatía del prematuro debe realizarse sin comprometer el suministro de oxígeno adecuado para preservar la vida del bebé.
Bajo el agua
La toxicidad del oxígeno es un peligro catastrófico en el buceo, porque una convulsión produce un alto riesgo de muerte por ahogamiento. La convulsión puede ocurrir repentinamente y sin síntomas de advertencia. Los efectos son convulsiones repentinas y pérdida del conocimiento, durante las cuales las víctimas pueden perder el control y ahogarse. Una de las ventajas de una máscara de buceo que cubre todo el rostro es la prevención de la pérdida del regulador en caso de convulsión. Las correas de sujeción de la boquilla son una alternativa relativamente económica con una función similar pero menos efectiva. Como existe un mayor riesgo de toxicidad por oxígeno en el sistema nervioso central en inmersiones profundas, inmersiones largas y inmersiones en las que se utilizan gases respirables ricos en oxígeno, se enseña a los buceadores a calcular una profundidad operativa máxima para gases respirables ricos en oxígeno y cilindros que contienen dichas mezclas. debe estar claramente marcado con esa profundidad.
El riesgo de convulsiones parece ser una función de la dosis: una combinación acumulativa de presión parcial y duración. El umbral de presión parcial de oxígeno por debajo del cual nunca se producen convulsiones no se ha establecido y puede depender de muchas variables, algunas de ellas personales. El riesgo para una persona específica puede variar considerablemente dependiendo de la sensibilidad individual, el nivel de ejercicio y la retención de dióxido de carbono, que está influenciada por el trabajo respiratorio.
En algunos cursos de formación de buceadores para modos de buceo en los que la exposición puede alcanzar niveles de riesgo significativo, se enseña a los buceadores a planificar y controlar lo que se llama el 'reloj de oxígeno' de sus inmersiones. Se trata de un despertador ficticio, que suena más rápidamente cuando aumenta la presión de oxígeno y está configurado para activarse en el límite máximo de exposición única recomendado en el Manual de Buceo de la Administración Nacional Oceánica y Atmosférica. Para las siguientes presiones parciales de oxígeno, los límites son: 45 minutos a 1,6 bar (160 kPa), 120 minutos a 1,5 bar (150 kPa), 150 minutos a 1,4 bar (140 kPa), 180 minutos a 1,3 bar (130 kPa) y 210 minutos a 1,2 bar (120 kPa), pero es imposible predecir con fiabilidad si se producirán síntomas de toxicidad y cuándo. Muchas computadoras de buceo con capacidad de nitrox calculan la carga de oxígeno y pueden rastrearla en múltiples inmersiones. El objetivo es evitar que se active la alarma reduciendo la presión parcial de oxígeno en el gas respirable o reduciendo el tiempo empleado en respirar gas de mayor presión parcial de oxígeno. A medida que la presión parcial de oxígeno aumenta con la fracción de oxígeno en el gas respirable y la profundidad de la inmersión, el buceador obtiene más tiempo en el reloj de oxígeno buceando a menor profundidad, respirando un gas menos rico en oxígeno o respirando un gas menos rico en oxígeno. acortando la duración de la exposición a gases ricos en oxígeno. Esta función la proporcionan algunas computadoras técnicas de descompresión de buceo y hardware de control y monitoreo de rebreather.
Bucear por debajo de 56 m (184 pies) en el aire expondría al buceador a un peligro cada vez mayor de toxicidad por oxígeno, ya que la presión parcial de oxígeno supera los 1,4 bar (140 kPa), por lo que se debe utilizar una mezcla de gases que contenga menos del 21 %. oxígeno (lo que se denomina mezcla hipóxica). Aumentar la proporción de nitrógeno no es viable, ya que se produciría una mezcla fuertemente narcótica. Sin embargo, el helio no es narcótico y se puede mezclar una mezcla utilizable reemplazando completamente el nitrógeno con helio (la mezcla resultante se llama heliox) o reemplazando parte del nitrógeno con helio, produciendo una trimix.
La toxicidad pulmonar por oxígeno es un evento totalmente evitable durante el buceo. La duración limitada y la naturaleza naturalmente intermitente de la mayoría de los buceos hacen que esta sea una complicación relativamente rara (e incluso reversible) para los buceadores. Las directrices establecidas permiten a los buceadores calcular cuándo corren riesgo de sufrir toxicidad pulmonar. En el buceo de saturación se puede evitar limitando el contenido de oxígeno del gas en las zonas habitadas a menos de 0,4 bar.
Proyección
La intención del examen mediante una prueba de tolerancia al oxígeno es identificar a los buceadores con baja tolerancia a altas presiones parciales de oxígeno hiperbárico que pueden ser más propensos a sufrir convulsiones de oxígeno durante las operaciones de buceo o durante el tratamiento hiperbárico para la enfermedad de descompresión. Se ha cuestionado el valor de esta prueba y los estudios estadísticos han demostrado una baja incidencia de convulsiones durante los programas de tratamiento hiperbárico estándar, por lo que algunas armadas han descontinuado su uso, aunque otras continúan exigiendo la prueba a todos los candidatos a buceadores.
La variabilidad en la tolerancia y otros factores variables, como la carga de trabajo, han provocado que la Marina de los EE. UU. abandone las pruebas de tolerancia al oxígeno. De las 6.250 pruebas de tolerancia al oxígeno realizadas entre 1976 y 1997, sólo se observaron 6 episodios de toxicidad por oxígeno (0,1%).
La prueba de tolerancia al oxígeno utilizada por la Armada de la India, que sigue las recomendaciones de la Armada de los EE. UU. y la Administración Nacional Oceánica y Atmosférica de los EE. UU., consiste en respirar oxígeno al 100% suministrado por una máscara BIBS a una presión ambiental de 2,8 bar absolutos (18 msw). durante 30 minutos, en reposo en cámara hiperbárica seca. El asistente no podrá observar síntomas de toxicidad por oxígeno en el SNC.
Configuración hiperbárica
La presencia de fiebre o antecedentes de convulsiones es una contraindicación relativa para el tratamiento con oxígeno hiperbárico. Los programas utilizados para el tratamiento de la enfermedad por descompresión permiten períodos de respiración de aire en lugar de oxígeno al 100% (pausas de aire) para reducir la posibilidad de convulsiones o daño pulmonar. La Marina de los EE. UU. utiliza tablas de tratamiento basadas en períodos que alternan entre 100% oxígeno y aire. Por ejemplo, la tabla 6 de la USN requiere 75 minutos (tres períodos de 20 minutos de oxígeno/5 minutos de aire) a una presión ambiental de 2,8 atmósferas estándar (280 kPa), equivalente a una profundidad de 18 metros (60 pies). A esto le sigue una lenta reducción de la presión a 1,9 atm (190 kPa) durante 30 minutos con oxígeno. Luego, el paciente permanece a esa presión durante 150 minutos más, que consisten en dos períodos de 15 minutos de aire/60 minutos de oxígeno, antes de que la presión se reduzca a la atmosférica durante 30 minutos con oxígeno.
La vitamina E y el selenio fueron propuestos y luego rechazados como un método potencial de protección contra la toxicidad pulmonar por oxígeno. Sin embargo, existe cierta evidencia experimental en ratas de que la vitamina E y el selenio ayudan a prevenir la peroxidación lipídica in vivo y el daño de los radicales libres y, por lo tanto, previenen los cambios en la retina después de exposiciones repetitivas al oxígeno hiperbárico.
Configuración normobárica
La displasia broncopulmonar es reversible en las primeras etapas mediante el uso de períodos de descanso con presiones más bajas de oxígeno, pero eventualmente puede resultar en una lesión pulmonar irreversible si se le permite progresar a un daño severo. Se necesitan uno o dos días de exposición sin interrupciones de oxígeno para causar tal daño.
La retinopatía del prematuro se puede prevenir en gran medida mediante pruebas de detección. Las pautas actuales exigen que todos los bebés con menos de 32 semanas de edad gestacional o que pesen menos de 1,5 kg (3,3 lb) al nacer sean examinados para detectar retinopatía del prematuro al menos cada dos semanas. El Estudio Cooperativo Nacional de 1954 mostró un vínculo causal entre el oxígeno suplementario y la retinopatía del prematuro, pero la posterior reducción del oxígeno suplementario provocó un aumento de la mortalidad infantil. Para equilibrar los riesgos de hipoxia y retinopatía del prematuro, los protocolos modernos ahora requieren la monitorización de los niveles de oxígeno en sangre en los bebés prematuros que reciben oxígeno.
La titulación cuidadosa de la dosis para minimizar la concentración administrada mientras se logra el nivel deseado de oxigenación minimizará el riesgo de daño por toxicidad del oxígeno y la cantidad de oxígeno utilizada para la terapia a largo plazo.
Configuración hipobárica
En entornos de baja presión, se puede evitar la toxicidad del oxígeno, ya que la toxicidad es causada por una alta presión parcial de oxígeno, no por una alta fracción de oxígeno. Esto queda ilustrado por el uso de oxígeno puro en los trajes espaciales, que deben funcionar a baja presión y a alta fracción de oxígeno y presión de cabina inferiores a la presión atmosférica normal en las primeras naves espaciales, por ejemplo, las naves espaciales Gemini y Apollo. En aplicaciones como la actividad extravehicular, el oxígeno en fracciones altas no es tóxico, incluso en fracciones de mezcla respirables cercanas al 100%, porque no se permite que la presión parcial de oxígeno supere crónicamente los 0,3 bar (4,4 psi).
Gestión


Durante la terapia con oxígeno hiperbárico, el paciente normalmente respirará oxígeno al 100% a través de una máscara mientras está dentro de una cámara hiperbárica presurizada con aire a aproximadamente 2,8 bar (280 kPa). Las convulsiones durante la terapia se controlan quitándole la mascarilla al paciente, reduciendo así la presión parcial de oxígeno inspirado por debajo de 0,6 bar (60 kPa).
Una convulsión bajo el agua requiere que el buzo sea llevado a la superficie lo antes posible. Aunque durante muchos años la recomendación ha sido no elevar al buzo durante la convulsión, debido al peligro de embolia gaseosa arterial (AGE), existe cierta evidencia de que la glotis no obstruye completamente las vías respiratorias. Esto ha llevado a la recomendación actual del Comité de Buceo de la Sociedad Médica Hiperbárica y Submarina de que se debe levantar al buzo durante la fase clónica (convulsiva) de la convulsión si el regulador no está en la boca del buceador. ya que el peligro de ahogamiento es entonces mayor que el de AGE, pero de lo contrario el ascenso debería retrasarse hasta el final de la fase clónica. Los rescatistas se aseguran de que su propia seguridad no se vea comprometida durante la fase convulsiva. Luego se aseguran de que se mantenga el suministro de aire de la víctima y llevan a cabo un levantamiento de flotación controlado. La mayoría de las agencias de formación de buceadores recreativos enseñan a levantar un cuerpo inconsciente como una habilidad avanzada, y para los buceadores profesionales es una habilidad básica, ya que es una de las funciones principales del buceador de reserva. Al llegar a la superficie, siempre se contacta a los servicios de emergencia, ya que existe la posibilidad de que surjan más complicaciones que requieran atención médica. Si se desarrollan síntomas distintos a una convulsión bajo el agua, el buzo debe cambiar inmediatamente a un gas con una fracción de oxígeno más baja o ascender a una profundidad menor si las obligaciones de descompresión lo permiten. Si hay una cámara disponible en la superficie, la descompresión de la superficie es una opción recomendada. La Marina de los EE. UU. ha publicado procedimientos para completar las paradas de descompresión cuando no hay una cámara de recompresión disponible de inmediato.
La aparición de síntomas de displasia broncopulmonar o síndrome de dificultad respiratoria aguda se trata disminuyendo la fracción de oxígeno administrada, junto con una reducción de los períodos de exposición y un aumento de los períodos de descanso donde se suministra aire normal. Cuando se requiere oxígeno suplementario para el tratamiento de otra enfermedad (particularmente en bebés), es posible que se necesite un ventilador para garantizar que el tejido pulmonar permanezca inflado. Las reducciones de presión y exposición se harán de forma progresiva y se podrán utilizar medicamentos como broncodilatadores y surfactantes pulmonares.
Los buceadores gestionan el riesgo de daño pulmonar limitando la exposición a niveles que la evidencia experimental ha demostrado que son generalmente aceptables, utilizando un sistema de unidades de toxicidad del oxígeno que se basan en el tiempo de exposición a presiones parciales específicas. En caso de tratamiento de emergencia para la enfermedad por descompresión, puede ser necesario exceder los límites de exposición normales para controlar los síntomas más críticos.
La retinopatía del prematuro puede retroceder espontáneamente, pero si la enfermedad progresa más allá de un umbral (definido como cinco horas contiguas u ocho horas acumuladas de retinopatía del prematuro en etapa 3), se ha demostrado que tanto la criocirugía como la cirugía con láser reducen el riesgo de ceguera. un resultado. Cuando la enfermedad ha progresado más, técnicas como el cerclaje escleral y la cirugía de vitrectomía pueden ayudar a volver a unir la retina.
Exposición repetida
La exposición repetida a concentraciones de oxígeno potencialmente tóxicas en el gas respirable es bastante común en la actividad hiperbárica, particularmente en la medicina hiperbárica, el buceo de saturación, los hábitats submarinos y el buceo con descompresión repetitiva. La investigación realizada por R.W. Hamilton y otros en la Administración Nacional Oceánica y Atmosférica (NOAA) determinó niveles aceptables de exposición para exposiciones únicas y repetidas. Se hace una distinción entre exposición aceptable para toxicidad aguda y crónica, pero estos son en realidad los extremos de una posible gama continua de exposiciones. Se puede hacer una distinción adicional entre la exposición rutinaria y la exposición requerida para el tratamiento de emergencia, donde un mayor riesgo de toxicidad por oxígeno puede estar justificado para lograr una reducción de una lesión más crítica, particularmente cuando se encuentra en un ambiente controlado y monitoreado relativamente seguro.
El método Repex (exposición repetida), desarrollado en 1988, permite calcular la dosis de toxicidad del oxígeno utilizando un valor de dosis única equivalente a 1 minuto de oxígeno al 100% a presión atmosférica llamado Unidad de Tolerancia al Oxígeno (OTU), y se utiliza para evitar efectos tóxicos durante varios días de exposición operativa. Algunas computadoras de buceo rastrearán automáticamente la dosis según la profundidad medida y la mezcla de gases seleccionada. Los límites permiten una mayor exposición cuando la persona no ha estado expuesta recientemente, y la dosis diaria permitida disminuye con el aumento de los días consecutivos de exposición. Es posible que estos valores no estén totalmente respaldados por los datos actuales.
| Días de exposición | dosis media diaria (OTU) | dosis total (OTU) |
|---|---|---|
| 1 | 850 | 850 |
| 2 | 700 | 1400 |
| 3 | 620 | 1860 |
| 4 | 525 | 2100 |
| 5 | 460 | 2300 |
| 6 | 420 | 2520 |
| 7 | 380 | 2660 |
| 8 | 350 | 2800 |
| 9 | 330 | 2970 |
| 10 | 310 | 3100 |
| 11 a 30 | 300 | calculada |
| PO2 (atm) | OTU por minuto |
|---|---|
| 0,50 | 0.00 |
| 0,555 | 0.15 |
| 0.60 | 0,277 |
| 0.65 | 0.37 |
| 0 | 0.47 |
| 0,75 | 0,56 |
| 0.80 | 0.65 |
| 0.85 | 0,74 |
| 0.90 | 0.83 |
| 0.95 | 0.92 |
| 1.00 | 1.00 |
| 1.05 | 1.08 |
| 1.10 | 1.16 |
| 1.15 | 1.24 |
| 1.20 | 1.32 |
| 1.25 | 1.40 |
| 1.30 | 1.48 |
| 1.35 | 1.55 |
| 1.40 | 1.63 |
| 1.45 | 1.70 |
| 1.50 | 1.78 |
| 1.55 | 1.85 |
| 1.60 | 1.92 |
| 1.65 | 2.00 |
| 1.70 | 2.07 |
| 1.75 | 2.14 |
| 1.80 | 2.21 |
| 1.85 | 2.28 |
| 1.90 | 2.35 |
| 1.95 | 2.42 |
| 2.00 | 2.49 |
Una propuesta más reciente utiliza una ecuación de potencia simple, Índice de toxicidad (TI) = t2 × PO2c , donde t es el tiempo y c es el término de potencia. Esto se derivó de las reacciones químicas que producen especies reactivas de oxígeno o nitrógeno, y se ha demostrado que ofrece buenas predicciones para la toxicidad del SNC con c = 6,8 y para la toxicidad pulmonar con c = 4,57.
Did you mean:For pulmonary toxicity, time is in hours, and PO2 in atmospheres absolute, IT should be limited to 250.
Para la toxicidad del SNC, el tiempo está en minutos, PO2 en atmósferas absolutas y un TI de 26,108 indica un riesgo del 1 %.
Pronóstico
Aunque las convulsiones causadas por la toxicidad del oxígeno del sistema nervioso central pueden provocar lesiones incidentales a la víctima, durante muchos años no se sabía si se podía producir daño al sistema nervioso después de la convulsión y varios estudios buscaron evidencia de dicho daño. Una revisión de estos estudios realizada por Bitterman en 2004 concluyó que después de la eliminación del gas respirable que contiene altas fracciones de oxígeno, no queda ningún daño neurológico a largo plazo debido a la convulsión.
La mayoría de los bebés que han sobrevivido después de una incidencia de displasia broncopulmonar eventualmente recuperarán una función pulmonar casi normal, ya que los pulmones continúan creciendo durante los primeros 5 a 7 años y el daño causado por la displasia broncopulmonar es hasta cierto punto reversible (incluso en adultos). Sin embargo, es probable que sean más susceptibles a las infecciones respiratorias por el resto de sus vidas y la gravedad de las infecciones posteriores suele ser mayor que la de sus pares.
La retinopatía del prematuro (ROP) en bebés frecuentemente regresa sin intervención y la vista puede ser normal en años posteriores. Cuando la enfermedad ha progresado a etapas que requieren cirugía, los resultados generalmente son buenos para el tratamiento de la ROP en etapa 3, pero son mucho peores para las etapas posteriores. Aunque la cirugía suele tener éxito en la restauración de la anatomía del ojo, el daño al sistema nervioso debido a la progresión de la enfermedad conduce a resultados comparativamente peores en la restauración de la visión. La presencia de otras enfermedades complicadas también reduce la probabilidad de un resultado favorable.
El suministro de oxígeno suplementario sigue siendo importante para salvar vidas en cuidados intensivos y puede aumentar la supervivencia en algunas enfermedades crónicas, pero la hiperoxia y la formación de especies reactivas de oxígeno están implicadas en la patogénesis de varias enfermedades potencialmente mortales. Los efectos tóxicos de la hiperoxia son particularmente frecuentes en el compartimento pulmonar y las circulaciones cerebral y coronaria están en riesgo cuando ocurren cambios vasculares. La hiperoxia a largo plazo daña las respuestas inmunes y aumenta la susceptibilidad a complicaciones infecciosas y lesiones tisulares.
Epidemiología
La incidencia de toxicidad del sistema nervioso central entre los buceadores ha disminuido desde la Segunda Guerra Mundial, a medida que se han desarrollado protocolos para limitar la exposición y la presión parcial de oxígeno inspirado. En 1947, Donald recomendó limitar la profundidad permitida para respirar oxígeno puro a 7,6 m (25 pies), lo que equivale a una presión parcial de oxígeno de 1,8 bar (180 kPa). Con el tiempo, este límite se ha reducido, hasta hoy en día generalmente se recomienda un límite de 1,4 bar (140 kPa) durante una inmersión recreativa y 1,6 bar (160 kPa) durante paradas de descompresión poco profundas, aunque los buzos militares que utilizan respiradores de oxígeno pueden operar a mayores profundidades para períodos limitados, con mayor riesgo. La toxicidad del oxígeno ahora se ha convertido en un fenómeno poco común, excepto cuando es causado por un mal funcionamiento del equipo y un error humano. Históricamente, la Marina de los EE. UU. ha refinado sus tablas de aire y gases mezclados del Manual de Buceo de la Marina para reducir los incidentes de toxicidad del oxígeno. Entre 1995 y 1999, los informes mostraron 405 inmersiones en superficie utilizando las tablas de helio-oxígeno; de estos, se observaron síntomas de toxicidad por oxígeno en 6 inmersiones (1,5%). Como resultado, en 2000 la Marina de los EE. UU. modificó los cronogramas y realizó pruebas de campo en 150 inmersiones, ninguna de las cuales produjo síntomas de toxicidad por oxígeno. Las tablas revisadas se publicaron en 2001.
La variabilidad en la tolerancia y otros factores variables, como la carga de trabajo, han provocado que la Marina de los EE. UU. abandone las pruebas de tolerancia al oxígeno. De las 6.250 pruebas de tolerancia al oxígeno realizadas entre 1976 y 1997, sólo se observaron 6 episodios de toxicidad por oxígeno (0,1%).
La toxicidad del oxígeno en el sistema nervioso central entre pacientes sometidos a oxigenoterapia hiperbárica es poco común y está influenciada por varios factores: sensibilidad individual y protocolo de tratamiento; y probablemente la indicación del tratamiento y el equipo utilizado. Un estudio de Welslau en 1996 informó de 16 incidentes en una población de 107.264 pacientes (0,015%), mientras que Hampson y Atik en 2003 encontraron una tasa del 0,03%. Yildiz, Ay y Qyrdedi, en un resumen de 36.500 tratamientos de pacientes entre 1996 y 2003, informaron sólo 3 incidentes de toxicidad del oxígeno, lo que dio una tasa del 0,008%. Una revisión posterior de más de 80.000 tratamientos de pacientes reveló una tasa aún más baja: 0,0024%. La reducción de la incidencia puede deberse en parte al uso de una máscara (en lugar de una capucha) para administrar oxígeno.
El riesgo general de toxicidad del SNC puede ser tan alto como 1 en 2000 a 3000 tratamientos. pero varía con la presión y puede ser tan alto como 1 en 200 en programas de tratamiento de presión más alta de 2,8 a 3,0 ATA, o tan bajo como 1 en 10.000 programas en 2 ATA o menos.
La displasia broncopulmonar se encuentra entre las complicaciones más comunes de los bebés prematuros y su incidencia ha aumentado a medida que aumenta la supervivencia de los bebés extremadamente prematuros. Sin embargo, la gravedad ha disminuido a medida que un mejor manejo del oxígeno suplementario ha dado como resultado que la enfermedad ahora se relacione principalmente con factores distintos de la hiperoxia.
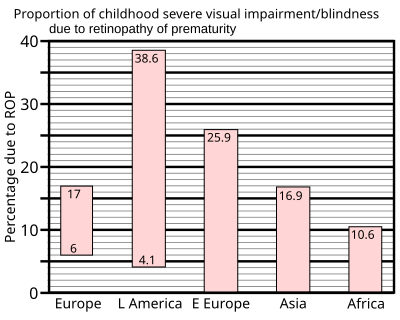
En 1997, un resumen de estudios de unidades de cuidados intensivos neonatales en países industrializados mostró que hasta el 60% de los bebés con bajo peso al nacer desarrollaban retinopatía del prematuro, que aumentó al 72% en los bebés con peso extremadamente bajo al nacer, definido como menos de 1 kg (2,2 libras) al nacer. Sin embargo, los resultados graves son mucho menos frecuentes: para los bebés de muy bajo peso al nacer (aquellos que pesan menos de 1,5 kg (3,3 lb) al nacer), se encontró que la incidencia de ceguera no supera el 8%.
La administración de oxígeno suplementario se utiliza amplia y eficazmente en medicina de emergencia y cuidados intensivos, pero las especies reactivas de oxígeno causadas por una oxigenación excesiva tienden a causar un círculo vicioso de lesión tisular, caracterizado por daño celular, muerte celular e inflamación, principalmente en los pulmones, lo que puede exacerbar los problemas de oxigenación de los tejidos para los cuales el oxígeno suplementario estaba destinado como tratamiento. Pueden ocurrir problemas similares en la oxigenoterapia para enfermedades crónicas que involucran hipoxia. La titulación cuidadosa del suministro de oxígeno para minimizar el exceso de las necesidades fisiológicas también reduce la exposición hiperóxica pulmonar al mínimo razonablemente practicable. La incidencia de síntomas pulmonares de toxicidad por oxígeno es aproximadamente del 5% y algunos fármacos pueden aumentar el riesgo, como el agente quimioterapéutico bleomicina.
Historia

La toxicidad del sistema nervioso central fue descrita por primera vez por Paul Bert en 1878. Demostró que el oxígeno era tóxico para insectos, arácnidos, miriápodos, moluscos, lombrices, hongos, semillas en germinación, aves y otros animales. La toxicidad del sistema nervioso central puede denominarse "efecto Paul Bert".
La toxicidad pulmonar por oxígeno fue descrita por primera vez por J. Lorrain Smith en 1899 cuando notó la toxicidad del sistema nervioso central y descubrió en experimentos con ratones y aves que 0,43 bar (43 kPa) no tenían ningún efecto, pero 0,75 bar (75 kPa) de oxígeno era un irritante pulmonar. La toxicidad pulmonar puede denominarse "efecto Lorrain Smith". La primera exposición humana registrada fue realizada en 1910 por Bornstein cuando dos hombres respiraron oxígeno a 2,8 bares (280 kPa) durante 30 minutos, mientras que él permaneció durante 48 minutos sin síntomas. En 1912, Bornstein desarrolló calambres en manos y piernas mientras respiraba oxígeno a 2,8 bar (280 kPa) durante 51 minutos. Luego, Smith pasó a demostrar que la exposición intermitente a un gas respirable con menos oxígeno permitía que los pulmones se recuperaran y retrasaba la aparición de la toxicidad pulmonar.
Albert R. Behnke et al. en 1935 fueron los primeros en observar la contracción del campo visual (visión de túnel) en inmersiones entre 1,0 bar (100 kPa) y 4,1 bar (410 kPa). Durante la Segunda Guerra Mundial, Donald y Yarbrough et al. realizaron más de 2000 experimentos sobre la toxicidad del oxígeno para respaldar el uso inicial de recicladores de oxígeno de circuito cerrado. En los primeros años del buceo con rebreather de oxígeno, los buzos navales desarrollaron una mitología sobre un monstruo llamado "Oxygen Pete", que acechaba en el fondo de la "olla húmeda" de la Unidad de Buceo Experimental del Almirantazgo. (una cámara hiperbárica llena de agua) para atrapar a buceadores desprevenidos. Llamaron a tener un ataque de toxicidad de oxígeno "recibir un Pete".
En la década posterior a la Segunda Guerra Mundial, Lambertsen et al. hicieron nuevos descubrimientos sobre los efectos de respirar oxígeno bajo presión y métodos de prevención. Su trabajo sobre exposiciones intermitentes para la extensión de la tolerancia al oxígeno y sobre un modelo para la predicción de la toxicidad pulmonar del oxígeno basado en la función pulmonar son documentos clave en el desarrollo de procedimientos operativos estándar al respirar presiones aumentadas de oxígeno. El trabajo de Lambertsen que muestra el efecto del dióxido de carbono en la disminución del tiempo transcurrido hasta la aparición de los síntomas del sistema nervioso central ha influido en el trabajo desde las pautas de exposición actuales hasta el diseño futuro de aparatos respiratorios.
La retinopatía del prematuro no se observaba antes de la Segunda Guerra Mundial, pero con la disponibilidad de oxígeno suplementario en la década siguiente, rápidamente se convirtió en una de las principales causas de ceguera infantil en los países desarrollados. En 1960, el uso de oxígeno se identificó como un factor de riesgo y se restringió su administración. La caída resultante de la retinopatía del prematuro estuvo acompañada de un aumento de la mortalidad infantil y de las complicaciones relacionadas con la hipoxia. Desde entonces, un seguimiento y diagnóstico más sofisticados han establecido protocolos para el uso de oxígeno que tienen como objetivo equilibrar las condiciones hipóxicas y los problemas de retinopatía del prematuro.
La displasia broncopulmonar fue descrita por primera vez por Northway en 1967, quien describió las condiciones que conducirían al diagnóstico. Esto fue ampliado más tarde por Bancalari y en 1988 por Shennan, quienes sugirieron que la necesidad de oxígeno suplementario a las 36 semanas podría predecir los resultados a largo plazo. Sin embargo, Palta et al. en 1998 concluyó que la evidencia radiográfica era el predictor más preciso de los efectos a largo plazo.

Bitterman et al. en 1986 y 1995 demostraron que la oscuridad y la cafeína retrasarían la aparición de cambios en la actividad eléctrica cerebral en ratas. En los años posteriores, la investigación sobre la toxicidad del sistema nervioso central se ha centrado en métodos de prevención y extensión segura de la tolerancia. Se ha demostrado que la sensibilidad a la toxicidad del oxígeno del sistema nervioso central se ve afectada por factores como el ritmo circadiano, los fármacos, la edad y el sexo. En 1988, Hamilton et al. escribieron procedimientos para que la Administración Nacional Oceánica y Atmosférica estableciera límites de exposición al oxígeno para las operaciones del hábitat. Incluso hoy en día, los modelos para la predicción de la toxicidad pulmonar del oxígeno no explican todos los resultados de la exposición a altas presiones parciales de oxígeno.
Sociedad y cultura
Los buceadores recreativos comúnmente respiran nitrox que contiene hasta un 40% de oxígeno, mientras que los buceadores técnicos usan oxígeno puro o nitrox que contiene hasta un 80% de oxígeno para acelerar la descompresión. Los buceadores que respiran fracciones de oxígeno superiores a las del aire (21%) necesitan ser educados sobre los peligros de la toxicidad del oxígeno y cómo gestionar el riesgo. Para comprar nitrox, es posible que se le solicite al buceador que presente evidencia de la calificación pertinente.
Desde finales de la década de 1990, el uso recreativo del oxígeno ha sido promovido por barras de oxígeno, donde los clientes respiran oxígeno a través de una cánula nasal. Se ha afirmado que esto reduce el estrés, aumenta la energía y disminuye los efectos de la resaca y los dolores de cabeza, a pesar de la falta de evidencia científica que lo respalde. También hay dispositivos a la venta que ofrecen "masaje con oxígeno" y "desintoxicación de oxígeno" con afirmaciones de eliminar toxinas corporales y reducir la grasa corporal. La Asociación Estadounidense del Pulmón ha declarado que "no hay evidencia de que el oxígeno en los bajos niveles de flujo utilizados en los bares pueda ser peligroso para la salud de una persona normal", pero el Centro para la Evaluación e Investigación de Medicamentos de EE. UU. advierte que las personas con enfermedades cardíacas o pulmonares necesitan que su oxígeno suplementario esté cuidadosamente regulado y no deben utilizar barras de oxígeno.
La sociedad victoriana sentía fascinación por el campo de la ciencia en rápida expansión. En "Dr. Ox's Experiment", cuento escrito por Julio Verne en 1872, el médico del mismo nombre utiliza la electrólisis del agua para separar oxígeno e hidrógeno. Luego bombea oxígeno puro por todo el pueblo de Quiquendone, haciendo que los habitantes normalmente tranquilos y sus animales se vuelvan agresivos y las plantas crezcan rápidamente. Una explosión de hidrógeno y oxígeno en la fábrica del Dr. Ox pone fin a su experimento. Verne resumió su historia explicando que los efectos del oxígeno descritos en el cuento fueron su propia invención (no están respaldados de ninguna manera por evidencia empírica). También hay un breve episodio de intoxicación por oxígeno en su "De la Tierra a la Luna".
Contenido relacionado
Ley de Fick
Precisión y exactitud
Evidencia empírica