Tornasol


El tornasol es una mezcla soluble en agua de diferentes colorantes extraídos de los líquenes. A menudo se absorbe en papel de filtro para producir una de las formas más antiguas de indicador de pH, que se utiliza para probar la acidez de los materiales. En un medio ácido, el papel tornasol azul se vuelve rojo, mientras que en un medio básico o alcalino, el papel tornasol rojo se vuelve azul. En definitiva, es un colorante e indicador que se utiliza para situar sustancias en una escala de pH.
Historia
La palabra "tornasol" proviene de una palabra nórdica antigua que significa "musgo usado para teñir". Hacia 1300, el médico español Arnaldus de Villa Nova comenzó a utilizar tornasol para estudiar ácidos y bases.
A partir del siglo XVI, el tinte azul se extrajo de algunos líquenes, especialmente en los Países Bajos.
Fuentes naturales

El tornasol se puede encontrar en diferentes especies de líquenes. Los tintes se extraen de especies como Roccella tinctoria (Sudamericana), Roccella fuciformis (Angola y Madagascar), Roccella pygmaea (Argelia), Roccella phycopsis, Lecanora tartarea (Noruega, Suecia), Variolaria dealbata, Ochrolechia parella, Parmotrema tinctorum y Parmelia. Actualmente, las principales fuentes son Roccella montagnei (Mozambique) y Dendrographa leucophoea (California).
Usos
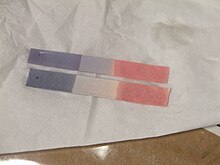
El uso principal del tornasol es comprobar si una solución es ácida o básica, ya que el papel tornasol azul se vuelve rojo en condiciones ácidas y el papel tornasol rojo se vuelve azul en condiciones básicas o alcalinas, y el cambio de color se produce en el rango de pH. 4,5–8,3 a 25 °C (77 °F). El papel tornasol neutro es violeta. El papel tornasol húmedo también se puede utilizar para detectar gases solubles en agua que afectan la acidez o la basicidad; el gas se disuelve en el agua y la solución resultante colorea el papel tornasol. Por ejemplo, el gas amoníaco, que es alcalino, vuelve azul el papel tornasol rojo. Si bien todo el papel tornasol actúa como papel de pH, lo contrario no es cierto.
El tornasol también se puede preparar como una solución acuosa que funciona de manera similar. En condiciones ácidas, la solución es roja y en condiciones alcalinas, la solución es azul.
| Litmus (pH indicador) | ||
| más abajo pH 4.5 | arriba pH 5 .3 | |
| 4.5 | ⇌ | 5 .3 |
Las reacciones químicas distintas a las ácido-base también pueden provocar un cambio de color en el papel tornasol. Por ejemplo, el cloro gaseoso vuelve blanco el papel tornasol azul; el tinte tornasol se blanquea porque hay iones de hipoclorito presentes. Esta reacción es irreversible, por lo que el tornasol no actúa como indicador en esta situación.
Química
La mezcla de tornasol tiene el número CAS 1393-92-6 y contiene de 10 a aproximadamente 15 colorantes diferentes. Es probable que todos los componentes químicos del tornasol sean los mismos que los de la mezcla relacionada conocida como orceína, pero en diferentes proporciones. A diferencia de la orceína, el componente principal del tornasol tiene una masa molecular media de 3300. Los indicadores ácido-base del tornasol deben sus propiedades a un cromóforo 7-hidroxifenoxazona. Algunas fracciones de tornasol recibieron nombres específicos, incluidos eritrolitmina (o eritroleína), azolitmina, espaniolitmina, leucoorceína y leucazolitmina. Azolitmin muestra casi el mismo efecto que el tornasol.
Una receta para hacer tornasol a partir de líquenes, como se describe en un sitio web de UC Santa Bárbara, dice:
Los detalles son difíciles de encontrar porque los procesos fueron mantenidos en secreto.
Este resumen de un procedimiento de fabricación moderno es de The Vanishing Lichens, D H S Richardson, Londres, 1975. Los líquenes (preferiblemente Lecanora tartarea y Roccella tinctoria) son terreno en una solución de carbonato de sodio y amoníaco.
Revise los líquenes de vez en cuando y el color cambia de rojo a púrpura y finalmente azul después de unas cuatro semanas. Los liquenes son secados y en polvo. En esta etapa los líquenes contienen parte lmus y en parte pigmentos orcein. La orceina se extrae mediante la extracción con alcohol, dejando el limus azul puro. Se comercializa como bultos azules, masas o tabletas, después de mezclarse con compuestos incoloros como la tiza y el yeso. El papel Litmus se impregna con esta sustancia.
Mecanismo
El tornasol rojo contiene un ácido diprótico débil. Cuando se expone a un compuesto básico, los iones de hidrógeno reaccionan con la base agregada. La base conjugada formada a partir del ácido tornasol tiene un color azul, por lo que el papel tornasol rojo húmedo se vuelve azul en una solución alcalina.
Referencias
- ^ "Litmus". 7 octubre 2021.
- ^ a b c Neupert, Manfred (31 de enero de 2013). "Lackmus". Römpp Lexikon Chemie (en alemán).
- ^ Surber, Christian; Humbert, Philippe; Abels, Christoph; Maibach, Howard (2018). Surber, Christian; Abels (eds.). pH de la piel: problemas y desafíos - Problemas actuales en la dermatología. Basel: Karger Medical and Scientific Publishers. p. 3. ISBN 9783318063851. Retrieved 1 de mayo 2023.
A principios del siglo XIV, el académico español, Arnaldus de Villa Nova (1235–1311), comenzó a utilizar el limus para estudiar ácidos y bases. Este compuesto, extraído de una líquena, se había utilizado como tinte desde al menos la época de los vikingos, pero él era la primera persona conocida por utilizarlo como prueba de acidez.
- ^ O'Leary, Donal (2000). "Clorine". Los elementos químicos. Archivado desde el original el 21 de septiembre de 2008.
- ^ Beecken, H.; E.-M. Gottschalk; U. v. Gizycki; H. Krämer; D. Maassen; H.-G. Matthies; H. Musso; C. Rathjen; Ul. Zdhorszky (2003). "Orceína y Litmus". Biotécnica " Histoquímica ". 78 (6): 289–302. doi:10.1080/10520290410001671362. PMID 15473576. S2CID 41944320.
- ^ H. Musso, C. Rathjen (1959). "Ocein dyes. X. Absorción de luz y cromoforo de litmus". Chem. Ber. 92 (3): 751–753. doi:10.1002/cber.19590920331.
- ^ E. T. Wolf: Vollständige Übersicht der Elementar-analytischen Untersuchungen organischer Substanzen, S. 450–453, veröffentlicht 1846, Verlag E. Anton (Alemania).
- ^ "Los estudiantes hacen preguntas, los científicos del UCSB responden". UCSB ScienceLine. 2002.