Emisión espontánea
(leer más)
La topología de una proteína transmembrana se refiere a las ubicaciones de los extremos N y C de la cadena polipeptídica que atraviesa la membrana con respecto a los lados interno o externo de la membrana biológica ocupada por la proteína.
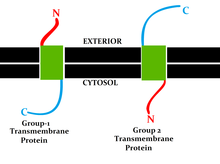
Varias bases de datos proporcionan topologías de proteínas de membrana determinadas experimentalmente. Incluyen Uniprot, TOPDB, OPM y ExTopoDB. También existe una base de datos de dominios ubicados de forma conservadora en un determinado lado de las membranas, TOPDOM.
Se desarrollaron varios métodos computacionales, con un éxito limitado, para predecir hélices alfa transmembrana y su topología. Los métodos pioneros utilizaron el hecho de que las regiones que atraviesan la membrana contienen más residuos hidrofóbicos que otras partes de la proteína, sin embargo, la aplicación de diferentes escalas hidrofóbicas alteró los resultados de la predicción. Posteriormente, se desarrollaron varios métodos estadísticos para mejorar la predicción topográfica y se introdujo un método de alineación especial. De acuerdo con la regla del interior positivo, los bucles citosólicos cerca de la bicapa lipídica contienen más aminoácidos cargados positivamente. La aplicación de esta regla resultó en los primeros métodos de predicción de topología. También existe una regla externa negativa en las hélices alfa transmembrana de las proteínas de un solo paso, aunque los residuos cargados negativamente son más raros que los residuos cargados positivamente en los segmentos transmembrana de las proteínas. A medida que se determinaron más estructuras, aparecieron los algoritmos de aprendizaje automático. Los métodos de aprendizaje supervisado se entrenan en un conjunto de estructuras determinadas experimentalmente; sin embargo, estos métodos dependen en gran medida del conjunto de entrenamiento. Los métodos de aprendizaje no supervisados se basan en el principio de que la topología depende de la máxima divergencia de las distribuciones de aminoácidos en diferentes partes estructurales. También se demostró que bloquear la ubicación de un segmento en función del conocimiento previo sobre la estructura mejora la precisión de la predicción. Esta característica se ha agregado a algunos de los métodos de predicción existentes. Los métodos más recientes utilizan la predicción por consenso (es decir, utilizan varios algoritmos para determinar la topología final) e incorporan automáticamente información experimental previamente determinada. La base de datos HTP proporciona una colección de topologías que se predicen computacionalmente para las proteínas transmembrana humanas.
La discriminación de péptidos señal y segmentos transmembrana es un problema adicional en la predicción de topología tratado con un éxito limitado por diferentes métodos. Tanto los péptidos señal como los segmentos transmembrana contienen regiones hidrofóbicas que forman hélices α. Esto provoca la predicción cruzada entre ellos, que es una debilidad de muchos predictores de topología transmembrana. Mediante la predicción simultánea de péptidos señal y hélices transmembrana (Phobius), los errores causados por la predicción cruzada se reducen y el rendimiento aumenta sustancialmente. Otra característica utilizada para aumentar la precisión de la predicción es la homología (PolyPhobius)”.
También es posible predecir proteínas de membrana de barril beta' topología
(leer más)
(leer más)
(leer más)