Tipificación de tejidos
La tipificación de tejidos es un procedimiento en el que se analiza la compatibilidad de los tejidos de un posible donante y un posible receptor antes del trasplante. La incompatibilidad de los tejidos del donante y del receptor puede provocar el rechazo de los tejidos. Existen varios métodos de tipificación de tejidos.
Sinopsis

Durante la tipificación de tejidos, se identifican los antígenos leucocitarios humanos (HLA) de un individuo. Las moléculas de HLA se presentan en la superficie de las células y facilitan las interacciones entre las células inmunitarias (como las células dendríticas y las células T) que conducen a respuestas inmunitarias adaptativas. Si el sistema inmunitario del receptor reconoce el HLA del donante como diferente del HLA del propio receptor, se puede desencadenar una respuesta inmunitaria contra los tejidos del donante. Más específicamente, los desajustes de HLA entre donantes y receptores de órganos pueden conducir al desarrollo de anticuerpos específicos del donante (DSA) anti-HLA. Los DSA están fuertemente asociados con el rechazo de tejidos del donante en el receptor, y su presencia se considera un indicador de rechazo mediado por anticuerpos. Cuando los HLA del donante y del receptor son compatibles, los tejidos del donante tienen significativamente más probabilidades de ser aceptados por el sistema inmunitario del receptor. Durante la tipificación de tejidos, se deben tipificar varios genes HLA tanto en el donante como en el receptor, incluidos los genes HLA de clase I A, B y C, así como los genes HLA de clase II DRB1, DRB3, DRB4, DRB5, DQA1, DQB1, DPA1 y DPB1. La tipificación de HLA se hace más difícil por el hecho de que la región HLA es la región genéticamente más variable en el genoma humano.
Métodos de escritura de tejido
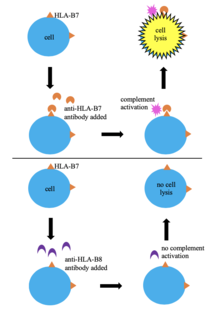
Uno de los primeros métodos de tipificación de tejidos fue la tipificación serológica. En esta técnica, las células sanguíneas de un donante se tipifican en función del HLA mezclándolas con suero que contiene anticuerpos anti-HLA. Si los anticuerpos reconocen su epítopo en el HLA del donante, se produce la activación del complemento, lo que provoca la lisis y muerte celular, lo que permite que las células absorban un colorante (azul tripán). Esto permite la identificación del HLA de las células basándose indirectamente en la especificidad de los anticuerpos conocidos en el suero. Este método se ha utilizado ampliamente porque es simple, rápido y de bajo costo; sin embargo, la enorme variabilidad en los alelos del HLA significa que el suero que contiene anticuerpos específicos del HLA de las células que se están analizando puede no estar disponible. La tipificación serológica no proporciona una imagen clara de la región del HLA y no siempre da como resultado una tipificación del HLA exitosa, por lo que muchos laboratorios han dejado de utilizarlo en favor de métodos más efectivos.
Recientemente, han surgido otros métodos más eficaces, incluido el uso de la reacción en cadena de la polimerasa (PCR) basada en cebadores específicos de secuencia (SSP) o sondas de oligonucleótidos específicos de secuencia (SSOP). Sin embargo, la SSP-PCR puede consumir tiempo y recursos. La SSOP-PCR es mejor para la tipificación de HLA de un gran número de individuos, por ejemplo, un gran número de donantes para registros de médula ósea. La RT-PCR es otro método para la tipificación de HLA que es rápido y versátil, pero es costoso.
El análisis conformacional mediado por la cadena de referencia (RSCA) es otro método utilizado para la tipificación de HLA. En este método, una muestra de HLA desconocida se mezcla con un alelo de referencia y se procesa en un gel mediante electroforesis. El RSCA está limitado por la cantidad de alelos de referencia de HLA disponibles, ya que la región de HLA es muy diversa.
Actualmente, la secuenciación directa de ADN se considera el mejor método de tipificación de HLA, ya sea mediante la secuenciación de Sanger o la secuenciación de nueva generación, aunque también puede requerir mucho tiempo y es uno de los métodos más costosos. También se puede utilizar la secuenciación de ARN, pero muchos laboratorios no lo hacen porque el ARN es inestable y propenso a degradarse.
Véase también
- Enfermedad de injerto-versus-host
- Histocompatibilidad
Referencias
- ^ Mulley, William R.; Hudson, Fiona; Lee, Darren; Holdsworth, Rhonda F. (2019). "Tisue typing for riñón transplantation for the general nephrologist". Nephrology. 24 (10): 997–1000. doi:10.1111/nep.13637. ISSN 1440-1797. PMID 31335997.
- ^ Nazahah, M.; Koh, M. B. C. (2015). "Tisue typing and its role in transplantation". ISBT Science Series. 10 (S1): 115–123. doi:10.1111/voxs.12168. ISSN 1751-2824. S2CID 71558083.
- ^ a b c d Mahdi, Batool Mutar (2013-02-23). "Un resplandor de HLA escribiendo en trasplante de órganos". Medicina Clínica y Traducción. 2 (1): 6. doi:10.1186/2001-1326-2-6. ISSN 2001-1326. PMC 3598844. PMID 23432791.
- ^ Argani, Hassan (enero 2019). "Anti-HLA Anticuerpo: El papel de los epitopos en el trasplante de órganos". Trasplante experimental y clínico. 17 (Suplemento 1): 38–42. doi:10.6002/ect.MESOT2018.L41. PMID 30777521. S2CID 73478179.
- ^ Zhang, Rubin (2018-01-06). "Los anticuerpos Donantes Específicos en los receptores de trasplante de riñón". Clinical Journal of the American Society of Nephrology. 13 (1): 182–192. doi:10.2215/CJN.00700117. ISSN 1555-9041. PMC 5753302. PMID 28446536.
- ^ a b c d e f Deaglio, Silvia; Amoroso, Antonio; Rinaldi, Mauro; Boffini, Massimo (2020-02-13). "HLA escribiendo en trasplante de pulmón: ¿la alta resolución encaja todo?". Annals of Translational Medicine. 8 3): 45. doi:10.21037/atm.2020.01.45. ISSN 2305-5847. PMC 7036624. PMID 32154803.
- ^ Kishore, Amit; Petrek, Martin (2018). "Siguiente Generación Secuenciación Basada HLA Tipo: Descifrar los Aspectos Inmunogenéticos de la Sarcoidosis". Fronteras en genética. 9: 503. doi:10.3389/fgene.2018.00503. ISSN 1664-8021. PMC 6210504. PMID 30410504.
- ^ a b c d e f g Dunn, P. P. J. (2011). "El antígeno de leucocito humano: técnicas y tecnología, una evaluación crítica". International Journal of Immunogenetics. 38 (6): 463–473. doi:10.1111/j.1744-313X.2011.01040.x. ISSN 1744-313X. PMID 22059555. S2CID 44343932.
Enlaces externos
- Cómo funciona el tejido de preimplantación, sitio web de HFEA
- Tissue+typing en la Biblioteca Nacional de Medicina de EE.UU.
- Comprensión Tissue Typing