Tetralogía de Fallot
tetralogía de Fallot (TOF), anteriormente conocida como tetralogía de Steno-Fallot, es un defecto cardíaco congénito caracterizado por cuatro defectos cardíacos específicos. Clásicamente, los cuatro defectos son:
- Estenosis pulmonar, que está estrechando la salida del ventrículo derecho;
- un defecto septal ventricular, que es un agujero que permite que la sangre fluya entre los dos ventrículos;
- hipertrofia ventricular derecha, que es engrosamiento del músculo ventricular derecho; y
- una aorta dominante, que es donde la aorta se expande para permitir que la sangre de ambos ventrículos entre.
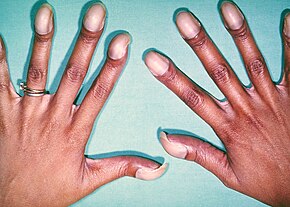
Al nacer, los niños pueden ser asintomáticos o presentar muchos síntomas graves. Más adelante en la infancia, normalmente hay episodios de coloración azulada en la piel debido a la falta de oxigenación suficiente, lo que se conoce como cianosis. Cuando los bebés afectados lloran o defecan, pueden sufrir un "episodio tet" donde se vuelven cianóticos, tienen dificultad para respirar, se vuelven flácidos y ocasionalmente pierden el conocimiento. Otros síntomas pueden incluir un soplo cardíaco, palpitaciones en los dedos y cansancio fácil al amamantar.
Por lo general, se desconoce la causa de la tetralogía de Fallot. Los factores de riesgo incluyen una madre que consume alcohol, tiene diabetes, tiene más de 40 años o contrae rubéola durante el embarazo. También puede estar asociado con el síndrome de Down y otros defectos cromosómicos que causan defectos cardíacos congénitos.
La TOF generalmente se trata mediante una cirugía a corazón abierto durante el primer año de vida. El momento de la cirugía depende de los síntomas y el tamaño del bebé. El procedimiento implica aumentar el tamaño de la válvula pulmonar y las arterias pulmonares y reparar el defecto del tabique ventricular. En bebés que son demasiado pequeños, se puede realizar una cirugía temporal con planes para una segunda cirugía cuando el bebé sea más grande. Con el cuidado adecuado, la mayoría de las personas afectadas viven hasta la edad adulta. Los problemas a largo plazo pueden incluir frecuencia cardíaca irregular e insuficiencia pulmonar.
Se estima que la prevalencia de TOF oscila entre 0,02 y 0,04 %. Aunque inicialmente se pensó que los hombres y las mujeres se veían afectados por igual, estudios más recientes han encontrado que los hombres se ven más afectados que las mujeres. Es el defecto cardíaco congénito complejo más común y representa alrededor del 10 por ciento de los casos. Fue inicialmente descrito en 1671 por Niels Steensen. Una descripción adicional fue publicada en 1888 por el médico francés Étienne-Louis Arthur Fallot, de quien toma su nombre. La primera reparación quirúrgica total se llevó a cabo en 1954.
Signos y síntomas
La tetralogía de Fallot provoca una baja oxigenación de la sangre. Esto se debe a una mezcla de sangre oxigenada y desoxigenada en el ventrículo izquierdo a través de la comunicación interventricular (CIV) y al flujo preferencial de la sangre mezclada desde ambos ventrículos a través de la aorta debido a la obstrucción del flujo a través de la válvula pulmonar. Este último se conoce como derivación de derecha a izquierda.
Los bebés con TOF, una enfermedad cardíaca cianótica, tienen una saturación de oxígeno en la sangre baja. La oxigenación de la sangre varía mucho de un paciente a otro dependiendo de la gravedad de los defectos anatómicos. Los rangos típicos varían de 60% a alrededor de 90%. Según el grado de obstrucción, los síntomas varían desde ausencia de cianosis o cianosis leve hasta cianosis profunda al nacer. Si el bebé no está cianótico, a veces se lo denomina "tet rosado". Otros síntomas incluyen un soplo cardíaco que puede variar de casi imperceptible a muy fuerte, dificultad para alimentarse, falta de aumento de peso, retraso en el crecimiento y desarrollo físico, dificultad para respirar (disnea) al hacer ejercicio, palpitaciones en los dedos de las manos y los pies y policitemia. El bebé puede ponerse azul con la lactancia o el llanto.
Aquellos que nacen con tetralogía de Fallot tienen más probabilidades de experimentar trastornos psiquiátricos como el trastorno por déficit de atención con hiperactividad (TDAH) en el futuro, posiblemente debido a cambios genéticos subyacentes que predisponen a ambas afecciones.
Hechizos de tet
Los bebés y niños con tetralogía de Fallot no reparada pueden desarrollar "episodios de tet". Estos son episodios de hipoxia aguda, caracterizados por dificultad para respirar, cianosis, agitación y pérdida del conocimiento. Esto puede ser iniciado por cualquier evento, como ansiedad, dolor, deshidratación o fiebre, que conduce a una disminución de la saturación de oxígeno o que causa una disminución de la resistencia vascular sistémica, lo que a su vez conduce a un aumento de la derivación a través del defecto septal ventricular. Por lo general, estos episodios disminuyen en frecuencia después de los primeros cuatro años de vida.
Desde el punto de vista clínico, los episodios de tet se caracterizan por un aumento marcado y repentino de la cianosis seguido de síncope.
Los niños mayores a menudo se pondrán en cuclillas instintivamente durante un período de tet. Esto aumenta la resistencia vascular sistémica y permite una reversión temporal de la derivación. Aumenta la presión en el lado izquierdo del corazón, disminuyendo el shunt de derecha a izquierda, disminuyendo así la cantidad de sangre desoxigenada que ingresa a la circulación sistémica.
Causa
Si bien las causas específicas de TOF no se han identificado por completo, existen varios factores ambientales o genéticos que se han asociado con TOF. Hasta ahora, alrededor del 20 % de los casos de CHD en general se han debido a causas conocidas, como defectos genéticos y teratógenos, que son varios factores que causan anomalías en el desarrollo del embrión o defectos de nacimiento. Sin embargo, el otro 80% de los casos tienen poco conocimiento sobre su causa.
Los factores genéticos relacionados con TOF incluyen varias mutaciones o deleciones genéticas. Las deleciones de genes asociadas con TOF incluyen la deleción del cromosoma 22 y el síndrome de DiGeorge.
Las asociaciones de genes específicos con TOF incluyen:
- Códigos JAG1 para ligandos dentro de la familia Notch de proteínas y está altamente expresado en el corazón en desarrollo. Las mutaciones del gen JAG1 pueden llevar al desarrollo cardíaco anormal asociado con TOF.
- Códigos NKX2-5 para reguladores de morfogénesis cardíaca para permitir el desarrollo del corazón adecuado. Los defectos en este gen típicamente causan defectos septales y se han asociado con alrededor del 4% de todos los casos TOF.
- ZFPM2 es otro regulador cardíaco involucrado en la regulación de GATA4. Las mutaciones del gen ZFPM2 conducen a reducir la producción de GATA y se han visto en algunos casos TOF.
- VEGF un conocido factor de crecimiento endotelial involucrado en la vascularización del corazón. Se ha demostrado que la expresión VEGF disminuyeda es un modificador de TOF.
- NOTCH1 está involucrado en la vascularización de los tejidos y es el sitio más común de variaciones genéticas involucradas con TOF, con un 7% de todos los casos TOF.
- TBX1 expresa progenitores involucrados en el desarrollo del ventrículo derecho. Chromosome 22q11 deletions also deleting TBX1 gene have been seen in 17% TOF cases.
- La expresión del gen FLT4 conduce al receptor del factor de crecimiento endotelial vascular 3 (VEGFR-3) que ayuda a la vascularización. Las mutaciones de este gen se han asociado con TOF, con un 2,4% de todos los casos.
- FOXC2 es otro gen involucrado en el desarrollo embrionario del sistema cardíaco. Las mutaciones de este gen se han demostrado como resultado en el síndrome linfático disfuncional y TOF.
- GATA4 ayuda en el desarrollo cardíaco ayudando a aumentar la producción de cardiomiocitos. Las mutaciones de este gen se han visto en varios casos familiares TOF que a menudo duran 2-3 generaciones.
- FLNA es una proteína codificada por el gen del mismo nombre que cruza filamentos de actina en redes en citoplasma y ayuda a anclar proteínas de membrana para el citoesqueleto de actina. Las mutaciones de este gen se vieron causando TOF en algunos pacientes.
Los factores ambientales que se han estudiado para estar potencialmente asociados con TOF incluyen:
- Consumo de alcohol materna: Durante el desarrollo embrionario, muchos de los sistemas de procesamiento y filtración del cuerpo no están completamente desarrollados. El cuerpo fetal no puede procesar el alcohol, así como los adultos que pueden conducir a un desarrollo impropio, incluyendo la cardiogénesis. Aunque no se han encontrado pruebas concluyentes entre los efectos del consumo de alcohol y la TOF, el consumo de alcohol materna se ha visto en varios pacientes con TOF.
- Fumar materna: El tabaquismo materno se ha asociado con varias complicaciones fetales, como el parto prematuro y el bajo peso al nacer, que pueden conducir a la TOF. En el famoso estudio Baltimore-Washington, se informó que fumar más de un paquete por día mientras estaba embarazada se asoció con dos desvíos cardíacos específicos, ambas partes de TOF: estenosis pulmonar y transposición con VSD.
- Diabetes maternas: La diabetes materna, la diabetes mellitus y la diabetes gestacional son factores de riesgo conocidos de CHD fetal, incluyendo TOF. Se ha demostrado que la diabetes materna aumenta el riesgo de deformaciones cardiovasculares, a saber, la transposición de grandes arterias, una de las cuatro deformaciones en TOF. Los estudios también han analizado si la diabetes aumenta el riesgo de malformación o regulación deficiente del azúcar y han encontrado que la regulación del azúcar no afecta significativamente las malformaciones cardíacas. Estudios retrospectivos han demostrado que las madres diabéticas con buen control de glucosa siguen manteniendo el riesgo elevado de CHD.
- Rubella: Rubella se caracteriza como enfermedad viral leve y contagiosa con consecuencias a menudo sin darse cuenta. La infección con rubéola durante el primer trimestre ha sido vista para causar varias malformaciones fetales, incluyendo TOF.
- Edad materna: La edad materna más vieja, especialmente después de 35 años puede tener varios riesgos de embarazo debido a las comorbilidades existentes como hipertensión, diabetes, hipotiroidismo y consanguinidad. Estos factores de riesgo pueden afectar el desarrollo fetal y conducir a diversas condiciones fetales como CHD (incluyendo TOF), Down Syndrome y Autism.
Los estudios de embriología muestran que la mala alineación anterior del tabique aortopulmonar da como resultado la combinación clínica de un defecto del tabique ventricular (CIV), estenosis pulmonar y una aorta superpuesta. La hipertrofia ventricular derecha se desarrolla progresivamente a partir de la resistencia al flujo sanguíneo a través del tracto de salida del ventrículo derecho.
Fisiopatología
En individuos sanos, el corazón humano se desarrolla alrededor del día 20 de gestación, cuando los tubos endocárdicos externos se fusionan en un solo tubo cardíaco. A partir de entonces, el tubo cardíaco comienza a plegarse, convirtiéndose en la aurícula y el ventrículo. El ventrículo derecho es dominante antes del nacimiento, recibe el 65% del retorno venoso al corazón y es el principal contribuyente del flujo sanguíneo a la parte inferior del cuerpo, la placenta y los pulmones. Aunque se desconoce la causa exacta de TOF, una asociación que se ha observado es una desviación anterior del tabique infundibular que da como resultado un VSD desalineado, con una aorta anulada que causa una obstrucción posterior del ventrículo derecho.
Diferentes factores, como la estenosis pulmonar, también pueden contribuir a la obstrucción del flujo de salida del ventrículo derecho. Durante los períodos de tet, se observaría fisiológicamente una disminución de la resistencia vascular sistémica o un aumento de la resistencia pulmonar.
El principal defecto anatómico en TOF es la desviación anterior del tabique de salida pulmonar. Este defecto da como resultado el estrechamiento del tracto de salida del ventrículo derecho (RVOT), la anulación de la aorta y un VSD.
Cuatro malformaciones
"Tetralogía" denota cuatro partes, lo que aquí implica los cuatro defectos anatómicos del síndrome. Esto no debe confundirse con la teratología de nombre similar, un campo de la medicina que se ocupa del desarrollo anormal y las malformaciones congénitas (incluida la tetralogía de Fallot). A continuación se muestran las cuatro malformaciones cardíacas que se presentan juntas en la tetralogía de Fallot:
| Estado | Descripción |
|---|---|
| Infundibular pulmonar Estenosis | Un estrechamiento del tracto de salida ventricular derecho. Puede ocurrir en la válvula pulmonar (estenosis valvular) o justo debajo de la válvula pulmonar (estenosis infundibular). La estenosis pulmónica infundibular es causada principalmente por el hacinamiento de la pared muscular del corazón (hipertrofia de la trabecula septoparietal), sin embargo, se cree que los eventos que conducen a la formación de la aorta dominante también son una causa. La estenosis pulmónica es la principal causa de las malformaciones, con las otras malformaciones asociadas actuando como mecanismos compensatorios a la estenosis pulmónica. El grado de estenosis varía entre individuos con TOF y es el determinante primario de los síntomas y la gravedad. Esta malformación se describe infrecuentemente como estenosis subpulmonar o obstrucción subpulmonar. |
| Aorta dominante | Una válvula aórtica con conexión biventricular, es decir, está situada sobre el defecto septal ventricular y conectada tanto a la derecha como al ventrículo izquierdo. El grado en el que la aorta se adjunta al ventrículo derecho se denomina su grado de "override". La raíz aórtica se puede desplazar hacia el frente (anteriormente) o directamente sobre el defecto septal, pero siempre se encuentra anormalmente ubicado a la derecha de la raíz de la arteria pulmonar. El grado de anulación es extremadamente variable, con el 5-95% de la válvula conectada al ventrículo derecho. |
| Defecto ventricular de septal (VSD) | Un agujero entre las dos cámaras inferiores (ventrículos) del corazón. El defecto se centra alrededor del aspecto más superior del septo ventricular (el septo de salida), y en la mayoría de los casos es único y grande. En algunos casos, el engrosamiento del septo (hipertrofia eseptal) puede estrechar los márgenes del defecto. |
| Hipertrofia ventricular derecha | El ventrículo derecho es más musculoso de lo normal, causando un aspecto característico en forma de bota (coeur-en-sabot) visto por rayos X de pecho. Debido a la extralimitación del septo ventricular externo, la pared ventricular derecha aumenta en tamaño para tratar el aumento de la obstrucción al tracto de salida derecho. Esta característica es ahora generalmente acordada como una anomalía secundaria, ya que el nivel de hipertrofia tiende a aumentar con la edad. |
Existe una variación anatómica entre los corazones de las personas con tetralogía de Fallot. Principalmente, el grado de obstrucción del tracto de salida del ventrículo derecho varía entre pacientes y generalmente determina los síntomas clínicos y la progresión de la enfermedad.
Presuntamente, esto surge de un crecimiento desigual del tabique aortopulmonar (también conocido como tabique de salida pulmonar). La aorta es demasiado grande, por lo que "sobrepasa" y este "roba" de la arteria pulmonar, que por lo tanto está estenosada. Esto entonces evita el cierre de la pared ventricular, por lo tanto, VSD, y esto aumenta las presiones en el lado derecho, por lo que el ventrículo R se agranda para manejar el trabajo.
Anomalías adicionales
Además, la tetralogía de Fallot puede presentarse con otras anomalías anatómicas, que incluyen:
- estenosis de la arteria pulmonar izquierda, en 40%
- una válvula pulmonar bicúspide, en 60%
- arco aórtico lado derecho, en 25%
- anomalías coronarias, en 10%
- a patente foramen ovale o defecto septal auricular, en cuyo caso el síndrome se llama a veces pentalogía de Fallot
- un defecto septal auriculoventricular
- Retorno venoso pulmonar total o parcialmente anómalo
La tetralogía de Fallot con atresia pulmonar (pseudotruncus arteriosus) es una variante grave en la que existe una obstrucción completa (atresia) del tracto de salida del ventrículo derecho, provocando una ausencia del tronco pulmonar durante el desarrollo embrionario. En estos individuos, la sangre se desvía completamente del ventrículo derecho al izquierdo, donde se bombea solo a través de la aorta. Los pulmones se perfunden a través de extensas colaterales de las arterias sistémicas y, a veces, también a través del conducto arterioso.
Diagnóstico
Hay tres diferentes pruebas de diagnóstico útiles que se utilizan para el diagnóstico de la tetralogía de Fallot. Estos incluyen una radiografía de tórax, un electrocardiograma y un ecocardiograma. La ecocardiografía determina el diagnóstico final y típicamente ofrece información suficiente para la planificación del tratamiento quirúrgico. Alrededor de la mitad de todos los pacientes ahora son diagnosticados antes de nacer. El diagnóstico diferencial es cuando los médicos diagnostican entre dos o más condiciones para los síntomas de una persona y esto puede incluir causas pulmonares primarias de cianosis, lesiones cardíacas cianóticas, estenosis pulmonar y troncos arteriales transpuestos.
Radiografía de tórax
Antes de que se dispusiera de técnicas más sofisticadas, la radiografía de tórax era el método definitivo de diagnóstico. El anormal "coeur-en-sabot" La apariencia (en forma de bota) de un corazón con tetralogía de Fallot es clásicamente visible a través de una radiografía de tórax, aunque la mayoría de los bebés con tetralogía pueden no mostrar este hallazgo. La forma de bota se debe a la hipertrofia ventricular derecha presente en TOF. Los campos pulmonares a menudo son oscuros (ausencia de marcas pulmonares intersticiales) debido a la disminución del flujo sanguíneo pulmonar.
Electrocardiograma
Un electrocardiograma (ECG) es uno de los procedimientos más básicos para evaluar el corazón. Se aplican pequeños electrodos en áreas específicas del cuerpo, cerca del pecho, el brazo y el cuello. Los cables conductores conectan los electrodos a una máquina de ECG. Luego se mide la actividad eléctrica del corazón. Los impulsos eléctricos naturales ayudan a que la sangre fluya correctamente al coordinar las contracciones en diferentes áreas del corazón. Estos impulsos se registran mediante un ECG, que muestra la rapidez, el ritmo, la intensidad y el tiempo de los impulsos eléctricos a medida que viajan por el corazón.
La electrocardiografía muestra hipertrofia ventricular derecha (HVD), junto con desviación del eje a la derecha. La RVH se observa en el EKG como ondas R altas en la derivación V1 y ondas S profundas en la derivación V5-V6.
Ecocardiograma
Los defectos cardíacos congénitos ahora se diagnostican con una ecocardiografía, que es rápida, no implica radiación, es muy específica y se puede realizar antes del nacimiento.
La ecocardiografía establece la presencia de TOF al demostrar VSD, RVH y anulación aórtica. Muchos pacientes son diagnosticados prenatalmente. El Doppler color (tipo de ecocardiografía) mide el grado de estenosis pulmonar. Además, se realiza una estrecha vigilancia del conducto arterioso en el período neonatal para garantizar que haya un flujo sanguíneo adecuado a través de la válvula pulmonar.
En ciertos casos, la anatomía de la arteria coronaria no se puede ver claramente mediante un ecocardiograma. En este caso, se puede realizar un cateterismo cardíaco.
Genética
Desde una perspectiva genética, es importante evaluar DiGeorge en todos los bebés con TOF.
Tratamiento
Hechizos de tet
Los episodios de Tet se definen como episodios cianóticos que ocurren debido a la obstrucción del flujo de salida del ventrículo derecho. Los ataques de tet pueden desencadenarse por varios factores, como llanto, taquipnea progresiva y respiración profunda, con síntomas que incluyen, entre otros, piel, uñas y labios azules, llanto profundo y dificultad para respirar.
Los episodios de Tet pueden tratarse con bloqueadores beta como propranolol, pero los episodios agudos requieren una intervención rápida con morfina o fentanilo intranasal para reducir el impulso ventilatorio, un vasopresor como fenilefrina o norepinefrina para aumentar la resistencia vascular sistémica y líquidos intravenosos para expansión de volumen.
El oxígeno (100 %) puede ser eficaz en el tratamiento de los episodios porque es un potente vasodilatador pulmonar y vasoconstrictor sistémico. Esto permite un mayor flujo de sangre a los pulmones al disminuir la derivación de sangre desoxigenada del ventrículo derecho al izquierdo a través del VSD. También existen procedimientos sencillos, como ponerse en cuclillas y la posición del tórax con las rodillas, que aumentan la resistencia vascular sistémica y disminuyen la derivación de derecha a izquierda de la sangre desoxigenada hacia la circulación sistémica.
Si los episodios son refractarios a los tratamientos anteriores, las personas suelen ser intubadas y sedadas. El tratamiento de último recurso para los episodios de tet es la oxigenación por membrana extracorpórea (ECMO) junto con la consideración de la derivación Blalock Taussig (derivación BT).
Reparación quirúrgica total
La reparación quirúrgica total de TOF es una cirugía curativa. Se pueden usar diferentes técnicas para realizar la reparación TOF. Sin embargo, en la mayoría de los casos se utiliza un abordaje arterial transpulmonar transauricular. La reparación consta de dos pasos principales: el cierre de la VSD con un parche y la reconstrucción del tracto de salida del ventrículo derecho.
Esta cirugía a corazón abierto está diseñada para aliviar la estenosis del tracto de salida del ventrículo derecho mediante la resección cuidadosa del músculo y para reparar la CIV. El tracto de salida del ventrículo derecho se puede reconstruir utilizando principalmente dos procedimientos: un parche transanular (TAP) o un procedimiento de preservación de la válvula pulmonar (PVS). La decisión sobre el tipo de procedimiento depende de la anatomía individual (especialmente el tamaño de la válvula pulmonar). La EVP mostró mejor supervivencia global, supervivencia libre de eventos y menor insuficiencia pulmonar a los 10, 20 y 30 años de la operación. La EVP se puede realizar con o sin ventriculotomía. Un estudio encontró una tasa de regurgitación pulmonar y supervivencia general y libre de eventos similares entre los pacientes que se sometieron a EVP con ventriculotomía y los que no.
Se puede realizar cirugía reparadora o reconstructiva adicional en pacientes según lo requiera su anatomía cardíaca particular.
El momento de la cirugía en pacientes asintomáticos suele ser entre dos meses y un año de edad. Sin embargo, en los pacientes sintomáticos que muestran un empeoramiento de los niveles de oxígeno en la sangre, los episodios de tet severos (episodios cianóticos) o la dependencia de las prostaglandinas desde el período neonatal temprano (para mantener abierto el conducto arterioso) deben planificarse con bastante urgencia.
Las posibles complicaciones de la reparación quirúrgica incluyen defecto septal ventricular residual, obstrucción del tracto de salida residual, bloqueo auriculoventricular completo, arritmias, aneurisma del parche de salida del ventrículo derecho e insuficiencia de la válvula pulmonar. Las complicaciones a largo plazo más comúnmente incluyen insuficiencia de la válvula pulmonar y arritmias.
La reparación total de la tetralogía de Fallot inicialmente conllevaba un alto riesgo de mortalidad, pero este riesgo se ha reducido constantemente a lo largo de los años. La cirugía ahora se lleva a cabo a menudo en bebés de un año de edad o menos con menos del 5% de mortalidad perioperatoria. Después de la cirugía, la mayoría de los pacientes disfrutan de una vida activa libre de síntomas. Actualmente, la supervivencia a largo plazo es cercana al 90%. Hoy en día, la población de TOF en adultos continúa creciendo y es uno de los defectos cardíacos congénitos más comunes que se observan en las clínicas ambulatorias para adultos.
Cirugía paliativa
Inicialmente, la cirugía consistía en formar una anastomosis de lado a extremo entre la arteria subclavia y la arteria pulmonar, es decir, un shunt arterial sistémico a pulmonar. Esto redirigió una gran parte de la sangre parcialmente oxigenada que sale del corazón hacia el cuerpo hacia los pulmones, aumentando el flujo a través del circuito pulmonar y aliviando los síntomas. La primera cirugía de derivación Blalock-Thomas-Taussig se realizó en Eileen Saxon, de 15 meses, el 29 de noviembre de 1944 con resultados espectaculares.
La derivación de Potts y la derivación de Waterston-Cooley son otros procedimientos de derivación que se desarrollaron con el mismo propósito. Estos ya no se usan.
Actualmente, la cirugía paliativa normalmente no se realiza en bebés con TOF, excepto en casos extremos. Por ejemplo, en lactantes sintomáticos, se puede realizar una reparación en dos etapas (colocación inicial de una derivación sistémica a arterial seguida de una reparación quirúrgica total). Las posibles complicaciones incluyen flujo sanguíneo pulmonar inadecuado, distorsión de la arteria pulmonar, crecimiento inadecuado de las arterias pulmonares y atresia pulmonar adquirida.
Enfoques para la reparación quirúrgica
Después de años de experiencia en reparación quirúrgica de tetralogía de Fallot, la atención se centró en la evidencia emergente de que la insuficiencia pulmonar a largo plazo es perjudicial para la función ventricular derecha y el pronóstico clínico. Como resultado, se ha intensificado la búsqueda de procedimientos quirúrgicos para aliviar la obstrucción del tracto de salida del ventrículo derecho y minimizar la regurgitación pulmonar.
Una reconstrucción del tracto de salida del ventrículo derecho restringido con un parche de Dacron combinado con una expansión nominal del anillo pulmonar o un abordaje de preservación del anillo arrojó resultados primarios de reparación completa en 94 bebés con TOF. El tamaño del anillo pulmonar fue mayor en los bebés tratados con esta última técnica, como se predijo. Después de un seguimiento promedio de alrededor de ocho años, el primer grupo tuvo una PR superior a la moderada, pero no hubo una diferencia significativa en la independencia de la PR severa después de diez años.
Además, no hubo diferencias significativas en la dilatación del ventrículo derecho entre las dos técnicas. Finalmente, encontraron que la reconstrucción del anillo pulmonar en TOF con solo una pequeña incisión transanular y un parche rígido de Dacron para inhibir la extensión del anillo pulmonar durante la fase de crecimiento normal produce los mismos beneficios a largo plazo que la preservación de la integridad total del anillo pulmonar.
Complicaciones
Corto plazo
Los defectos septales ventriculares residuales y la obstrucción persistente del flujo de salida del ventrículo derecho son problemas comunes en el período posoperatorio inmediato. Arritmias como taquicardia ventricular, fibrilación/aleteo auricular y taquicardia por reentrada intraauricular pueden ocurrir después de la reparación de tetralogía. Con taquicardia de complejo ancho, es probable que el ECG muestre patrones de bloqueo de rama derecha o bloqueo de rama izquierda. Los pacientes a los que se les ha reparado el corazón pueden experimentar muerte cardíaca súbita. Los factores de riesgo para los ritmos cardíacos anormales incluyen:
- Edad (reparación)
- Género masculino
- Bloque cardíaco completo transitorio más allá del día postoperatorio tres
- QRS duración superior a 180 milisegundos
Largo plazo
Los pacientes adultos con cardiopatías congénitas están aumentando a un ritmo de alrededor del 5 % por año, superando a la población pediátrica. La sobrecarga de volumen del ventrículo derecho por insuficiencia pulmonar, el aneurisma del ventrículo derecho por el parche de salida o la ventriculotomía, la obstrucción de la arteria pulmonar distal, la hipertrofia ventricular, el agrandamiento de la cámara, la disfunción biventricular y la dilatación e insuficiencia de la raíz aórtica son complicaciones a largo plazo que se observan en estos pacientes. La arritmia, la insuficiencia cardíaca y las complicaciones de las reoperaciones son las tres causas principales de muerte en personas con tetralogía de Fallot corregida. La duración del QRS superior a 180 milisegundos, la edad avanzada en la reparación (más de tres años), la insuficiencia valvular pulmonar o tricúspide significativa, los antecedentes de síncope, las contracciones ventriculares prematuras multifocales y la taquicardia ventricular son algunos de los factores asociados con la muerte súbita después de los 30 años. de procedimiento. La insuficiencia pulmonar es la razón más común para la reintervención y los criterios de reemplazo de la válvula pulmonar se han basado tradicionalmente en la gravedad de la fracción regurgitante en una resonancia magnética o una tomografía computarizada. Los índices de volumen telesistólico y telediastólico del ventrículo derecho e izquierdo, las fracciones de eyección y la existencia de aneurisma generador de flujo obstructivo son parámetros observados en esta investigación. La intolerancia al ejercicio, los signos y síntomas de insuficiencia cardíaca, el síncope y la taquicardia ventricular prolongada son todos síntomas posibles. También se puede usar un método de válvula pulmonar transcatéter para reemplazar una válvula pulmonar.
Embarazo
En comparación con la población obstétrica general, las mujeres a las que se les reparó completamente la tetralogía de Fallot tienen resultados similares. El grado de regurgitación pulmonar con disfunción ventricular derecha o izquierda, así como el nivel de hipertensión pulmonar, están relacionados con un mayor riesgo de complicaciones en el embarazo. La muerte fetal es más probable en mujeres que tienen hipertensión ventricular derecha moderada o que se han sometido a una derivación paliativa. En comparación con el 0,8 % de la población general, los hijos de mujeres con tetralogía tienen una probabilidad del 3 al 5 % de desarrollar una cardiopatía congénita. Si la deleción 22q11 está presente, existe un 50 % de posibilidades de transferir el cromosoma dañado, con un alto riesgo de anomalía cardíaca congénita.
Pronóstico
La tetralogía de Fallot sin tratamiento provoca rápidamente una hipertrofia progresiva del ventrículo derecho debido al aumento de la resistencia causado por el estrechamiento del tronco pulmonar. Esto progresa a insuficiencia cardíaca que comienza en el ventrículo derecho y, a menudo, conduce a insuficiencia cardíaca izquierda y miocardiopatía dilatada. La tasa de mortalidad depende de la gravedad de la tetralogía de Fallot. Si no se trata, TOF conlleva una tasa de mortalidad del 35% en el primer año de vida y una tasa de mortalidad del 50% en los primeros tres años de vida. Los pacientes con TOF no tratados rara vez progresan a la edad adulta.
Los pacientes que se han sometido a una reparación quirúrgica total de la tetralogía de Fallot han mejorado la hemodinámica y, a menudo, tienen una función cardíaca de buena a excelente después de la operación con alguna o ninguna intolerancia al ejercicio (Clase I-II de la New York Heart Association). El resultado a largo plazo suele ser excelente para la mayoría de los pacientes; sin embargo, los defectos posquirúrgicos residuales como la regurgitación pulmonar, la estenosis de la arteria pulmonar, la comunicación interventricular residual, la disfunción del ventrículo derecho y la obstrucción del tracto de salida del ventrículo derecho pueden afectar la esperanza de vida y aumentar la necesidad de una nueva operación.
Las complicaciones cardiovasculares y cerebrovasculares en pacientes con cardiopatía coronaria reparada, como TOF, ocurren antes en la vida en comparación con sujetos sanos. También son comunes la regurgitación pulmonar crónica y la dilatación y disfunción del ventrículo derecho.
Dentro de los 30 años posteriores a la corrección, el 50 % de los pacientes requerirán una nueva operación. La causa más común de reoperación es una válvula pulmonar con fugas (insuficiencia de la válvula pulmonar). Esto generalmente se corrige con un procedimiento llamado reemplazo de válvula pulmonar.
Un factor pronóstico común con TOF es el desarrollo de lesión por reperfusión de isquemia. La protección miocárdica insuficiente se considera una de las principales causas de muerte en la corrección de la TOF.
Comorbilidades
Hay muchas condiciones comórbidas que pueden ocurrir con TOF que pueden exacerbar la condición. A menudo, TOF puede presentarse con bajo peso al nacer y prematuridad. En ambos casos, se observó un aumento de la mortalidad y la morbilidad. También se observaron diferencias en la mecánica auricular y ventricular derecha y rigidez hepática en adultos con TOF reparado, así como atresia pulmonar y estenosis pulmonar persistente. En pacientes con atresia pulmonar, hay una falla completa del flujo directo desde el ventrículo derecho a la vasculatura arterial pulmonar. Como tal, el flujo sanguíneo pulmonar depende por completo de la derivación de la circulación sistémica, típicamente a través de un conducto arterioso permeable. La fisiopatología de TOF junto con el arterioso pulmonar se atribuye únicamente a defectos de las arterias pulmonares. Incluso después de la atención quirúrgica, estos pacientes siguen teniendo un mayor riesgo de estenosis arterial pulmonar e hipertensión pulmonar.
También se observó que la enfermedad de Danon, que es un trastorno genético raro, complica la TOF. En particular, alargamiento del complejo QRS y acortamiento del intervalo PR. Las anomalías genéticas que se encuentran en TOF pueden conducir a un diagnóstico más temprano de la enfermedad de Danon, lo que ayuda a mejorar los resultados pronósticos.
Epidemiología
Se estima que la prevalencia de la tetralogía de Fallot es de 0,02 a 0,04 %, lo que corresponde a aproximadamente 200 a 400 casos por millón de nacidos vivos. Representa del 7 al 10% de todas las anomalías cardíacas congénitas, lo que lo convierte en el defecto cardíaco cianótico más común. Aunque inicialmente se creía que los hombres y las mujeres se veían afectados por igual, estudios más recientes han demostrado que TOF afecta más a los hombres que a las mujeres. Aproximadamente 1 de cada 100 recién nacidos es diagnosticado con un defecto cardíaco congénito, de los cuales el 10% son diagnosticados con TOF. Genéticamente, se asocia más comúnmente con el síndrome de Down y el síndrome de DiGeorge. Se sabe que el síndrome de Down y otros trastornos cromosómicos ocurren junto con defectos cardíacos congénitos como TOF.
Historia
La tetralogía de Fallot fue descrita inicialmente en 1671 por el investigador danés Niels Steensen. También conocido como Nicolaus Steno en latín, Stensen fue un pionero en anatomía y geología. Su trabajo hizo contribuciones significativas al campo de la anatomía y patología cardíaca, lo que llevó a que la condición se titulara inicialmente como tetralogía de Steno-Fallot. Una descripción adicional fue publicada en 1888 por el médico francés Étienne-Louis Arthur Fallot, de quien finalmente recibió su nombre. En 1924, Maude Elizabeth Seymour Abbott, cardióloga pediátrica de Montreal, Canadá, la denominó tetralogía de Fallot.
El breve artículo "Disección de un feto monstruoso en París" en 1671 describió por primera vez las condiciones que más tarde se conocerían juntas como TOF. En particular, destacó la formación inusual de arterias, la estenosis de la arteria pulmonar, la ausencia del conducto arterioso, una aorta anulada y circulación cardíaca fetal donde la sangre se redirigía a la aorta desde la arteria pulmonar. Más de cien años después, en 1777, el médico holandés Eduard Sandifort informó de lo que él denominó "el niño azul" paciente. Inicialmente se pensó que este paciente, que tenía 16 meses de edad, tenía asma, aunque una autopsia post mortem reveló una malformación cardíaca sin conducto arterioso ni ligamento arterioso, lo que indica que el niño pudo haber muerto por TOF. El médico escocés William Hunter informó sobre otro paciente de 13 años en 1782. Hunter describió que el paciente, junto con otros tres, padecía cianosis después de un examen póstumo en 1774.
Otros casos, como los presentados por Pulteney (1785), Abernethy (1793), Bell (1797), Dorsey (1812) y Farre (1814) también contribuyeron a la comprensión moderna de TOF. El primer caso informado de TOF fue en Estados Unidos en la Universidad de Pensilvania en 1816, con más casos informados por Peacock (1858 y 1869), Widman (1881) y finalmente Fallot (1888), de quien se nombra la condición. Fallot fue el primero en describir con elegancia las cuatro características clave que lo diferencian de otras afecciones cardíacas cianóticas, y se destacó en la descalificación del foramen oval permeable como quinta característica. Fallot inicialmente se refirió a ella como "La maladie bleue", que en francés significa "la enfermedad azul" o "cyanose cardiaque", que se traduce como "cianosis cardíaca".
La primera reparación quirúrgica se llevó a cabo en 1944 en Johns Hopkins. El procedimiento fue realizado por el cirujano Alfred Blalock y la cardióloga Helen B. Taussig, y Vivien Thomas también realizó contribuciones sustanciales y figura como asistente. Esta primera cirugía se representó en la película Algo que hizo el Señor. En realidad, fue Helen Taussig quien convenció a Alfred Blalock de que la derivación iba a funcionar. Eileen Saxon, de 15 meses, fue la primera persona en recibir una derivación Blalock-Thomas-Taussig. Además, el procedimiento de Blalock-Thomas-Taussig, inicialmente el único tratamiento quirúrgico disponible para la tetralogía de Fallot, fue paliativo pero no curativo. La primera reparación total de la tetralogía de Fallot fue realizada por un equipo dirigido por C. Walton Lillehei en la Universidad de Minnesota en 1954 en un niño de 11 años. La reparación total en bebés ha tenido éxito desde 1981, y las investigaciones indican que tiene una tasa de mortalidad comparativamente baja. Hoy en día, la población de TOF en adultos continúa creciendo y es uno de los defectos cardíacos congénitos más comunes que se observan en las clínicas ambulatorias para adultos.
Trastornos relacionados
Las siguientes enfermedades tienen síntomas comparables a la tetralogía de Fallot. Para un diagnóstico diferencial, las comparaciones entre estos trastornos proporcionan un conocimiento valioso.
Defectos del tabique interauricular
Los defectos del tabique auricular (CIA) son un tipo de anomalía cardíaca congénita en la que existe una pequeña abertura entre las dos aurículas del corazón. La carga sobre el lado derecho del corazón aumenta como resultado de estas anomalías, al igual que el flujo de sangre a los pulmones. Esto conduce a un flujo de sangre excesivo a los pulmones y una mayor carga de trabajo en el lado derecho del corazón. Otro hallazgo común asociado con los ASD es la hipertrofia ventricular derecha, también conocida como agrandamiento del ventrículo derecho.
Defectos del tabique ventricular
Los defectos del tabique ventricular (CIV) son un tipo de anomalía cardíaca congénita en la que falta uno de los ventrículos. Dos aurículas y un ventrículo grande son comunes en bebés con anomalías congénitas. Los síntomas de estas enfermedades incluyen una frecuencia respiratoria inusualmente alta (taquipnea), un tono azulado en la piel (cianosis), sibilancias, latidos cardíacos rápidos (taquicardia) y/o agrandamiento anormal del hígado, que son similares a los de otras enfermedades congénitas. problemas cardíacos (hepatomegalia). Los VSD también pueden provocar una acumulación de líquido alrededor del corazón, lo que puede provocar insuficiencia cardíaca congestiva.
Defecto del tabique auriculoventricular
El defecto del tabique atrioventricular (AVSD, por sus siglas en inglés) es una afección cardíaca congénita poco común que se caracteriza por un desarrollo defectuoso de los tabiques y las válvulas del corazón. La insuficiencia cardíaca congestiva es común en los bebés con la versión completa de la afección. El líquido se acumula en otras partes del cuerpo, particularmente en los pulmones. Las dificultades para respirar pueden resultar de la congestión pulmonar (disnea).
Estenosis de la válvula mitral
La estenosis de la válvula mitral es una anomalía cardíaca poco común que puede ocurrir al nacer (congénita) o desarrollarse más tarde en la vida (adquirida). El estrechamiento aberrante de la apertura de la válvula mitral caracteriza esta condición. Existen dos versiones de esta condición conocidas como congénita y adquirida caracterizadas por diferentes síntomas. Los síntomas de la estenosis congénita de la válvula mitral incluyen una amplia gama, como infecciones respiratorias, dificultad para respirar, palpitaciones y tos. Los síntomas de la estenosis de la válvula mitral adquirida también incluyen una amplia gama, como pérdida de conciencia, angina, debilidad general y molestias abdominales.
Casos destacados
- Shaun White, snowboarder profesional estadounidense y skateboarder
- Beau Casson, Australian cricketer
- Dennis McEldowney, autor de Nueva Zelanda y editor
- Max Page, el "Little Darth Vader" de Volkswagen del comercial Super Bowl 2011
- Billy Kimmel, el hijo del anfitrión del programa Jimmy Kimmel; el diagnóstico de Billy llevó a Kimmel a discutir el acceso a la atención médica en su programa ¡Jimmy Kimmel Live!