Tetrafluoruro de azufre
Tetrafluoruro de azufre es un compuesto químico con la fórmula SF4. Es un gas corrosivo incoloro que libera gas fluoruro de hidrógeno peligroso al exponerse al agua o la humedad. El tetraflururo de azufre es un reactivo útil para la preparación de compuestos organofluorados, algunos de los cuales son importantes en las industrias farmacéutica y química especializada.
Estructura
El azufre en el SF4 está en estado de oxidación +4, con un solo par de electrones. Los átomos del SF4 están dispuestos en forma de balancín, con el átomo de azufre en el centro. Una de las tres posiciones ecuatoriales está ocupada por un par de electrones solitarios no enlazantes. En consecuencia, la molécula tiene dos tipos distintos de ligandos F, dos axiales y dos ecuatoriales. Las distancias de enlace relevantes son S–Fax = 164,3 pm y S–Feq = 154,2 pm. Es típico que los ligandos axiales de las moléculas hipervalentes estén unidos con menos fuerza.
El espectro de RMN 19F del SF4 revela solo una señal, lo que indica que las posiciones axial y ecuatorial del átomo de F se interconvierten rápidamente mediante pseudorotación.

Sintesis y fabricación
A escala de laboratorio, el tetrafluoruro de azufre se prepara a partir de azufre elemental y fluoruro cobáltico.
- S + 4CoF3 → SF4 + 4CoF2
SF4 se produce industrialmente mediante la reacción de SCl2 y NaF con acetonitrilo como catalizador.
- 3 SCl2 + 4 NaF → SF4 + S2Cl2 + 4 NaCl
A temperaturas más altas (por ejemplo, 225–450 °C), el disolvente es superfluo. Además, el dicloruro de azufre puede sustituirse por azufre elemental (S) y cloro (Cl2).
Una alternativa de baja temperatura (por ejemplo, 20 a 86 °C) al proceso clorante anterior utiliza bromo líquido (Br2) como oxidante y disolvente:
- S(s) + 2 Br2(l; exceso) + 4KF(s) → SF4↑ + 4 KBr(brom)
Uso en síntesis de compuestos organofluorinos
En síntesis orgánica, SF4 se utiliza para convertir grupos COH y C=O en grupos CF y CF2, respectivamente. La eficiencia de estas conversiones es muy variable.
En el laboratorio, el uso de SF4 ha sido reemplazado por el trifluoruro de dietilaminosulfuro, más seguro y fácil de manejar, (C2H5)2NSF3, "DAST": Este reactivo se prepara a partir de SF4:
- SF4 + (CH)3)3SiN(C)2H5)2 → (C2H5)2NSF3 + (CH)3)3SiF
Otras reacciones
Pentafluoruro de cloruro de azufre (SF
5Cl), un útil fuente del grupo SF5, se prepara a partir de SF4.
- SF4 + Cl2 + CsF → SF5Cl + CsCl
La hidrólisis del SF4 da dióxido de azufre:
- SF4 + 2 H2O → SO2 + 4 HF
Esta reacción se produce a través de la intermediación del fluoruro de tionilo, que generalmente no interfiere con el uso de SF4 como reactivo.
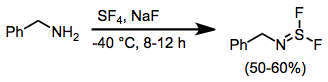
Cuando las aminas se tratan con SF4 y una base, se obtienen difluoruros de aminoazufre.
Toxicity
SF
4 reacciona dentro de los pulmones con la humedad, formando azufre dióxido y fluoruro de hidrógeno que forma ácido fluorhídrico altamente tóxico y corrosivo
Referencias
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0580". National Institute for Occupational Safety and Health (NIOSH).
- ^ Tolles, W. M.; W. M. Gwinn, W. D. (1962). "Structure y Dipole Moment for SF4". J. Chem. Phys. 36 (5): 1119–1121. Bibcode:1962JChPh..36.1119T doi:10.1063/1.1732702.
- ^ Wang, C.-L. J. (2004). "Tetrafluoruro de Shufur". En Paquette, L. (ed.). Enciclopedia de Reagentes para la Síntesis Orgánica. Nueva York: J. Wiley & Sons. doi:10.1002/047084289X. hdl:10261/236866. ISBN 9780471936237.
- ^ Holleman, A. F.; Wiberg, E. (2001). Química Inorgánica. San Diego: Prensa Académica. ISBN 0-12-352651-5.
- ^ Kwasnik, W. (1963). "Compuestos fluorinos: tetrafluoruro de azufre". En Brauer, Georg (ed.). Manual de Química Inorgánica Preparativa. Vol. 1. Traducido por Riley, Reed F. (2a ed.). NY, NY: Academic Press. p. 168. LCCN 63-14307 – via the Internet Archive.
- ^ a b Fawcett, F. S.; Tullock, C. W. (1963). "Sulfur(IV) Fluoride" (PDF). Síntesis inorgánica. Vol. 7. pp. 119–124. doi:10.1002/9780470132388.ch33. ISBN 978-0-470-13166-4.
- ^ Tullock, C. W.; Fawcett, F. S.; Smith, W. C.; Coffman, D. D. (1960). "La química del tetrafluoruro de azufre. I. La síntesis del tetrafluoruro de azufre". J. Am. Chem. Soc. 82 (3): 539-542. doi:10.1021/ja01488a011.
- ^ US 2992073, Tullock, C.W., "Synthesis of Sulfur Tetrafluoride", publicado 1961
- ^ Winter, R.W.; Cook P.W. (2010). "Un SF simplificado y eficiente4- método de preparación". J. Fluorine Chem. 131: 780-783. doi:10.1016/j.jfluchem.2010.03.016
- ^ Hasek, W. R. (1961). "1,1-Trifluoroheptane". Sintetías orgánicas. 41: 104. doi:10.15227/orgsyn.041.0104.
- ^ Fauq, A. H. (2004). "N,N- Trifluoruro Diethylaminosulfur". En Paquette, L. (ed.). Enciclopedia de Reagentes para la Síntesis Orgánica. Nueva York: J. Wiley & Sons. doi:10.1002/047084289X. hdl:10261/236866. ISBN 9780471936237..
- ^ W. J. Middleton; E. M. Bingham (1977). "Diethylaminosulfur Trifluoride". Sintetías orgánicas. 57: 440. doi:10.15227/orgsyn.057.0050.
- ^ Nyman, F.; Roberts, H. L.; Seaton, T. (1966). "Sulfur Chloride Pentafluoride" (PDF). Síntesis inorgánica. Vol. 8. McGraw-Hill. p. 160. doi:10.1002/9780470132395.ch42 ISBN 9780470132395.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Química de los elementos (2a edición). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Grunwell, John R.; Dye, Sandra L. (1975). "Nueva generación de benzonitrile-N-sulfide". Cartas de Tetraedro. 16 (21): 1739–1740. doi:10.1016/s0040-4039(00)72247-7. ISSN 0040-4039.
- ^ Johnston, H. (2003). Un puente no atacado: investigación civil de guerra química durante la Segunda Guerra Mundial. World Scientific. pp. 33–36. ISBN 981-238-153-8.