Terpeno
Los terpenos () son una clase de productos naturales que consisten en compuestos con la fórmula (C5H8)n para n ≥ 2. Compuestos por más de 30.000 compuestos, estos hidrocarburos insaturados son producidos predominantemente por plantas, particularmente coníferas. Los terpenos se clasifican además por el número de carbonos: monoterpenos (C10), sesquiterpenos (C15), diterpenos (C20), como ejemplos El terpeno alfa-pineno es un componente principal del solvente común, la trementina.
Historia y terminología
El término terpeno fue acuñado en 1866 por el químico alemán August Kekulé para designar todos los hidrocarburos que tienen la fórmula empírica C10H16, de los cuales el canfeno era uno. Anteriormente, muchos hidrocarburos que tenían la fórmula empírica C10H16 se llamaban "canfeno", pero muchos otros hidrocarburos de la misma composición tenían nombres diferentes. Kekulé acuñó el término "terpeno" para reducir la confusión. El nombre "terpeno" es una forma abreviada de "terpentina", una ortografía obsoleta de "trementina".
Aunque a veces se usan indistintamente con "terpenos", los terpenoides (o isoprenoides) son terpenos modificados que contienen grupos funcionales adicionales, generalmente oxígeno. Sin embargo, los términos terpenos y terpenoides a menudo se usan indistintamente. Además, los terpenos se producen a partir de terpenoides y muchos terpenoides se producen a partir de terpenos. Ambos tienen olores fuertes y, a menudo, agradables, que pueden proteger a sus anfitriones o atraer a los polinizadores. El número de terpenos y terpenoides se estima en 55.000 entidades químicas.
El Premio Nobel de Química de 1939 fue otorgado a Leopold Ružička "por su trabajo sobre polimetilenos y terpenos superiores", "incluida la primera síntesis química de hormonas sexuales masculinas".
Función biológica
Los terpenos son los principales componentes biosintéticos. Los esteroides, por ejemplo, son derivados del triterpeno escualeno. Los terpenos y los terpenoides también son los componentes principales de los aceites esenciales de muchos tipos de plantas y flores. En las plantas, los terpenos y los terpenoides son mediadores importantes de las interacciones ecológicas. Por ejemplo, desempeñan un papel en la defensa de las plantas contra la herbivoría, la resistencia a las enfermedades, la atracción de mutualistas como los polinizadores, así como la comunicación potencial entre plantas. Parecen desempeñar papeles como antialimentadores. Otras funciones de los terpenoides incluyen la modulación del crecimiento celular y el alargamiento de la planta, la captación de luz y la fotoprotección, y el control de la permeabilidad y la fluidez de la membrana.
Los árboles liberan mayores cantidades de terpenos en climas más cálidos, donde pueden funcionar como un mecanismo natural de siembra de nubes. Las nubes reflejan la luz del sol, permitiendo que la temperatura del bosque se regule.
Algunos insectos utilizan algunos terpenos como forma de defensa. Por ejemplo, las termitas de la subfamilia Nasutitermitinae ahuyentan a los insectos depredadores mediante el uso de un mecanismo especializado llamado pistola fontanelar, que expulsa una mezcla resinosa de terpenos.
Aplicaciones
El único terpeno que tiene aplicaciones importantes es el caucho natural (es decir, poliisopreno). Se ha investigado la posibilidad de que otros terpenos puedan usarse como precursores para producir polímeros sintéticos como alternativa al uso de materias primas a base de petróleo. Sin embargo, pocas de estas aplicaciones se han comercializado. Sin embargo, muchos otros terpenos tienen aplicaciones comerciales e industriales a menor escala. Por ejemplo, la trementina, una mezcla de terpenos (por ejemplo, pineno), obtenida de la destilación de resina de pino, se utiliza como disolvente orgánico y como materia prima química (principalmente para la producción de otros terpenoides). La colofonia, otro subproducto de la resina de árboles de coníferas, se usa ampliamente como ingrediente en una variedad de productos industriales, como tintas, barnices y adhesivos. Los violinistas (y los que tocan instrumentos de arco similares) también utilizan la colofonia para aumentar la fricción en el pelo del arco. Los terpenos se utilizan ampliamente como fragancias y sabores en productos de consumo como perfumes, cosméticos y productos de limpieza, así como en alimentos y bebidas. Por ejemplo, el aroma y sabor del lúpulo proviene, en parte, de los sesquiterpenos (principalmente α-humuleno y β-cariofileno), que afectan la calidad de la cerveza. Algunos forman hidroperóxidos que se valoran como catalizadores en la producción de polímeros.
Se ha demostrado que muchos terpenos tienen efectos farmacológicos, aunque la mayoría de los estudios son de investigación de laboratorio y la investigación clínica en humanos es preliminar. Los terpenos también son componentes de algunas medicinas tradicionales, como la aromaterapia.
Como reflejo de su papel defensivo en las plantas, los terpenos se utilizan como ingredientes activos de pesticidas en la agricultura.
Propiedades físicas y químicas
Los terpenos son incoloros, aunque las muestras impuras suelen ser amarillas. Escala de puntos de ebullición con tamaño molecular: terpenos, sesquiterpenos y diterpenos respectivamente a 110, 160 y 220 °C. Al ser altamente no polares, son insolubles en agua. Al ser hidrocarburos, son altamente inflamables y tienen una gravedad específica baja (flotan en el agua). Son aceites ligeros al tacto considerablemente menos viscosos que los aceites vegetales familiares como el aceite de maíz (28 cP), con una viscosidad que varía de 1 cP (al estilo agua) a 6 cP. Los terpenos son irritantes locales y pueden causar trastornos gastrointestinales si se ingieren.
Terpenoides (mono-, sesqui-, di-, etc.) tienen propiedades físicas similares pero tienden a ser más polares y, por lo tanto, ligeramente más solubles en agua y algo menos volátiles que sus análogos terpenos. Los derivados altamente polares de los terpenoides son los glucósidos, que están ligados a los azúcares. Estos son sólidos solubles en agua.
Biosíntesis
Isopreno como bloque de construcción
Derivado conceptualmente de los isoprenos, las estructuras y fórmulas de los terpenos siguen la regla biogenética del isopreno o la regla C5, tal como se describe en 1953 por Leopold Ružička y colegas. Las unidades de isopreno C5 se proporcionan en forma de pirofosfato de dimetilalilo (DMAPP) y pirofosfato de isopentenilo (IPP). DMAPP e IPP son isómeros estructurales entre sí. Este par de bloques de construcción son producidos por dos rutas metabólicas distintas: la ruta del mevalonato (MVA) y la ruta del no mevalonato (MEP). Estas dos vías son mutuamente excluyentes en la mayoría de los organismos, a excepción de algunas bacterias y plantas terrestres. En general, la mayoría de las arqueas y eucariotas utilizan la vía MVA, mientras que las bacterias utilizan principalmente la vía MEP. IPP y DMAPP son productos finales de las vías MVA y MEP y la abundancia relativa de estas dos unidades de isopreno está regulada enzimáticamente en los organismos huéspedes.
| Organismo | Senderos |
|---|---|
| Bacterias | MVA o MEP |
| Archaea | MVA |
| Green Algae | MEP |
| Plantas | MVA y MEP |
| Animales | MVA |
| Fungi | MVA |
Vía del mevalonato
Esta vía conjuga tres moléculas de acetil CoA.
La vía del mevalonato (MVA) se distribuye en los tres dominios de la vida; arqueas, bacterias y eucariotas. La vía MVA se distribuye universalmente en arqueas y eucariotas no fotosintéticos, mientras que la vía es escasa en bacterias. En los eucariotas fotosintéticos, algunas especies poseen la vía MVA, mientras que otras tienen la vía MEP o ambas vías, MVA y MEP. Esto se debe a la adquisición de la vía MEP por un ancestro común de Archaeplastida (algas + plantas terrestres) a través de la endosimbiosis de cianobacterias ancestrales que poseían la vía MEP. Las vías MVA y MEP se perdieron selectivamente en linajes fotosintéticos individuales.
Además, la vía de MVA de las arqueas no es completamente homóloga a la vía de MVA de los eucariotas. En cambio, la vía de MVA eucariótica está más cerca de la vía de MVA bacteriana.
Vía no mevalonato
La ruta del no mevalonato o la ruta del 2-C-metil-D-eritritol 4-fosfato (MEP) comienza con piruvato y gliceraldehído 3-fosfato (G3P) como fuente de carbono.
C5 IPP y C5 DMAPP son los productos finales en cualquiera de las vías y son los precursores de terpenoides con varios números de carbono (típicamente C5 a C40), cadenas laterales de (bacterio)clorofilas, hemos y quinonas. La síntesis de todos los terpenoides superiores se produce a través de la formación de pirofosfato de geranilo (GPP), pirofosfato de farnesilo (FPP) y pirofosfato de geranilgeranilo (GGPP).
Fase de pirofosfato de geranilo y posteriores
En las vías de MVA y MEP, la IPP se isomeriza a DMAPP por la enzima isopentenil pirofosfato isomerasa. IPP y DMAPP se condensan para dar pirofosfato de geranilo, el precursor de los monoterpenos y monoterpenoides.
El pirofosfato de geranilo también se convierte en pirofosfato de farnesilo y pirofosfato de geranilgeranilo, precursores C15 y C20 respectivamente de sesquiterpenos y diterpenos (así como sesequiterpenoides y diterpenoides). La biosíntesis está mediada por la terpeno sintasa.
De terpenos a terpenoides
Los genomas de muchas especies de plantas contienen genes que codifican enzimas terpenoides sintasa que confieren a los terpenos su estructura básica y citocromos P450 que modifican esta estructura básica.
Estructura
Los terpenos se pueden visualizar como el resultado de unir unidades de isopreno (C5H8) "de la cabeza a la cola" para formar cadenas y anillos. Algunos terpenos están vinculados "cola a cola", y los terpenos ramificados más grandes pueden estar vinculados "cola a mitad".
Fórmula
Estrictamente hablando, todos los monoterpenos tienen la misma fórmula química C10H16. De manera similar, todos los sesquiterpenos y diterpenos tienen fórmulas de C15H24 y C20H32 respectivamente. La diversidad estructural de mono, sesqui y diterpenos es una consecuencia de la isomería.
Quiralidad
Los terpenos y los terpenoides suelen ser quirales. Los compuestos quirales pueden existir como imágenes especulares no superponibles, que exhiben propiedades físicas distintas, como olor o toxicidad.
- Insaturación
La mayoría de los terpenos y terpenoides presentan grupos C=C, es decir, presentan insaturación. Dado que no tienen grupos funcionales aparte de su insaturación, los terpenos son estructuralmente distintivos. La insaturación está asociada con alquenos di- y trisustituidos. Los alquenos disustituidos y trisustituidos resisten la polimerización (temperaturas de techo bajas) pero son susceptibles a la formación de carbocationes inducida por ácidos.
Clasificación
- Patrones seleccionados
Los terpenos se pueden clasificar por el número de unidades de isopreno en la molécula; un prefijo en el nombre indica el número de pares de isopreno necesarios para ensamblar la molécula. Comúnmente, los terpenos contienen 2, 3, 4 o 6 unidades de isopreno; los tetraterpenos (8 unidades de isopreno) forman una clase separada de compuestos llamados carotenoides; los otros son raros.
- La unidad básica isoprena en sí no se considera un terpene, pero puede formar derivados que contienen oxígeno como el prenol y el ácido isovaleric análogo a los terpenoides.
- Monoterpenes consisten en 2 isoprene unidades y tienen la fórmula molecular C10H16. Ejemplos de monoterpenes y monoterpenoides incluyen geraniol, terpineol (presente en lila), limonena (presente en cítricos), mircena (presente en hops), linalool (presente en lavanda), hinokitiol (presente en cipreses) o pinos (presente en pinos). Los iridosides provienen de monoterpenes. Ejemplos de iridoides incluyen aucubina y catalpol.
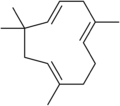
- Sesquiterpenes consiste de 3 isoprene unidades y tienen la fórmula molecular C15H24. Ejemplos de sesquiterpenoides y sesquiterpenoides incluyen humulene, farnesenes, farnesol, geosmin. (El sesqui- prefijo significa uno y medio.)
- Diterpenes se componen de 4 isoprene unidades y tienen la fórmula molecular C20H32. Se derivan de geranilgeranil pirofosfato. Ejemplos de diterpenes y diterpenoides son caféstol, kahweol, cembrene y taxadieno (precursor de taxol). Los diterpenes también forman la base para compuestos biológicamente importantes como retinol, retina y fito.
- Sesterterpenes, terpenes con 25 carbonos y 5 isoprene unidades, son raras en relación con los otros tamaños. (El Sester- prefijo significa dos y medio.) Un ejemplo de un sesterterpenoide es geranylfarnesol.
- Triterpenes consisten en 6 isoprene unidades y tienen la fórmula molecular C30H48. El escualene lineal triterpene, el principal componente del aceite de hígado de tiburón, se deriva del acoplamiento reductivo de dos moléculas de pirofosfato de farnesilo. El escualeno se procesa biosintéticamente para generar lanosterol o cicloartenol, los precursores estructurales a todos los esteroides.
- Sesquarterpenes se componen de 7 isoprene unidades y tienen la fórmula molecular C35H56. Los sesquarterpenes son típicamente microbianas en su origen. Ejemplos de sesquarterpenoides son ferrugicadiol y tetraprenylcurcumene.
- Los tetraterpenos contienen 8 isoprene unidades y tienen la fórmula molecular C40H64. Los tetraterpenoides de importancia biológica incluyen el licopeno acíclico, el gammacaroteno monocíclico y el alfa bicíclico y betacarotenos.
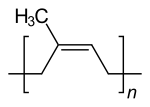
- Polyterpenes consisten en cadenas largas de muchos isoprene unidades. El caucho natural consiste en poliisopreno en el que los dobles lazos son cis. Algunas plantas producen un poliisopreno con trans dobles lazos, conocidos como gutta-percha.
- Norisoprenoides, caracterizados por el acortamiento de una cadena o anillo mediante la eliminación de un grupo de metileno o la sustitución de una o más cadenas laterales de metilmeto por átomos de hidrógeno. Estos incluyen el C13-norisoprenoide 3-oxo-α-ionol presente en Muscat de hojas de Alejandría y derivaciones 7,8-dihidroionona, tales como megastigmane-3,9-diol y 3-oxo-7,8-dihidro-α-ionol encontrado en hojas de Shiraz (tanto uvas en la especie Vitis vinifera) o vino (responsable para algunas de las notas de especias en Chardonnay), puede ser producido por peróxidos fúngicos o glicosidasas.
Síntesis industriales
Si bien los terpenos y los terpenoides se encuentran ampliamente, su extracción de fuentes naturales suele ser problemática. En consecuencia, se producen por síntesis química, generalmente a partir de productos petroquímicos. En una ruta, la acetona y el acetileno se condensan para dar 2-metilbut-3-in-2-ol, que se extiende con éster acetoacético para dar alcohol geranílico. Otros se preparan a partir de terpenos y terpenoides que se aíslan fácilmente en cantidad, por ejemplo, de las industrias del papel y del aceite de resina. Por ejemplo, el α-pineno, que se obtiene fácilmente de fuentes naturales, se convierte en citronelal y alcanfor. El citronelal también se convierte en óxido de rosa y mentol.