Termogenina
termogenina (llamada proteína desacopladora por sus descubridores y ahora conocida como proteína desacopladora 1, o UCP1) es una proteína transportadora mitocondrial que se encuentra en el tejido adiposo pardo (BAT). Se utiliza para generar calor mediante termogénesis sin escalofríos y contribuye de manera cuantitativa importante a contrarrestar la pérdida de calor en los bebés, que de otro modo se produciría debido a su alta relación superficie-volumen.
Mecanismo
UCP1 pertenece a la familia UCP que son proteínas transmembrana que disminuyen el gradiente de protones generado en la fosforilación oxidativa. Lo hacen aumentando la permeabilidad de la membrana mitocondrial interna, permitiendo que los protones que han sido bombeados al espacio intermembrana regresen a la matriz mitocondrial. La generación de calor mediada por UCP1 en la grasa parda desacopla la cadena respiratoria, lo que permite una rápida oxidación del sustrato con una baja tasa de producción de ATP. UCP1 está relacionado con otros transportadores de metabolitos mitocondriales, como el translocador de nucleótidos de adenina, un canal de protones en la membrana interna mitocondrial que permite la translocación de protones desde el espacio intermembrana mitocondrial a la matriz mitocondrial. UCP1 está restringido al tejido adiposo marrón, donde proporciona un mecanismo para la enorme capacidad de generación de calor del tejido.
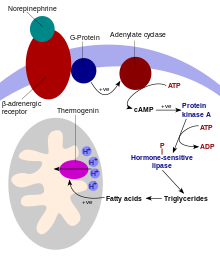
UCP1 se activa en las células de grasa parda mediante ácidos grasos y se inhibe mediante nucleótidos. Los ácidos grasos se liberan mediante la siguiente cascada de señalización: las terminales del sistema nervioso simpático liberan norepinefrina en un receptor adrenérgico Beta-3 en la membrana plasmática. Esto activa la adenilil ciclasa, que cataliza la conversión de ATP en AMP cíclico (AMPc). El AMPc activa la proteína quinasa A, lo que hace que sus subunidades C activas se liberen de sus subunidades R reguladoras. La proteína quinasa A activa, a su vez, fosforila la triacilglicerol lipasa, activándola así. La lipasa convierte los triacilgliceroles en ácidos grasos libres, que activan la UCP1, anulando la inhibición causada por los nucleótidos de purina (GDP y ADP). Durante la terminación de la termogénesis, la termogenina se inactiva y los ácidos grasos residuales se eliminan mediante oxidación, lo que permite que la célula reanude su estado normal de conservación de energía.

UCP1 es muy similar a la proteína portadora de ATP/ADP, o translocador de nucleótidos de adenina (ANT). El modelo de acceso alterno propuesto para UCP1 se basa en un mecanismo ANT similar. El sustrato llega a la proteína UCP1 medio abierta desde el lado citoplasmático de la membrana, la proteína cierra el lado citoplasmático para que el sustrato quede encerrado en la proteína y luego el lado de la matriz de la proteína se abre, permitiendo que el sustrato se libere. la matriz mitocondrial. La apertura y cierre de la proteína se logra tensando y aflojando los puentes salinos en la superficie de la membrana de la proteína. La justificación de este modelado de UCP1 en ANT se encuentra en los numerosos residuos conservados entre las dos proteínas que participan activamente en el transporte de sustrato a través de la membrana. Ambas proteínas son proteínas de membrana integral, localizadas en la membrana mitocondrial interna, y tienen un patrón similar de puentes salinos, residuos de prolina y aminoácidos hidrofóbicos o aromáticos que pueden cerrarse o abrirse cuando están en estado citoplasmático o de matriz.
Estructura

La estructura atómica de la proteína de desacoplamiento humana 1 UCP1 se ha resuelto mediante microscopía electrónica criogénica. La estructura tiene el pliegue típico de un miembro de la familia SLC25. UCP1 está bloqueado en un estado citoplasmático abierto por trifosfato de guanosina de manera dependiente del pH, lo que evita la fuga de protones.
Evolución
UCP1 se expresa en el tejido adiposo marrón, que funcionalmente se encuentra sólo en los euterios. El gen UCP1, o termogenina, probablemente surgió en un antepasado de los vertebrados modernos, pero inicialmente no permitió que nuestro antepasado vertebrado utilizara la termogénesis sin temblores para calentarse. No fue hasta que se seleccionó de forma adaptativa la generación de calor en los mamíferos placentarios descendientes de este ancestro común que UCP1 desarrolló su función actual en el tejido adiposo marrón para proporcionar calor adicional. Si bien UCP1 desempeña un papel termogénico clave en una amplia gama de mamíferos placentarios, particularmente aquellos con un tamaño corporal pequeño y aquellos que hibernan, el gen UCP1 ha perdido funcionalidad en varios linajes de cuerpos grandes (por ejemplo, caballos, elefantes, vacas marinas, ballenas y damanes) y linajes con tasas metabólicas bajas (por ejemplo, pangolines, armadillos, perezosos y osos hormigueros). Descubrimientos recientes de ortólogos de UCP1 que no generan calor en peces y marsupiales, otros descendientes del antepasado de los vertebrados modernos, muestran que este gen se transmitió a todos los vertebrados modernos, pero, aparte de los mamíferos placentarios, ninguno tiene capacidad de producir calor. Esto sugiere además que UCP1 tenía un propósito original diferente y, de hecho, los análisis filogenéticos y de secuencia indican que UCP1 es probablemente una forma mutada de una proteína portadora de dicarboxilato que se adaptó para la termogénesis en mamíferos placentarios.
Historia
En la década de 1960, los investigadores que investigaban el tejido adiposo marrón descubrieron que, además de producir más calor que el típico de otros tejidos, el tejido adiposo marrón parecía provocar un cortocircuito o desacoplar el acoplamiento de la respiración. La proteína desacopladora 1 fue descubierta en 1976 por David G. Nicholls, Vibeke Bernson y Gillian Heaton, y el descubrimiento se publicó en 1978 y demostró ser la proteína responsable de este efecto de desacoplamiento. Posteriormente, UCP1 se purificó por primera vez en 1980 y se clonó por primera vez en 1988.
La proteína desacopladora dos (UCP2), un homólogo de la UCP1, se identificó en 1997. La UCP2 se localiza en una amplia variedad de tejidos y se cree que participa en la regulación de las especies reactivas de oxígeno (ROS). En la última década, se identificaron tres homólogos adicionales de UCP1, incluidos UCP3, UCP4 y UCP5 (también conocido como BMCP1 o SLC25A14).
Relevancia clínica
Los métodos para administrar UCP1 a las células mediante terapia de transferencia genética o métodos para su regulación positiva han sido una importante línea de investigación en el tratamiento de la obesidad, debido a su capacidad para disipar el exceso de reservas metabólicas.
Contenido relacionado
Colfax (pueblo), Wisconsin
Soyuz 8
Trasplante