Terapia con anticuerpos monoclonales
Los anticuerpos monoclonales (mAb) tienen diversos usos terapéuticos. Es posible crear un mAb que se una específicamente a casi cualquier diana extracelular, como las proteínas de la superficie celular y las citocinas. Se pueden utilizar para hacer que su diana sea ineficaz (por ejemplo, impidiendo la unión al receptor), para inducir una señal celular específica (activando los receptores), para hacer que el sistema inmunitario ataque células específicas o para llevar un fármaco a un tipo de célula específico (como con la radioinmunoterapia, que administra radiación citotóxica).
Entre las principales aplicaciones se incluyen el cáncer, las enfermedades autoinmunes, el asma, los trasplantes de órganos, la prevención de coágulos sanguíneos y ciertas infecciones.
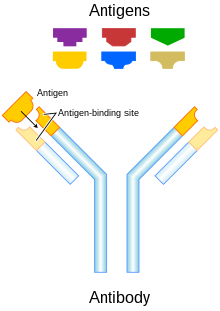
Estructura y función del anticuerpo
Los anticuerpos de inmunoglobulina G (IgG) son moléculas heterodímeras grandes, de aproximadamente 150 kDa, que se componen de dos tipos de cadenas polipeptídicas, llamadas cadena pesada (~50 kDa) y cadena ligera (~25 kDa). Los dos tipos de cadenas ligeras son kappa (κ) y lambda (λ). Mediante la escisión con la enzima papaína, la parte Fab (unión al antígeno del fragmento) se puede separar de la parte Fc (región cristalizable del fragmento) de la molécula. Los fragmentos Fab contienen los dominios variables, que consisten en tres dominios de aminoácidos hipervariables del anticuerpo responsables de la especificidad del anticuerpo incrustados en regiones constantes. Las cuatro subclases conocidas de IgG están involucradas en la citotoxicidad celular dependiente de anticuerpos. Los anticuerpos son un componente clave de la respuesta inmunitaria adaptativa, y desempeñan un papel central tanto en el reconocimiento de antígenos extraños como en la estimulación de una respuesta inmunitaria a ellos. La aparición de la tecnología de los anticuerpos monoclonales ha hecho posible la generación de anticuerpos contra antígenos específicos presentes en las superficies de los tumores. Los anticuerpos monoclonales pueden adquirirse en el sistema inmunológico a través de la inmunidad pasiva o la inmunidad activa. La ventaja de la terapia con anticuerpos monoclonales activos es el hecho de que el sistema inmunológico producirá anticuerpos a largo plazo, y solo una administración de fármacos a corto plazo para inducir esta respuesta. Sin embargo, la respuesta inmunitaria a ciertos antígenos puede ser inadecuada, especialmente en los ancianos. Además, pueden producirse reacciones adversas a estos anticuerpos debido a la respuesta duradera a los antígenos. La terapia con anticuerpos monoclonales pasivos puede garantizar una concentración constante de anticuerpos y puede controlar las reacciones adversas al detener la administración. Sin embargo, la administración repetida y el consiguiente mayor costo de esta terapia son desventajas importantes.
La terapia con anticuerpos monoclonales puede resultar beneficiosa en el caso del cáncer, las enfermedades autoinmunes y los trastornos neurológicos que provocan la degeneración de las células del organismo, como la enfermedad de Alzheimer. La terapia con anticuerpos monoclonales puede ayudar al sistema inmunológico porque el sistema inmunológico innato responde a los factores ambientales que encuentra discriminando entre células extrañas y células del organismo. Por lo tanto, las células tumorales que proliferan a un ritmo elevado o las células del organismo que mueren y que posteriormente causan problemas fisiológicos generalmente no son el objetivo específico del sistema inmunológico, ya que las células tumorales son las propias células del paciente. Sin embargo, las células tumorales son muy anormales y muchas muestran antígenos inusuales. Algunos de estos antígenos tumorales son inadecuados para el tipo de célula o su entorno. Los anticuerpos monoclonales pueden dirigirse a células tumorales o células anormales del organismo que se reconocen como células del organismo, pero que son debilitantes para la salud.
Historia

La inmunoterapia se desarrolló en la década de 1970 tras el descubrimiento de la estructura de los anticuerpos y el desarrollo de la tecnología de hibridomas, que proporcionó la primera fuente fiable de anticuerpos monoclonales. Estos avances permitieron la focalización específica de los tumores tanto in vitro como in vivo. Las investigaciones iniciales sobre neoplasias malignas demostraron que la terapia con mAb tenía un éxito limitado y, por lo general, de corta duración en el tratamiento de las neoplasias malignas de la sangre. Además, el tratamiento debía adaptarse a cada paciente, lo que era impracticable en los entornos clínicos habituales.
Se han desarrollado cuatro tipos principales de anticuerpos: murinos, quiméricos, humanizados y humanos. Los anticuerpos de cada tipo se distinguen por sufijos en su nombre.
Murine
Los anticuerpos terapéuticos iniciales eran análogos murinos (sufijo -omab). Estos anticuerpos tienen: una vida media corta in vivo (debido a la formación de complejos inmunes), una penetración limitada en los sitios tumorales y un reclutamiento inadecuado de las funciones efectoras del huésped. Los anticuerpos quiméricos y humanizados generalmente los han reemplazado en aplicaciones de anticuerpos terapéuticos. La comprensión de la proteómica ha demostrado ser esencial para identificar nuevos objetivos tumorales.
Inicialmente, los anticuerpos murinos se obtuvieron mediante la tecnología de hibridoma, por la que Jerne, Köhler y Milstein recibieron un premio Nobel. Sin embargo, la disimilitud entre los sistemas inmunitarios murino y humano condujo al fracaso clínico de estos anticuerpos, excepto en algunas circunstancias específicas. Los principales problemas asociados con los anticuerpos murinos incluían una menor estimulación de la citotoxicidad y la formación de complejos después de la administración repetida, lo que resultó en reacciones alérgicas leves y, a veces, choque anafiláctico. La tecnología de hibridoma ha sido reemplazada por la tecnología de ADN recombinante, los ratones transgénicos y la visualización de fagos.
Quimérico y humanizado
Para reducir la inmunogenicidad de los anticuerpos murinos (ataques del sistema inmunitario contra los anticuerpos), se diseñaron moléculas murinas para eliminar el contenido inmunogénico y aumentar la eficiencia inmunológica. Esto se logró inicialmente mediante la producción de anticuerpos quiméricos (sufijo -ximab) y humanizados (sufijo -zumab). Los anticuerpos quiméricos están compuestos de regiones variables murinas fusionadas con regiones constantes humanas. Al tomar secuencias de genes humanos de la cadena ligera kappa y la cadena pesada IgG1 se obtienen anticuerpos que son aproximadamente 65 % humanos. Esto reduce la inmunogenicidad y, por lo tanto, aumenta la semivida sérica.
Los anticuerpos humanizados se producen injertando regiones hipervariables murinas en dominios de aminoácidos en anticuerpos humanos. Esto da como resultado una molécula de aproximadamente el 95% de origen humano. Los anticuerpos humanizados se unen al antígeno mucho más débilmente que el anticuerpo monoclonal murino original, con disminuciones de la afinidad de hasta varios cientos de veces. Se han logrado aumentos en la fuerza de unión anticuerpo-antígeno introduciendo mutaciones en las regiones determinantes de complementariedad (CDR), utilizando técnicas como la redistribución aleatoria de cadenas, la aleatorización de las regiones determinantes de complementariedad y anticuerpos con mutaciones dentro de las regiones variables inducidas por PCR propensa a errores, cepas mutadoras de E. coli y mutagénesis específica del sitio.
Anticuerpos monoclonales humanos
Los anticuerpos monoclonales humanos (sufijo -umab) se producen utilizando ratones transgénicos o bibliotecas de presentación de fagos mediante la transferencia de genes de inmunoglobulina humana al genoma murino y la vacunación del ratón transgénico contra el antígeno deseado, lo que conduce a la producción de anticuerpos monoclonales apropiados. De este modo, los anticuerpos murinos in vitro se transforman en anticuerpos completamente humanos.
Las cadenas pesadas y ligeras de las proteínas IgG humanas se expresan en formas polimórficas estructurales (alotípicas). El alotipo de la IgG humana es uno de los muchos factores que pueden contribuir a la inmunogenicidad.
Condiciones específicas
Cáncer
Los anticuerpos monoclonales contra el cáncer pueden actuar contra las células malignas mediante varios mecanismos. El ramucirumab es un anticuerpo monoclonal humano recombinante y se utiliza en el tratamiento de neoplasias malignas avanzadas. En el linfoma infantil, los estudios de fase I y II han encontrado un efecto positivo del uso de la terapia con anticuerpos.
Los anticuerpos monoclonales utilizados para estimular la respuesta inmunitaria contra el cáncer son otra estrategia para combatir el cáncer cuando las células cancerosas no son atacadas directamente. Las estrategias incluyen anticuerpos diseñados para bloquear los mecanismos que regulan negativamente las respuestas inmunitarias contra el cáncer, puntos de control como PD-1 y CTLA-4 (terapia de puntos de control) y anticuerpos modificados para estimular la activación de las células inmunitarias.
Enfermedades autoinmunes
Los anticuerpos monoclonales utilizados para las enfermedades autoinmunes incluyen infliximab y adalimumab, que son eficaces en la artritis reumatoide, la enfermedad de Crohn y la colitis ulcerosa por su capacidad de unirse al TNF-α e inhibirlo. Basiliximab y daclizumab inhiben la IL-2 en las células T activadas y, por lo tanto, ayudan a prevenir el rechazo agudo de los trasplantes de riñón. Omalizumab inhibe la inmunoglobulina E humana (IgE) y es útil en el asma alérgico de moderado a grave.
Enfermedad de Alzheimer
La enfermedad de Alzheimer (EA) es un trastorno neurodegenerativo progresivo, multifacético y dependiente de la edad, y es una de las principales causas de demencia. Según la hipótesis amiloide, la acumulación de péptidos beta amiloide extracelulares (Aβ) en placas a través de oligomerización conduce a los síntomas característicos de la EA a través de disfunción sináptica y neurodegeneración. Se sabe que la inmunoterapia mediante la administración de anticuerpos monoclonales (mAb) exógenos trata varios trastornos del sistema nervioso central. En el caso de la EA, se cree que la inmunoterapia inhibe la oligomerización de Aβ o la eliminación de Aβ del cerebro y, por lo tanto, previene la neurotoxicidad.
Sin embargo, los mAb son moléculas grandes y, debido a la barrera hematoencefálica, la absorción de mAb en el cerebro es extremadamente limitada; se estima que solo pasa aproximadamente 1 de cada 1000 moléculas de mAb. Sin embargo, la hipótesis del sumidero periférico propone un mecanismo en el que los mAb podrían no necesitar cruzar la barrera hematoencefálica. Por lo tanto, se están realizando muchos estudios de investigación a partir de intentos fallidos de tratar la enfermedad de Alzheimer en el pasado.
Sin embargo, las vacunas anti-Aβ pueden promover la eliminación de las placas de Aβ mediada por anticuerpos en modelos de ratones transgénicos con proteínas precursoras de amiloide (APP), y pueden reducir los deterioros cognitivos. Las vacunas pueden estimular el sistema inmunológico para que produzca sus propios anticuerpos, en el caso de la enfermedad de Alzheimer mediante la administración del antígeno Aβ. Esto también se conoce como inmunoterapia activa. Otra estrategia es la denominada inmunoterapia pasiva. En este caso, los anticuerpos se producen externamente en células cultivadas y se administran al paciente en forma de fármaco. En ratones que expresan APP, se ha demostrado que tanto la inmunización activa como la pasiva de anticuerpos anti-Aβ son eficaces para eliminar las placas y pueden mejorar la función cognitiva.
Actualmente, existen dos terapias con anticuerpos aprobadas por la FDA para la enfermedad de Alzheimer: aducanemab y lecanemab. El aducanemab ha recibido una aprobación acelerada, mientras que el lecanemab ha recibido una aprobación total. Se han realizado varios ensayos clínicos con inmunización pasiva y activa y algunos están en marcha, con resultados previstos en un par de años. La implementación de estos medicamentos suele tener lugar durante la aparición temprana de la enfermedad de Alzheimer. Se están llevando a cabo otras investigaciones y desarrollos de medicamentos para la intervención temprana y la prevención de la enfermedad de Alzheimer. Entre los ejemplos de medicamentos mAb importantes que se han evaluado o se están evaluando para el tratamiento de la enfermedad de Alzheimer se incluyen Bapineuzumab, Solanezumab, Gautenerumab, Crenezumab, Aducanemab, Lecanemab y Donanemab.
Bapineuzumab
El bapineuzumab, un anticuerpo monoclonal anti-Aβ humanizado, está dirigido contra el extremo N-terminal de Aβ. Los ensayos clínicos de fase II de bapineuzumab en pacientes con enfermedad de Alzheimer de leve a moderada dieron como resultado una concentración reducida de Aβ en el cerebro. Sin embargo, en pacientes con un aumento de los portadores de apolipoproteína (APOE) e4, el tratamiento con bapineuzumab también se acompaña de edema vasogénico, una afección citotóxica en la que se altera la barrera hematoencefálica y, por lo tanto, se afecta la materia blanca debido a la acumulación excesiva de líquido de los capilares en los espacios intracelulares y extracelulares del cerebro.
En los ensayos clínicos de fase III, el bapineuzumab mostró un efecto positivo prometedor sobre los biomarcadores de la enfermedad de Alzheimer, pero no logró demostrar un efecto sobre el deterioro cognitivo. Por lo tanto, se suspendió el bapineuzumab después de fallar en el ensayo clínico de fase III.
Solanezumab
Solanezumab, un mAb anti-Aβ, se dirige al extremo N de Aβ. En la fase I y la fase II de los ensayos clínicos, el tratamiento con Solanezumab provocó una elevación del nivel de Aβ en el líquido cefalorraquídeo, lo que mostró una concentración reducida de placas de Aβ. Además, no hay efectos secundarios adversos asociados. Los ensayos clínicos de fase III de Solanezumab produjeron una reducción significativa del deterioro cognitivo en pacientes con EA leve, pero no en pacientes con EA grave. Sin embargo, la concentración de Aβ no cambió significativamente, junto con otros biomarcadores de EA, incluida la expresión de fosfatasa alcalina y el volumen del hipocampo. Los ensayos clínicos de fase III de Solanezumab fracasaron porque no mostró efecto sobre el deterioro cognitivo en comparación con placebo.
Lecanemab
Lecanemab (BAN2401) es un anticuerpo monoclonal humanizado que se dirige selectivamente a las protofibrillas solubles tóxicas de Aβ. En los ensayos clínicos de fase 3, Lecanemab mostró un deterioro cognitivo un 27 % más lento después de 18 meses de tratamiento en comparación con placebo. Los ensayos clínicos de fase 3 también informaron reacciones relacionadas con la infusión, anomalías en las imágenes relacionadas con amiloide y dolores de cabeza como los efectos secundarios más comunes de Lecanemab. En julio de 2023, la FDA le dio a Lecanemab la aprobación total para el tratamiento de la enfermedad de Alzheimer y se le dio el nombre comercial de Leqembi.
Ensayos preventivos
El fracaso de varios fármacos en los ensayos clínicos de fase III ha llevado a la prevención de la enfermedad de Alzheimer y a la intervención temprana para los intentos de tratamiento de la enfermedad de Alzheimer de aparición. El tratamiento pasivo con mAb anti-Aβ se puede utilizar para los intentos preventivos de modificar la progresión de la enfermedad de Alzheimer antes de que cause daño cerebral extenso y síntomas. Se están realizando ensayos que utilizan el tratamiento con mAb para pacientes positivos para factores de riesgo genéticos y pacientes de edad avanzada positivos para indicadores de enfermedad de Alzheimer. Esto incluye el tratamiento anti-AB en la enfermedad de Alzheimer asintomática (A4), la Iniciativa de Prevención del Alzheimer (API) y DIAN-TU. El estudio A4 en individuos de edad avanzada que son positivos para indicadores de enfermedad de Alzheimer pero negativos para factores de riesgo genéticos probará Solanezumab en ensayos clínicos de fase III, como seguimiento de estudios previos con Solanezumab. DIAN-TU, lanzado en diciembre de 2012, se centra en pacientes jóvenes positivos para mutaciones genéticas que son riesgos para la enfermedad de Alzheimer. Este estudio utiliza Solanezumab y Gautenerumab. Gautenerumab, el primer anticuerpo monoclonal totalmente humano que interactúa preferentemente con las placas oligomerizadas de Aβ en el cerebro, provocó una reducción significativa de la concentración de Aβ en los ensayos clínicos de fase I, lo que impidió la formación y la concentración de placas sin alterar la concentración plasmática del cerebro. Actualmente se están llevando a cabo ensayos clínicos de fase II y III.
Tipos de terapia
Radioinmunoterapia
La radioinmunoterapia (RIT) implica el uso de anticuerpos murinos conjugados radiactivamente contra antígenos celulares. La mayoría de las investigaciones se centran en su aplicación a los linfomas, ya que se trata de neoplasias malignas muy sensibles a la radiación. Para limitar la exposición a la radiación, se eligieron los anticuerpos murinos, ya que su alta inmunogenicidad promueve la rápida eliminación del tumor. Tositumomab es un ejemplo utilizado para el linfoma no Hodgkin.
Tratamiento de la enzima prodrug dirigida por el Anticuerpo
La terapia enzimática profarmacodirigida por anticuerpos (ADEPT, por sus siglas en inglés) implica la aplicación de anticuerpos monoclonales asociados al cáncer que están unidos a una enzima activadora de fármacos. La administración sistémica de un agente no tóxico da como resultado la conversión del anticuerpo en un fármaco tóxico, lo que produce un efecto citotóxico que puede dirigirse a las células malignas. El éxito clínico de los tratamientos ADEPT es limitado.
Antibody-drug conjugates
Los conjugados anticuerpo-fármaco (ADC) son anticuerpos unidos a una o más moléculas de fármacos. Normalmente, cuando el ADC se encuentra con la célula diana (por ejemplo, una célula cancerosa), se libera el fármaco para matarla. Muchos ADC se encuentran en desarrollo clínico. A partir de 2016, algunos han sido aprobados.
Terapia inmunooliposa
Los inmunoliposomas son liposomas conjugados con anticuerpos. Los liposomas pueden transportar fármacos o nucleótidos terapéuticos y, cuando se conjugan con anticuerpos monoclonales, pueden dirigirse contra células malignas. Los inmunoliposomas se han utilizado con éxito in vivo para transportar genes supresores de tumores a tumores, utilizando un fragmento de anticuerpo contra el receptor de transferrina humano. La administración de genes específicos de tejido mediante inmunoliposomas se ha logrado en tejido de cáncer de mama y de cerebro.
Terapia de punto de control
La terapia de puntos de control utiliza anticuerpos y otras técnicas para eludir las defensas que los tumores utilizan para suprimir el sistema inmunológico. Cada defensa se conoce como punto de control. Las terapias compuestas combinan anticuerpos para suprimir múltiples capas defensivas. Los puntos de control conocidos incluyen CTLA-4, al que se dirige ipilimumab, PD-1, al que se dirigen nivolumab y pembrolizumab, y el microambiente tumoral.
Las características del microambiente tumoral (TME) impiden el reclutamiento de células T al tumor. Entre las formas de hacerlo se encuentra la nitración de la quimiocina CCL2, que atrapa a las células T en el estroma. La vasculatura tumoral ayuda a los tumores a reclutar preferentemente otras células inmunitarias en lugar de las células T, en parte a través de la expresión específica de FasL, ETBR y B7H3 en las células endoteliales (EC). Las células mielomonocíticas y tumorales pueden aumentar la expresión de PD-L1, en parte debido a las condiciones hipóxicas y la producción de citocinas, como IFNβ. La producción aberrante de metabolitos en el TME, como la regulación de la vía por IDO, puede afectar las funciones de las células T de forma directa e indirecta a través de células como las células Treg. Las células CD8 pueden verse suprimidas por la regulación de los fenotipos TAM por parte de las células B. Los fibroblastos asociados al cáncer (CAF) tienen múltiples funciones en el TME, en parte a través de la captura de células T mediada por la matriz extracelular (ECM) y la exclusión de células T regulada por CXCL12.
Anticuerpos terapéuticos aprobados por la FDA
El primer anticuerpo monoclonal terapéutico aprobado por la FDA fue un fármaco específico para el rechazo de trasplantes de células CD3 IgG2a murinas, OKT3 (también llamado muromonab), en 1986. Este fármaco se utilizó en receptores de trasplantes de órganos sólidos que se volvieron resistentes a los esteroides. Cientos de terapias están en fase de ensayos clínicos. La mayoría se centran en objetivos inmunológicos y oncológicos.
| Anticuerpo | Nombre de la marca | Company | Fecha de aprobación | Ruta | Tipo | Meta | Indicación (Enfermedad combinada) | BLA STN | Drug Label |
|---|---|---|---|---|---|---|---|---|---|
| abciximab | ReoPro | Centocor | 12/22/1994 | intravenosa | chimeric Fab | GPIIb/IIIa | Intervención coronaria percutánea | 103575 | Enlace |
| adalimumab | Humira | Abbvie | 12/31/2002 | subcutáneo | plenamente humano | TNF | Artritis reumatoide | 125057 | Enlace |
| adalimumab-adbm | Cyltezo | Boehringer Ingelheim | 8/25/17 | subcutáneo | completamente humano, biosimilar | TNF | Artritis reumatoide Artritis idiopática juvenil Artritis pisoriática Espondilitis anquilosante Enfermedad de Crohn Colitis ulcerosa Psoriasis plaque | 761058 | Enlace |
| adalimumab-atto | Amjevita | Amgen | 9/23/2016 | subcutáneo | completamente humano, biosimilar | TNF | Artritis reumatoide Artritis idiopática juvenil Artritis pisoriática Espondilitis anquilosante Enfermedad de Crohn Colitis ulcerosa Psoriasis plaque | 761024 | Enlace |
| ado-trastuzumab emtansine | Kadcyla | Genentech | 2/22/2013 | intravenosa | humanizado, anticuerpo-drogas conjugado | HER2 | Cáncer de mama metastásico | 125427 | Enlace |
| alemtuzumab | Campath, Lemtrada | Genzyme | 5/7/2001 | intravenosa | humanizada | CD52 | Leucemia linfática crónica de células B | 103948 | Enlace |
| alirocumab | Praluent | Sanofi Aventis | 7/24/2015 | subcutáneo | plenamente humano | PCSK9 | Heterozygous familial hipercolesterolemia Hipercolesterolemia refractaria | 125559 | Enlace |
| atezolizumab | Tecentriq | Genentech | 5/18/2016 | intravenosa | humanizada | PD-L1 | Carcinoma de uranio | 761034 | Enlace |
| atezolizumab | Tecentriq | Genentech | 10/18/2016 | intravenosa | humanizada | PD-L1 | Carcinoma de uranio Cáncer de pulmón de células no pequeñas metastásico | 761041 | Enlace |
| avelumab | Bavencio | EMD Serono | 3/23/2017 | intravenosa | plenamente humano | PD-L1 | Carcinoma de células Merkel metastásico | 761049 | Enlace |
| basiliximab | Simulecto | Novartis | 5/12/1998 | intravenosa | chimeric | IL2RA | Profilaxis del rechazo agudo del órgano en el trasplante renal | 103764 | Enlace |
| belimumab | Benlysta | Ciencias del genoma humano | 3/9/2011 | intravenosa | plenamente humano | BLyS | Lupus eritematoso sistémico | 125370 | Enlace |
| benralizumab | Fasenra | AstraZeneca | 11/14/17 | subcutáneo | humanizada | subunidad alfa del receptor interleucina-5 | Asma grave, fenotipo eosinofílico | 761070 | Enlace |
| bevacizumab | Avastin | Genentech | 2/26/2004 | intravenosa | humanizada | VEGF | Cáncer de colorrectal metastásico | 125085 | Enlace |
| bevacizumab-awwb | Mvasi | Amgen | 9/14/17 | intravenosa | humanizada, biosimilar | VEGF | Cáncer de colorrectal metastásico No escamoso Carcinoma pulmonar no pequeño Glioblastoma Carcinoma de células renales metastásico Cáncer cervical | 761028 | Enlace |
| bezlotoxumab | Zinplava | Merck | 10/21/2016 | intravenosa | plenamente humano | Clostridioides difficile toxin B | Evitar la repetición de la infección de Clostridioides difficile | 761046 | Enlace |
| blinatumomab | Blincyto | Amgen | 12/3/2014 | intravenosa | mouse, bispecific | CD19 | Leucemia linfática aguda de células B precursora | 125557 | Enlace |
| brentuximab vedotin | Adcetris | Seattle Genetics | 9/19/2011 | intravenosa | chimeric, antibody-drug conjugate | CD30 | Linfoma de Hodgkin Linfoma anaplásico de células grandes | 125388 | Enlace |
| brodalumab | Siliq | Valeant | 2/15/2017 | subcutáneo | chimeric | IL17RA | Psoriasis plaque | 761032 | Enlace |
| burosumab-twza | Crysvita | Ultragenyx | 4/17/18 | subcutáneo | plenamente humano | FGF23 | Hipófosfatemia ligada a X | 761068 | Enlace |
| canakinumab | Ilaris | Novartis | 6/17/2009 | subcutáneo | plenamente humano | IL1B | Síndrome periódico asociado a la ciriopyrina | 125319 | Enlace |
| capromab pendetide | ProstaScint | Cytogen | 10/28/1996 | intravenosa | murina, radioetiqueta | PSMA | Diagnóstico de imagen en cáncer de próstata recién diagnosticado o postprostatectomía | 103608 | Enlace |
| certolizumab pegol | Cimzia | UCB (empresa) | 4/22/2008 | subcutáneo | humanizada | TNF | Enfermedad de Crohn | 125160 | Enlace |
| cetuximab | Erbitux | ImClone Systems | 2/12/2004 | intravenosa | chimeric | EGFR | Carcinoma colorrectal metastásico | 125084 | Enlace |
| daclizumab | Zenapax | Roche | 12/10/1997 | intravenosa | humanizada | IL2RA | Profilaxis del rechazo agudo del órgano en el trasplante renal | 103749 | Enlace |
| daclizumab | Zinbryta | Biogen | 5/27/2016 | subcutáneo | humanizada | IL2R | Esclerosis múltiple | 761029 | Enlace |
| daratumumab | Darzalex | Janssen Biotech | 11/16/2015 | intravenosa | plenamente humano | CD38 | mieloma múltiple | 761036 | Enlace |
| denosumab | Prolia, Xgeva | Amgen | 6/1/2010 | subcutáneo | plenamente humano | RANKL | Mujeres posmenopáusicas con osteoporosis | 125320 | Enlace |
| dinutuximab | Unituxin | Terapéutica Unida | 3/10/2015 | intravenosa | chimeric | GD2 | Neuroblastoma pediátrico de alto riesgo | 125516 | Enlace |
| dupilumab | Dupixent | Farmacéuticos Regeneron | 3/28/2017 | subcutáneo | plenamente humano | IL4RA | Dermatitis atópica, asma | 761055 | Enlace |
| durvalumab | Imfinzi | AstraZeneca | 5/1/2017 | intravenosa | plenamente humano | PD-L1 | Carcinoma de uranio | 761069 | Enlace |
| eculizumab | Soliris | Alexion | 3/16/2007 | intravenosa | humanizada | Componente complementario 5 | Hemoglobinuria nocturna paroxismal | 125166 | Enlace |
| elotuzumab | Empliciti | Bristol-Myers Squibb | 11/30/2015 | intravenosa | humanizada | SLAMF7 | mieloma múltiple | 761035 | Enlace |
| emicizumab-kxwh | Hemlibra | Genentech | 11/16/17 | subcutáneo | humanizada, biespecífica | Factor IXa, Factor X | Hemofilia A ( deficiencia del factor VIII congénito) con inhibidores del factor VIII. | 761083 | Enlace |
| erenumab-aooe | Aimovig | Amgen | 5/17/18 | subcutáneo | plenamente humano | Receptor CGRP | Prevención del dolor de cabeza migraña | 761077 | Enlace |
| evolocumab | Repatha | Amgen | 8/27/2015 | subcutáneo | plenamente humano | PCSK9 | Heterozygous familial hipercolesterolemia Hipercolesterolemia refractaria | 125522 | Enlace |
| gemtuzumab ozogamicin | Mylotarg | Wyeth | 9/1/17 | intravenosa | humanizado, anticuerpo-drogas conjugado | CD33 | Leucemia mieloide aguda | 761060 | Enlace |
| golimumab | Simponi | Centocor | 4/24/2009 | subcutáneo | plenamente humano | TNF | Artritis reumatoide Artritis pisoriática Espondilitis anquilosante | 125289 | Enlace |
| golimumab | Simponi Aria | Janssen Biotech | 7/18/2013 | intravenosa | plenamente humano | TNF | Artritis reumatoide | 125433 | Enlace |
| guselkumab | Tremfya | Janssen Biotech | 7/13/17 | subcutáneo | plenamente humano | IL23 | Psoriasis plaque | 761061 | Enlace |
| ibalizumab-uiyk | Trogarzo | TaiMed Biologics | 3/6/18 | intravenosa | humanizada | CD4 | VIH | 761065 | Enlace |
| ibritumomab tiuxetan | Zevalin | Productos farmacéuticos | 2/19/2002 | intravenosa | murina, radioinmunoterapia | CD20 | Linfoma no Hodgkin de células B recaídas o refractarios de baja calidad, folicular o transformado | 125019 | Enlace |
| idarucizumab | Praxbind | Boehringer Ingelheim | 10/16/2015 | intravenosa | humanized Fab | dabigatran | Reversión de emergencia de anticoagulante dabigatran | 761025 | Enlace |
| infliximab | Remicade | Centocor | 8/24/1998 | intravenosa | chimeric | TNF alpha | Enfermedad de Crohn | 103772 | Enlace |
| infliximab-abda | Renflexis | Samsung Bioepis | 21/12/2017 | intravenosa | chimeric, biosimilar | TNF | Enfermedad de Crohn Colitis ulcerosa Artritis reumatoide Espondilitis anquilosante Artritis pisoriática Psoriasis plaque | 761054 | Enlace |
| infliximab-dyyb | Inflectra | Celltrion Healthcare | 4/5/2016 | intravenosa | chimeric, biosimilar | TNF | Enfermedad de Crohn Colitis ulcerosa Artritis reumatoide Espondilitis anquilosante Artritis pisoriática Psoriasis plaque | 125544 | Enlace |
| infliximab-qbtx | Ixifi | Pfizer | 12/13/17 | intravenosa | chimeric, biosimilar | TNF | Enfermedad de Crohn Colitis ulcerosa Artritis reumatoide Espondilitis anquilosante Artritis pisoriática Psoriasis plaque | 761072 | Enlace |
| inotuzumab ozogamicin | Besponsa | Wyeth | 8/17/17 | intravenosa | humanizado, anticuerpo-drogas conjugado | CD22 | Leucemia linfática aguda de células B precursora | 761040 | Enlace |
| ipilimumab | Yervoy | Bristol-Myers Squibb | 3/25/2011 | intravenosa | plenamente humano | CTLA-4 | Melanoma metastásico | 125377 | Enlace |
| ixekizumab | Taltz | Eli Lilly | 3/22/2016 | subcutáneo | humanizada | IL17A | Psoriasis plaque | 125521 | Enlace |
| marstacimab | Hympavzi | Pfizer | 10/11/2024 | intravenosa | plenamente humano | Inhibidor de la ruta del factor de tejido | Hemophilia A y B | 761345 | [1] |
| mepolizumab | Nucala | GlaxoSmithKline | 11/4/2015 | subcutáneo | humanizada | IL5 | Asma grave | 125526 | Enlace |
| Natalieumab | Tysabri | Biogen Idec | 11/23/2004 | intravenosa | humanizada | alpha-4 integrino | Esclerosis múltiple | 125104 | Enlace |
| necitumumab | Portrazza | Eli Lilly | 11/24/2015 | intravenosa | plenamente humano | EGFR | Carcinoma de pulmón de células no pequeñas metastásico | 125547 | Enlace |
| nivolumab | Opdivo | Bristol-Myers Squibb | 3/4/2015 | intravenosa | plenamente humano | PD-1 | Carcinoma de pulmón de células no pequeñas metastásico | 125527 | Enlace |
| nivolumab | Opdivo | Bristol-Myers Squibb | 12/22/2014 | intravenosa | plenamente humano | PD-1 | Melanoma metastásico | 125554 | Enlace |
| obiltoxaximab | Anthem | Terapéutica Elusys | 3/18/2016 | intravenosa | chimeric | Antígeno protector de la toxina Antrax | Antrax inhalador | 125509 | Enlace |
| obinutuzumab | Gazyva | Genentech | 11/1/2013 | intravenosa | humanizada | CD20 | Leucemia linfática crónica | 125486 | Enlace |
| ocrelizumab | Ocrevus | Genentech | 3/28/2017 | intravenosa | humanizada | CD20 | Esclerosis múltiple | 761053 | Enlace |
| ofatumumab | Arzerra | Glaxo Grp | 10/26/2009 | intravenosa | plenamente humano | CD20 | Leucemia linfática crónica | 125326 | Enlace |
| olaratumab | Lartruvo | Eli Lilly | 10/19/2016 | intravenosa | plenamente humano | PDGFRA | Sarcoma de tejido blando | 761038 | Enlace |
| omalizumab | Xolair | Genentech | 6/20/2003 | subcutáneo | humanizada | IgE | Asma persistente moderada a grave | 103976 | Enlace |
| palivizumab | Synagis | MedImmune | 6/19/1998 | intramuscular | humanizada | F protein of RSV | Virus sincitial respiratorio | 103770 | Enlace |
| panitumumab | Vectibix | Amgen | 9/27/2006 | intravenosa | plenamente humano | EGFR | Cáncer de colorrectal metastásico | 125147 | Enlace |
| pembrolizumab | Keytruda | Merck | 9/4/2014 | intravenosa | humanizada | PD-1 | Melanoma metastásico | 125514 | Enlace |
| pertuzumab | Perjeta | Genentech | 6/8/2012 | intravenosa | humanizada | HER2 | Cáncer de mama metastásico | 125409 | Enlace |
| ramucirumab | Cyramza | Eli Lilly | 4/21/2014 | intravenosa | plenamente humano | VEGFR2 | Cáncer gástrico | 125477 | Enlace |
| ranibizumab | Lucentis | Genentech | 6/30/2006 | Inyección intravitreal | humanizada | VEGFR1 VEGFR2 | Degeneración macular relacionada con la edad húmeda | 125156 | Enlace |
| raxibacumab | Raxibacumab | Ciencias del genoma humano | 12/24/2012 | intravenosa | plenamente humano | Antígeno protector de Bacillus anthracis | Antrax inhalador | 125349 | Enlace |
| reslizumab | Cinqair | Teva | 3/23/2016 | intravenosa | humanizada | IL5 | Asma grave | 761033 | Enlace |
| rituximab | Rituxan | Genentech | 11/26/1997 | intravenosa | chimeric | CD20 | Linfoma no Hodgkin de células B | 103705 | Enlace |
| rituximab y hyaluronidase | Rituxan Hycela | Genentech | 6/22/17 | subcutáneo | chimeric, co-formulated | CD20 | Linfoma folicular Linfoma de células B grandes difusas Leucemia linfática crónica | 761064 | Enlace |
| sarilumab | Kevzara | Sanofi Aventis | 5/22/17 | subcutáneo | plenamente humano | IL6R | Artritis reumatoide | 761037 | Enlace |
| secukinumab | Cosentyx | Novartis | 1/21/2015 | subcutáneo (2015) intravenosa (2023) | plenamente humano | IL17A | Psoriasis plaque Espondilitis anquilosante | 125504 | Enlace |
| siltuximab | Sylvant | Janssen Biotech | 4/23/2014 | intravenosa | chimeric | IL6 | Enfermedad de Castleman multicéntrico | 125496 | Enlace |
| tildrakizumab-asmn | Ilumya | Merck | 3/20/18 | subcutáneo | humanizada | IL23 | Psoriasis plaque | 761067 | Enlace |
| tocilizumab | Actemra | Genentech | 1/8/2010 | intravenosa | humanizada | IL6R | Artritis reumatoide | 125276 | Enlace |
| tocilizumab | Actemra | Genentech | 10/21/2013 | intravenosa subcutáneo | humanizada | IL6R | Artritis reumatoide Artritis idiopática juvenil poliarticular Artritis idiopática juvenil sistémica | 125472 | Enlace |
| trastuzumab | Herceptin | Genentech | 9/25/1998 | intravenosa | humanizada | HER2 | Cáncer de mama metastásico | 103792 | Enlace |
| trastuzumab-dkst | Ogivri | Mylan | 12/1/17 | intravenosa | humanizada, biosimilar | HER2 | Cáncer de mama hiperexpresivo, adenocarcinoma de unión metastásico gástrico o gastroesofágico | 761074 | Enlace |
| ustekinumab | Stelara | Centocor | 9/25/2009 | subcutáneo | plenamente humano | IL12 IL23 | Psoriasis plaque | 125261 | Enlace |
| ustekinumab | Stelara | Janssen Biotech | 9/23/2016 | subcutáneo intravenosa | plenamente humano | IL12 IL23 | Psoriasis plaque Artritis pisoriática Enfermedad de Crohn | 761044 | Enlace |
| vedolizumab | Entyvio | Takeda | 5/20/2014 | intravenosa | humanizada | receptor integrino | Colitis ulcerosa Enfermedad de Crohn | 125476 | Enlace |
Tositumomab – Bexxar – 2003 – CD20
Mogamulizumab – Poteligeo – Agosto 2018 – CCR4
Moxetumomab pasudotox – Lumoxiti – Septiembre 2018 – CD22
Cemiplimab – Libtayo – Septiembre 2018 – PD-1
Polatuzumab vedotin – Polivy – Junio 2019 – CD79B
Los anticuerpos biespecíficos ya han llegado a la práctica clínica. En 2009, el anticuerpo biespecífico catumaxomab fue aprobado en la Unión Europea y posteriormente retirado por razones comerciales. Otros anticuerpos biespecíficos son amivantamab, blinatumomab, teclistamab y emicizumab.
Economía
Desde el año 2000, el mercado terapéutico de los anticuerpos monoclonales ha crecido exponencialmente. En 2006, los "cinco grandes" anticuerpos terapéuticos del mercado fueron bevacizumab, trastuzumab (ambos oncológicos), adalimumab, infliximab (tanto para trastornos autoinmunes como inflamatorios, "AIID") y rituximab (oncológico y AIID), que representaron el 80% de los ingresos en 2006. En 2007, ocho de los 20 medicamentos biotecnológicos más vendidos en los EE. UU. son anticuerpos monoclonales terapéuticos. Este rápido crecimiento de la demanda de producción de anticuerpos monoclonales se ha visto bien compensado por la industrialización de la fabricación de mAb.
Referencias
- ^ a b Yao S, Zhu Y, Chen L (febrero de 2013). "Avances en apuntar moléculas de señalización de superficie celular para la modulación inmunitaria". Reseñas de la naturaleza. Drug Discovery. 12 (2): 130–146. doi:10.1038/nrd3877. PMC 3698571. PMID 23370250.
- ^ Janeway, Charles; Paul Travers; Mark Walport; Mark Shlomchik (2001). Inmunobiología; Quinta edición. Nueva York y Londres: Garland Science. ISBN 978-0-8153-4101-7.
- ^ a b Janeway CA Jr.; et al. (2005). Inmunobiología (6th ed.). Ciencias Garland. ISBN 978-0-443-07310-6.
- ^ a b Baxter D (diciembre de 2007). "Inmunidad activa y pasiva, tipos de vacunas, excipientes y licencias". Medicina ocupacional. 57 (8): 552-556. doi:10.1093/occmed/kqm110. PMID 18045976.
- ^ Modificado desde Carter P (noviembre de 2001). "Mejorando la eficacia de las terapias de cáncer basadas en anticuerpos". Reseñas de la naturaleza. Cáncer. 1 (2): 118–129. doi:10.1038/35101072. PMID 11905803. S2CID 10169378.
- ^ Breedveld FC (Febrero 2000). "Los anticuerpos monoclonales terapéuticos". Lancet. 355 (9205): 735-740. doi:10.1016/S0140-6736(00)01034-5. PMID 10703815. S2CID 43781004.
- ^ Köhler G, Milstein C (agosto de 1975). "Continuas culturas de células fusionadas que secretan el anticuerpo de la especificidad predefinida". Naturaleza. 256 (5517): 495-497. Código de la Biblia:1975Natur.256..495K doi:10.1038/256495a0. PMID 1172191. S2CID 4161444.
- ^ Nadler LM, Stashenko P, Hardy R, Kaplan WD, Button LN, Kufe DW, et al. (septiembre de 1980). "Seroterapia de un paciente con un anticuerpo monoclonal dirigido contra un antígeno asociado al linfoma humano". Cancer Research. 40 (9): 3147–3154. PMID 7427932.
- ^ Ritz J, Schlossman SF (enero de 1982). "Utilización de anticuerpos monoclonales en el tratamiento de la leucemia y el linfoma". Sangre. 59 (1): 1–11. doi:10.1182/blood.V59.1.1.1. PMID 7032624.
- ^ a b c Stern M, Herrmann R (abril de 2005). "Overview of monoclonal antibodies in cancer therapy: present and promise". Críticas críticas en Oncología/Hematología. 54 (1): 11–29. doi:10.1016/j.critrevonc.2004.10.011. PMID 15780905.
- ^ a b c Hudson PJ, Souriau C (enero de 2003). "Anticuerpos mejorados". Nature Medicine. 9 (1): 129–134. doi:10.1038/nm0103-129. PMID 12514726. S2CID 19243664.
- ^ Carter P, Presta L, Gorman CM, Ridgway JB, Henner D, Wong WL, et al. (mayo de 1992). "Humanización de un anticuerpo antip185HER2 para terapia de cáncer humano". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 89 (10): 4285–4289. Código: 1992PNAS...89.4285C. doi:10.1073/pnas.89.10.4285. PMC 49066. PMID 1350088.
- ^ Presta LG, Lahr SJ, Shields RL, Porter JP, Gorman CM, Fendly BM, Jardieu PM (septiembre de 1993). "Humanización de un anticuerpo dirigido contra IgE". Journal of Immunology. 151 (5): 2623–2632. doi:10.4049/jimmunol.151.5.2623. PMID 8360482. S2CID 904440.
- ^ Chothia C, Lesk AM, Tramontano A, Levitt M, Smith-Gill SJ, Air G, et al. (1989). "Conformations of immunoglobulin hypervariable regions". Naturaleza. 342 (6252): 877–883. Código: 1989Natur.342..877C. doi:10.1038/342877a0. PMID 2687698. S2CID 4241051.
- ^ Waldmann TA (marzo de 2003). "Inmunoterapia: pasado, presente y futuro". Nature Medicine. 9 (3): 269-277. doi:10.1038/nm0303-269. PMID 12612576. S2CID 9745527.
- ^ Jefferis R, Lefranc MP (Julio–agosto 2009). "Alotipos de inmunoglobulina humana: posibles implicaciones para la inmunogenicidad". m Abs. 1 (4): 332–338. doi:10.4161/mabs.1.4.9122. PMC 2726606. PMID 20073133.
- ^ Chapman K, Pullen N, Coney L, Dempster M, Andrews L, Bajramovic J, et al. (2009). "Desarrollo preclínico de anticuerpos monoclonales: consideraciones para el uso de primates no humanos". m Abs. 1 (5): 505-516. doi:10.4161/mabs.1.5.9676. PMC 2759500. PMID 20065651.
- ^ Vennepureddy A, Singh P, Rastogi R, Atallah JP, Terjanian T (octubre de 2017). "Evolución de ramucirumab en el tratamiento del cáncer - Una revisión de la literatura". Journal of Oncology Pharmacy Practice. 23 (7): 525-539. doi:10.1177/1078155216655474. PMID 27306885. S2CID 21298489.
- ^ de Zwart V, Gouw SC, Meyer-Wentrup FA (enero de 2016). "Terapias anticuerpos para el linfoma en niños". La base de datos Cochrane de revisiones sistemáticas. 2016 (1): CD011181. doi:10.1002/14651858.cd011181.pub2. PMC 8719646. PMID 26784573.
- ^ a b Sharma P, Allison JP (abril de 2015). "El futuro de la terapia de control inmune". Ciencia. 348 (6230): 56–61. Código:2015...348...56S. doi:10.1126/science.aaaa8172. PMID 258373. S2CID 4608450.
- ^ Dempke WC, Fenchel K, Uciechowski P, Dale SP (marzo de 2017). "Medicamentos de segunda y tercera generación para el tratamiento inmuno-oncológico-¿Cuanto más mejor?". European Journal of Cancer. 74: 55–72. doi:10.1016/j.ejca.2017.01.001. PMID 28335888.
- ^ a b Rang, H. P. (2003). Farmacología. Edimburgo: Churchill Livingstone. p. 241. ISBN 978-0-443-07145-4.
- ^ a b Pul R, Dodel R, Stangel M (marzo 2011). "Terapia anticuerpo en la enfermedad de Alzheimer". Expert Opinion on Biological Terapia. 11 (3): 343–357. doi:10.1517/14712598.2011.552884. PMID 21261567. S2CID 19375883.
- ^ a b c d van Dyck CH (febrero 2018). " Anticuerpos monoclonales anti-amiloide-β para la enfermedad de Alzheimer: caídas y promesas". Psiquiatría Biológica. 83 (4): 311–319. doi:10.1016/j.biopsych.2017.08.010. PMC 5767539. PMID 28967385.
- ^ a b c d e Guo X, Yan L, Zhang D, Zhao Y (Febrero 2024). "Inmunoterapia pasiva para la enfermedad de Alzheimer". Revisiones de investigación sobre el envejecimiento. 94: 102192. doi:10.1016/j.arr.2024.102192. PMID 38219962.
- ^ a b c d Panza F, Solfrizzi V, Imbimbo BP, Logroscino G (octubre de 2014). "Amyloid-directed monoclonal anticuerpos para el tratamiento de la enfermedad de Alzheimer: el punto de no retorno?". Expert Opinion on Biological Terapia. 14 (10): 1465-1476. doi:10.1517/14712598.2014.935332. PMID 24981190. S2CID 26323381.
- ^ van Dyck CH (febrero 2018). " Anticuerpos monoclonales anti-amiloide-β para la enfermedad de Alzheimer: caídas y promesas". Psiquiatría Biológica. 83 (4): 311–319. doi:10.1016/j.biopsych.2017.08.010. PMC 5767539. PMID 28967385.
- ^ Goel, Ayush (20 de agosto de 2013). "Edema cerebral vasogénico". radiopaedia.org. Retrieved 2017-11-01.
- ^ a b Panza F, Frisardi V, Imbimbo BP, D'Onofrio G, Pietrarossa G, Seripa D, et al. (noviembre de 2010). "Bapineuzumab: anticuerpos monoclonales anti-β-amiloide para el tratamiento de la enfermedad de Alzheimer". Inmunoterapia. 2 (6): 767–782. doi:10.2217/imt.10.80. PMID 21091109.
- ^ Sperling RA, Donohue MC, Raman R, Rafii MS, Johnson K, Masters CL, et al. (septiembre 2023). "Trial of Solanezumab in Preclinical Alzheimer's Disease". El New England Journal of Medicine. 389 (12): 1096–1107. doi:10.1056/NEJMoa2305032. PMC 10559996. PMID 37458272.
- ^ Logovinsky V, Satlin A, Lai R, Swanson C, Kaplow J, Osswald G, et al. (abril de 2016). "Safety and tolerability of BAN2401--a Clinic study in Alzheimer's disease with a protofibril selective Aβ antibody". Investigación y Terapia de Alzheimer. 8 1): 14. doi:10.1186/s13195-016-0181-2. PMC 4822297. PMID 27048170.
- ^ "Un estudio para confirmar la seguridad y la eficacia de BAN2401 en participantes con enfermedad de Alzheimer temprana". Case Medical Research. 2019-03-25. doi:10.31525/ct1-nct03887455. ISSN 2643-4652.S2CID 242999976.
- ^ van Dyck CH, Swanson CJ, Aisen P, Bateman RJ, Chen C, Gee M, et al. (enero 2023). "Lecanemab in Early Alzheimer's Disease". El New England Journal of Medicine. 388 (1): 9–21. doi:10.1056/NEJMoa2212948. PMID 36449413.
- ^ "Leqembi vivieron ALZFORUM". www.alzforum.org. Retrieved 2024-02-14.
- ^ Comisionado, Oficina del (2023-07-07). "FDA convierte el tratamiento de la enfermedad de Alzheimer en evolución tradicional". FDA. Retrieved 2024-02-14.
- ^ Francis RJ, Sharma SK, Springer C, Green AJ, Hope-Stone LD, Sena L, et al. (septiembre de 2002). "Un ensayo de fase I del tratamiento de la enzima prodrug dirigida anticuerpo (ADEPT) en pacientes con carcinoma colorrectal avanzado u otros tumores que producen CEA". British Journal of Cancer. 87 (6): 600–607. doi:10.1038/sj.bjc.6600517. PMC 2364249. PMID 12237768.
- ^ Krauss WC, Park JW, Kirpotin DB, Hong K, Benz CC (2000). "Terapéuticas HER2 (ErbB-2/neu) emergentes con base en anticuerpos". Enfermedad de mama. 11: 113–124. doi:10.3233/bd-1999-11110. PMID 15687597.
- ^ Joyce JA, Fearon DT (abril de 2015). "Exclusión celular, privilegio inmunitario y microambiente tumoral". Ciencia. 348 (6230): 74–80. Código:2015Sci...348...74J. doi:10.1126/science.aaa6204PMID 258376. S2CID 11603692.
- ^ Hooks MA, Wade CS, Millikan WJ (1991). "Muromonab CD-3: una revisión de su farmacología, farmacocinética y uso clínico en trasplante". Farmacoterapia. 11 (1): 26–37. doi:10.1002/j.1875-9114.1991.tb03595.x. PMID 1902291. S2CID 25271222.
- ^ Chames P, Baty D (2009). "Los anticuerpos específicos para la terapia del cáncer: la luz al final del túnel?". m Abs. 1 (6): 539-547. doi:10.4161/mabs.1.6.10015. PMC 2791310. PMID 20073127.
- ^ Linke R, Klein A, Seimetz D (2010). "Catumaxomab: desarrollo clínico y direcciones futuras". m Abs. 2 (2): 129–136. doi:10.4161/mabs.2.2.11221. PMC 2840231. PMID 20190561.
- ^ "Removab: Retiro de la autorización de marketing en la Unión Europea" (PDF). Agencia Europea de Medicinas. 2017-07-10.
- ^ Toledo-Stuardo K, Ribeiro CH, González-Herrera F, Matthies DJ, Le Roy MS, Dietz-Vargas C, Latorre Y, Campos I, Guerra Y, Tello S, Vásquez-Sáez V, Novoa P, Fehring N, González M, Rodríguez-Siza J, Vásquez G, Méndez P, Altamirano C, Molina MC (octubre 2024). "Los anticuerpos terapéuticos en oncología: una visión general de inmunofarmacia". Cancer Immunol Immunother. 73 (12): 242. doi:10.1007/s00262-024-03814-2. PMC 11448508. PMID 39358613.
- ^ Scolnik PA (2009). "mAbs: una perspectiva empresarial". m Abs. 1 (2): 179–184. doi:10.4161/mabs.1.2.7736. PMC 2725420. PMID 20061824.
- ^ Kelley B (2009). "Industrialization of mAb production technology: the bioprocessing industry at a crossroads". m Abs. 1 (5): 443–452. doi:10.4161/mabs.1.5.9448. PMC 2759494. PMID 20065641.
Enlaces externos
- Manual de Gestión del Cáncer: Principios de Farmacoterapia Oncológica(registro requerido) Archivado 2009-05-15 en la máquina Wayback