Teoría del campo cristalino
En física molecular, la teoría del campo cristalino (CFT) describe la ruptura de las degeneraciones de los estados orbitales de los electrones, normalmente d o . orbitales f, debido a un campo eléctrico estático producido por una distribución de carga circundante (vecinos de aniones). Esta teoría se ha utilizado para describir varias espectroscopias de complejos de coordinación de metales de transición, en particular espectros ópticos (colores). CFT explica con éxito algunas propiedades magnéticas, colores, entalpías de hidratación y estructuras de espinela de complejos de metales de transición, pero no intenta describir los enlaces. La CFT fue desarrollada por los físicos Hans Bethe y John Hasbrouck van Vleck en la década de 1930. Posteriormente, la CFT se combinó con la teoría de los orbitales moleculares para formar la teoría del campo de ligandos (LFT), más realista y compleja, que ofrece información sobre el proceso de enlace químico en complejos de metales de transición. La CFT puede complicarse aún más al romper los supuestos hechos sobre las energías orbitales relativas del metal y del ligando, lo que requiere el uso de la teoría del campo de ligando invertido (ILFT) para describir mejor el enlace.
Descripción general
Según la teoría del campo cristalino, la interacción entre un metal de transición y ligandos surge de la atracción entre el catión metálico cargado positivamente y la carga negativa de los electrones no enlazantes del ligando. La teoría se desarrolla considerando los cambios de energía de los cinco orbitales d degenerados al estar rodeados por una serie de cargas puntuales formadas por ligandos. A medida que un ligando se acerca al ion metálico, los electrones del ligando estarán más cerca de algunos de los orbitales d y más lejos de otros, lo que provocará una pérdida de degeneración. Los electrones en los orbitales d y los del ligando se repelen entre sí debido a la repulsión entre cargas similares. Por lo tanto, los electrones d más cercanos a los ligandos tendrán una energía mayor que los más alejados, lo que da como resultado que los orbitales d se dividan en energía. Esta división se ve afectada por los siguientes factores:
- la naturaleza del iión de metal.
- el estado de oxidación del metal. Un estado de oxidación superior conduce a una división mayor relativa al campo esférico.
- el arreglo de los ligandos alrededor del ión de metal.
- el número de coordinación del metal (es decir tetraedral, octaedral...)
- la naturaleza de los ligandos que rodean el ión metálico. Cuanto más fuerte sea el efecto de los ligandos, mayor será la diferencia entre la energía alta y baja d grupos.
El tipo más común de complejo es el octaédrico, en el que seis ligandos forman los vértices de un octaedro alrededor del ion metálico. En simetría octaédrica, los orbitales d se dividen en dos conjuntos con una diferencia de energía, Δoct (el parámetro de división del campo cristalino, también comúnmente denominado por 10Dq por diez veces el "diferencial de cuantos") donde el dxy, los orbitales dxz y dyz tendrán menor energía que el d z2 y dx2-y2, que tendrá mayor energía, porque el primer grupo está más lejos de los ligandos que el segundo y por lo tanto experimenta menos repulsión. Los tres orbitales de menor energía se denominan colectivamente t2g, y los dos orbitales de mayor energía como eg. Estas etiquetas se basan en la teoría de la simetría molecular: son los nombres de representaciones irreducibles del grupo de puntos octaédricos, Oh. (consulte la tabla de caracteres Oh). Los diagramas de energía orbital típicos se dan a continuación en la sección Alto y bajo giro.
Los complejos tetraédricos son el segundo tipo más común; aquí cuatro ligandos forman un tetraedro alrededor del ion metálico. En una división de campo cristalino tetraédrico, los orbitales d se dividen nuevamente en dos grupos, con una diferencia de energía de Δtet. Los orbitales de menor energía serán dz2 y d<. i>x2-y2, y los orbitales de mayor energía serán dxy, dxz y d yz - opuesto al caso octaédrico. Además, dado que los electrones del ligando en simetría tetraédrica no están orientados directamente hacia los orbitales d, la división de energía será menor que en el caso octaédrico. CFT también puede describir geometrías cuadradas planas y otras geometrías complejas.
El tamaño del espacio Δ entre dos o más conjuntos de orbitales depende de varios factores, incluidos los ligandos y la geometría del complejo. Algunos ligandos siempre producen un valor pequeño de Δ, mientras que otros siempre dan una división grande. Las razones detrás de esto pueden explicarse mediante la teoría del campo de ligandos. La serie espectroquímica es una lista de ligandos derivada empíricamente ordenada por el tamaño de la división Δ que producen (de Δ pequeña a Δ grande; consulte también esta tabla):
Yo- < Br- < S2− < SCN− (S–consolidado) < Cl- < NO3- < N3- < F- < OH- < C2O42− < H2O < NCS− (con enlace N) < CH3CN < py < NH3 < es < 2,2'-bipiridina < fen < NO2- < PPh3 < CN- < CO.
Es útil tener en cuenta que los ligandos que producen la mayor división son aquellos que pueden participar en la unión de metal con ligando.
El estado de oxidación del metal también contribuye al tamaño de Δ entre los niveles de energía alto y bajo. A medida que aumenta el estado de oxidación de un metal determinado, aumenta la magnitud de Δ. Un complejo V3+ tendrá un Δ mayor que un complejo V2+ para un conjunto dado de ligandos, ya que la diferencia en la densidad de carga permite que los ligandos estén más cerca de un V3+ que a un ion V2+. La distancia más pequeña entre el ligando y el ion metálico da como resultado un Δ mayor, porque el ligando y los electrones del metal están más cerca entre sí y, por lo tanto, se repelen más.
Alto y bajo giro

Los ligandos que provocan una gran división Δ de los orbitales d se denominan ligandos de campo fuerte, como el CN− y el CO de la serie espectroquímica. En complejos con estos ligandos, es desfavorable colocar electrones en orbitales de alta energía. Por lo tanto, los orbitales de menor energía se llenan completamente antes de que comience la población de los conjuntos superiores según el principio de Aufbau. Complejos como este se denominan "bajo espín". Por ejemplo, NO2- es un ligando de campo fuerte y produce un Δ grande. El ion octaédrico [Fe(NO2)6]3−, que tiene 5 electrones d, tenga el diagrama de división octaédrico que se muestra a la derecha con los cinco electrones en el nivel t2g. Por lo tanto, este estado de bajo giro no sigue la regla de Hund.

Por el contrario, los ligandos (como I− y Br−) que causan una pequeña división Δ de los orbitales d se denominan Ligandos de campo débil. En este caso, es más fácil colocar electrones en el conjunto de orbitales de mayor energía que colocar dos en el mismo orbital de baja energía, porque dos electrones en el mismo orbital se repelen entre sí. Por lo tanto, se coloca un electrón en cada uno de los cinco orbitales d de acuerdo con la regla de Hund, y se produce el "espín alto" Los complejos se forman antes de que se produzca cualquier emparejamiento. Por ejemplo, Br− es un ligando de campo débil y produce un pequeño Δoct. Entonces, el ion [FeBr6]3−, nuevamente con cinco electrones d, tendría un diagrama de división octaédrico donde los cinco orbitales están ocupada individualmente.
Para que se produzca una división de espín baja, el costo de energía de colocar un electrón en un orbital ya ocupado debe ser menor que el costo de colocar el electrón adicional en un g orbital con un coste energético de Δ. Como se señaló anteriormente, eg se refiere a la dz2 y dx2-y2 que tienen mayor energía que los t2g en los complejos octaédricos. Si la energía requerida para emparejar dos electrones es mayor que Δ, el costo de energía de colocar un electrón en un eg, se produce una alta división de espín.
La energía de división del campo cristalino para complejos metálicos tetraédricos (cuatro ligandos) se conoce como Δtet y es aproximadamente igual a 4/9Δoct (para el mismo metal y los mismos ligandos). Por lo tanto, la energía necesaria para emparejar dos electrones suele ser mayor que la energía necesaria para colocar electrones en los orbitales de mayor energía. Por tanto, los complejos tetraédricos suelen tener un alto espín.
El uso de estos diagramas de división puede ayudar en la predicción de las propiedades magnéticas de los compuestos de coordinación. Un compuesto que tenga electrones desapareados en su diagrama de división será paramagnético y será atraído por campos magnéticos, mientras que un compuesto que carece de electrones desapareados en su diagrama de división será diamagnético y será repelido débilmente por un campo magnético.
Energía de estabilización
La energía de estabilización del campo cristalino (CFSE) es la estabilidad que resulta de colocar un ion de metal de transición en el campo cristalino generado por un conjunto de ligandos. Surge debido al hecho de que cuando los orbitales d se dividen en un campo de ligando (como se describió anteriormente), algunos de ellos pierden energía que antes con respecto a un campo esférico conocido como baricentro en el que se encuentran los cinco . Los orbitales d están degenerados. Por ejemplo, en un caso octaédrico, el conjunto t2g adquiere menor energía que los orbitales del baricentro. Como resultado de esto, si hay electrones ocupando estos orbitales, el ion metálico es más estable en el campo del ligando en relación con el baricentro en una cantidad conocida como CFSE. Por el contrario, los orbitales eg (en el caso octaédrico) tienen mayor energía que en el baricentro, por lo que colocar electrones en estos reduce la cantidad de CFSE.

Si la división de los orbitales d en un campo octaédrico es Δoct, los tres t2g los orbitales se estabilizan con respecto al baricentro por 2/5 Δoct, y el eg Los orbitales se desestabilizan en 3/5 Δoct. Como ejemplos, considere las dos configuraciones d5 que se muestran más arriba en la página. El ejemplo de bajo espín (arriba) tiene cinco electrones en los orbitales t2g, por lo que el CFSE total es 5 x 2/ 5 Δoct = 2Δoct. En el ejemplo de giro alto (inferior), el CFSE es (3 x 2/5 Δoct) - (2 x 3/5 Δoct) = 0 - en este caso, la estabilización generada por los electrones en los orbitales inferiores se anula por el efecto desestabilizador del electrones en los orbitales superiores.
Propiedades ópticas
Las propiedades ópticas (detalles de los espectros de absorción y emisión) de muchos complejos de coordinación pueden explicarse mediante la teoría del campo cristalino. Sin embargo, a menudo los colores más profundos de los complejos metálicos surgen de excitaciones de transferencia de carga más intensas.
Geometrías y diagramas de división
| Nombre | Forma | Diagrama de energía |
|---|---|---|
| Octahedral |  | 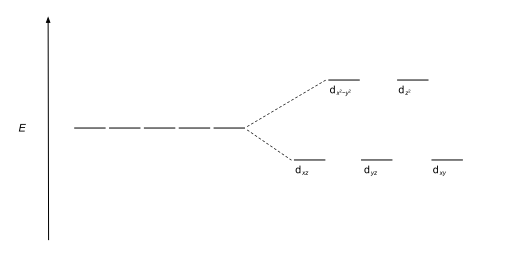 |
| Bipyramidal pentagonal |  | 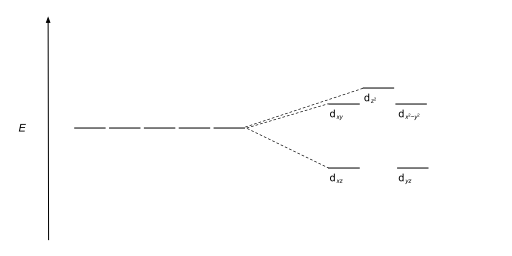 |
| Plaza antiprismática |  | 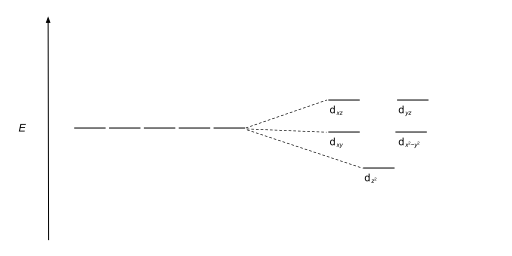 |
| Plano cuadrado |  | 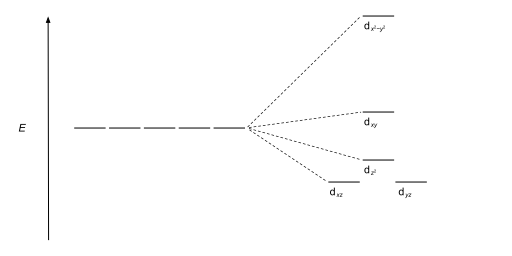 |
| pirámide cuadrada |  | 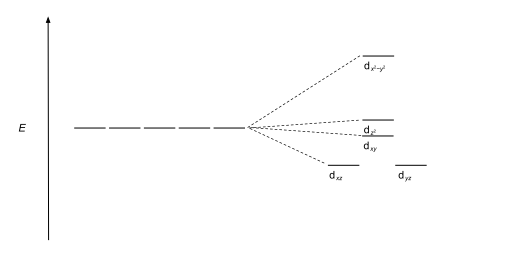 |
| Tetraedral |  | 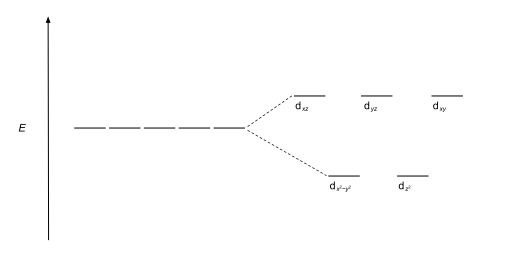 |
| Bipyramidal trigonal |  | 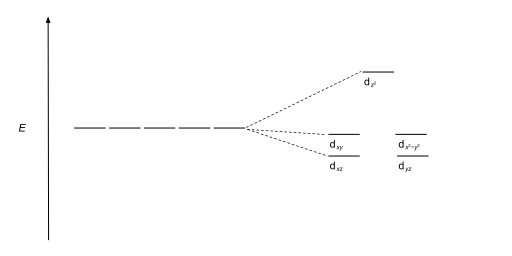 |