Tendencias periódicas
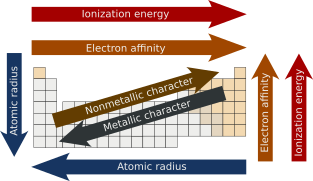
En química, las tendencias periódicas son patrones específicos presentes en la tabla periódica que ilustran diferentes aspectos de ciertos elementos cuando se agrupan por período y/o grupo. Fueron descubiertas por el químico ruso Dmitri Mendeleev en 1863. Las tendencias periódicas principales incluyen radio atómico, energía de ionización, afinidad electrónica, electronegatividad, nucleofilia, electrofilia, valencia, carga nuclear y carácter metálico. Mendeleev construyó las bases de la tabla periódica. Mendeleev organizó los elementos en función del peso atómico, dejando espacios vacíos donde creía que los elementos no descubiertos ocuparían su lugar. El descubrimiento de esta tendencia por parte de Mendeleev le permitió predecir la existencia y las propiedades de tres elementos desconocidos, que luego fueron descubiertos por otros químicos y llamados galio, escandio y germanio. El físico inglés Henry Moseley descubrió que organizar los elementos por número atómico en lugar de peso atómico agruparía naturalmente los elementos con propiedades similares.
Resumen de las tendencias
| Bienes periódicos | A través del período | Down the group |
|---|---|---|
| Radius atómico | Disminuciones | Aumentos |
| Nucleophilicity | ||
| Carácter metálico | ||
| Cargo nuclear | Aumentos | |
| Cargo nuclear eficaz | Disminuciones | |
| Energía de ionización | ||
| Afinidad de electrones | ||
| Electronegatividad | ||
| Carácter no metálico | ||
| Valency | Constante |
Radius atómico

El radio atómico es la distancia desde el núcleo atómico hasta el orbital electrónico más externo de un átomo. En general, el radio atómico disminuye a medida que nos movemos de izquierda a derecha en un período, y aumenta cuando descendemos en un grupo. Esto se debe a que en los períodos, los electrones de valencia están en la misma capa más externa. El número atómico aumenta dentro del mismo período mientras nos movemos de izquierda a derecha, lo que a su vez aumenta la carga nuclear efectiva. El aumento de las fuerzas de atracción reduce el radio atómico de los elementos. Cuando descendemos en el grupo, el radio atómico aumenta debido a la adición de una nueva capa.
Cargo nuclear y carga nuclear eficaz
La carga nuclear se define como el número de protones en el núcleo de un elemento. Por lo tanto, de izquierda a derecha de un período y de arriba hacia abajo de un grupo, a medida que aumenta el número de protones en el núcleo, la carga nuclear también aumentará. Sin embargo, los electrones de los átomos multielectrónicos no experimentan toda la carga nuclear debido a los efectos de protección de los otros electrones. En este caso, la carga nuclear de los átomos que experimentan este apantallamiento se denomina carga nuclear efectiva. El apantallamiento aumenta a medida que aumenta el número de capas internas de un átomo. Por lo tanto, de izquierda a derecha de un período, la carga nuclear efectiva seguirá aumentando. Pero, de arriba hacia abajo de un grupo, a medida que aumenta el número de capas, la carga nuclear efectiva disminuirá.
Energía de ionización
La energía de ionización es la cantidad mínima de energía que un electrón de un átomo o ion gaseoso debe absorber para salir de la influencia de la fuerza de atracción del núcleo. También se la denomina potencial de ionización. La primera energía de ionización es la cantidad de energía que se requiere para extraer el primer electrón de un átomo neutro. La energía necesaria para extraer el segundo electrón del átomo neutro se denomina segunda energía de ionización, y así sucesivamente.
A medida que uno se desplaza de izquierda a derecha a lo largo de un período en la tabla periódica moderna, la energía de ionización aumenta a medida que aumenta la carga nuclear y disminuye el tamaño atómico. La disminución del tamaño atómico da como resultado una fuerza de atracción más potente entre los electrones y el núcleo. Sin embargo, supongamos que uno se desplaza hacia abajo en un grupo. En ese caso, la energía de ionización disminuye a medida que aumenta el tamaño atómico debido a la adición de una capa de valencia, lo que disminuye la atracción del núcleo hacia los electrones.

Afinidad de electrones
La energía liberada cuando se añade un electrón a un átomo neutro gaseoso para formar un anión se conoce como afinidad electrónica. En términos de tendencia, a medida que se avanza de izquierda a derecha a lo largo de un período, la afinidad electrónica aumentará a medida que aumenta la carga nuclear y disminuye el tamaño atómico, lo que da como resultado una fuerza de atracción más potente del núcleo y el electrón añadido. Sin embargo, a medida que se desciende en un grupo, la afinidad electrónica disminuye porque el tamaño atómico aumenta debido a la adición de una capa de valencia, lo que debilita la atracción del núcleo hacia los electrones. Aunque puede parecer que el flúor debería tener la mayor afinidad electrónica, su pequeño tamaño genera suficiente repulsión entre los electrones, lo que da como resultado que el cloro tenga la mayor afinidad electrónica de la familia de los halógenos.
Electronegatividad
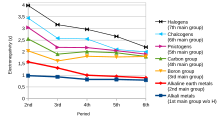
La tendencia de un átomo de una molécula a atraer hacia sí el par de electrones compartido se conoce como electronegatividad. Es una cantidad adimensional porque es solo una tendencia. La escala más utilizada para medir la electronegatividad fue diseñada por Linus Pauling. La escala se denominó escala de Pauling en su honor. Según esta escala, el flúor es el elemento más electronegativo, mientras que el cesio es el menos electronegativo.
En términos de tendencia, a medida que uno se mueve de izquierda a derecha a lo largo de un período en la tabla periódica moderna, la electronegatividad aumenta a medida que aumenta la carga nuclear y disminuye el tamaño atómico. Sin embargo, si uno se mueve hacia abajo en un grupo, la electronegatividad disminuye a medida que aumenta el tamaño atómico debido a la adición de una capa de valencia, lo que disminuye la atracción del átomo hacia los electrones.
Sin embargo, en el grupo XIII (familia del boro), la electronegatividad primero disminuye del boro al aluminio y luego aumenta a medida que descendemos en el grupo. Esto se debe a que el tamaño atómico aumenta a medida que descendemos en el grupo, pero al mismo tiempo la carga nuclear efectiva aumenta debido al escaso apantallamiento de los electrones internos d y f. Como resultado, la fuerza de atracción del núcleo por los electrones aumenta y, por lo tanto, la electronegatividad aumenta del aluminio al talio.
Valency
La valencia de un elemento es la cantidad de electrones que debe perder o ganar un átomo para obtener una configuración electrónica estable. En términos simples, es la medida de la capacidad de combinación de un elemento para formar compuestos químicos. Los electrones que se encuentran en la capa más externa generalmente se conocen como electrones de valencia; la cantidad de electrones de valencia determina la valencia de un átomo.
En cuanto a la tendencia, al moverse de izquierda a derecha a lo largo de un período, el número de electrones de valencia de los elementos aumenta y varía entre uno y ocho. Pero la valencia de los elementos primero aumenta de 1 a 4, y luego disminuye a 0 a medida que llegamos a los gases nobles. Sin embargo, a medida que descendemos en un grupo, el número de electrones de valencia generalmente no cambia. Por lo tanto, en muchos casos los elementos de un grupo particular tienen la misma valencia. Sin embargo, esta tendencia periódica no siempre se sigue para los elementos más pesados, especialmente para el bloque f y los metales de transición. Estos elementos muestran una valencia variable ya que tienen un orbital d como penúltimo orbital y un orbital s como orbital más externo. Las energías de estos orbitales (n-1)d y ns (por ejemplo, 4d y 5s) son relativamente cercanas.
Propiedades metálicas y no metálicas
Las propiedades metálicas generalmente aumentan a medida que se desciende en los grupos, ya que la atracción decreciente entre los núcleos y los electrones más externos hace que estos electrones estén más débilmente unidos y, por lo tanto, sean capaces de conducir calor y electricidad. A lo largo de cada período, de izquierda a derecha, la atracción creciente entre los núcleos y los electrones más externos hace que el carácter metálico disminuya. Por el contrario, el carácter no metálico disminuye a medida que se desciende en los grupos y aumenta a lo largo de los períodos.
Nucleophilicity and Electrophilicity
La electrofilia se refiere a la tendencia de una especie deficiente en electrones, llamada electrófilo, a aceptar electrones. De manera similar, la nucleofilia se define como la afinidad de una especie rica en electrones, conocida como nucleófilo, a donar electrones a otra especie.Las tendencias en la tabla periódica son útiles para predecir la nucleofilia y la electrofilia de un elemento. En general, la nucleofilia disminuye a medida que aumenta la electronegatividad , lo que significa que la nucleofilia disminuye de izquierda a derecha a lo largo de la tabla periódica. Por otro lado, la electrofilia generalmente aumenta a medida que aumenta la electronegatividad , lo que significa que la electrofilia sigue una tendencia creciente de izquierda a derecha en la tabla periódica. Sin embargo, el entorno molecular o químico específico del electrófilo también influye en la electrofilia. Por lo tanto, la electrofilicidad no se puede predecir con precisión basándose únicamente en tendencias periódicas.
Véase también
- Cuadro periódico
- Historia de la tabla periódica
- Lista de elementos por propiedades atómicas
Referencias
- ^ Schrobilgen, Gary J. (2019). "La química en el borde de la tabla periódica: la importancia de las tendencias periódicas en el descubrimiento de los gases nobles y el desarrollo de la química Noble-Gas". En Mingos, D. Michael P. (ed.). Cuadro I. Estructura y Bonificación. Vol. 181. pp. 157–196. doi:10.1007/430_2019_49. ISBN 978-3-030-40024-8.
- ^ Edwards, Peter P.; Egdell, Russell G.; Fenske, Dieter; Yao, Benzhen (18 septiembre 2020). "La ley periódica de los elementos químicos: 'El nuevo sistema de pesos atómicos que hace evidentes las analogías que existen entre los cuerpos'". Transacciones filosóficas de la Sociedad Real A: Ciencias Matemáticas, Físicas e Ingeniería. 378 (2180): 20190537. código:2020RSPTA.37890537E. doi:10.1098/rsta.2019.0537. PMC 7435142. PMID 32811357.
- ^ a b Egdell, Russell G.; Bruton, Elizabeth (2020-09-18). "Henry Moseley, espectroscopia de rayos X y la mesa periódica". Transacciones filosóficas de la Sociedad Real A: Ciencias Matemáticas, Físicas e Ingeniería. 378 (2180): 20190302. código:2020RSPTA.37890302E. doi:10.1098/rsta.2019.0302. PMID 32811359.
- ^ Sztejnberg, Aleksander (2018). "Dmitri Ivanovich Mendeleev (1834 – 1907), Científico ruso prominente. Referencias a sus grandes logros científicos en la literatura entre 1871 y 1917". Revista CENIC. Ciencias Químicas. 49 (1): 1–13.
- ^ "radio atómico e iónico". www.chemguide.co.uk. Retrieved 2022-06-30.
- ^ Huggins, Maurice L. (abril de 1922). "Atómico Radii. I". Examen físico. 19 (4): 346–353. Bibcode:1922PhRv...19..346H. doi:10.1103/PhysRev.19.346.
- ^ Rahm, Martin; Hoffmann, Roald; Ashcroft, N. W. (17 de marzo de 2017). "Corrigendum: Atomic and Ionic Radii of Elements 1–96". Química – Un Diario Europeo. 23 (16): 4017. doi:10.1002/chem.201700610. PMID 28318129.
- ^ l'Annunziata, Michael F. (2016). " Conceptos básicos y definiciones". Radioactividad. pp. 67–78. doi:10.1016/B978-0-444-63489-4.00002-2. ISBN 978-0-444-63489-4.
- ^ Stokłosa, A.; Zajęcki, J.; Kurek, S. S. (2004). "Carga nuclear efectiva de un ión" (PDF). Materials Science Poland. 22 (1): 35–45.
- ^ "7.4: Energía de Ionización". Química LibreTextos. 2014-11-18. Retrieved 2022-07-02.
- ^ Van De Walle, C.G. (2001). "Point Defects and Impurities in III-Nitride Bulk and Thin Film Heterostructures". Enciclopedia de Materiales: Ciencia y Tecnología. pp. 7125–7131. doi:10.1016/B0-08-043152-6/01262-6. ISBN 978-0-08-043152-9.
- ^ Abdu, Sadiq Garba; Onimisi, Muhammad Yusuf; Musa, Nasiru (enero de 2014). "Computation of the First and Second Ionization Energies of the First Ten Elements of the Periodic Table Using a Modified Hartree-Fock Approximation Code". American Journal of Condensed Matter Physics. 4 (3): 51–56.
- ^ "Ionización de la energía Tendencias de la ciencia en la vida". sciencetrends.com. 2018-05-18. Retrieved 2022-07-02.
- ^ Zadeh, Dariush H. (2019-07-26). "Conchas atómicas según ionización". Journal of Molecular Modeling. 25 (8): 251. doi:10.1007/s00894-019-4112-6. PMID 31346734.
- ^ "Afinidad electrónica". Enciclopedia Diccionario de polímeros. 2007. p. 350. doi:10.1007/978-0-387-30160-0_4245. ISBN 978-0-387-31021-3.
- ^ "Electron Affinity Trend ¦ Science Trends". sciencetrends.com2018-05-14. Retrieved 2022-07-02.
- ^ Química (IUPAC), Unión Internacional de Puras y Aplicadas. "IUPAC - electronegatividad (E01990)". goldbook.iupac.org. doi:10.1351/goldbook.e01990. Retrieved 2022-06-30.
- ^ Bickmore, Barry R.; Wander, Matthew C. F. (2018). "Electronegatividad". Encyclopedia of Geochemistry. Encyclopedia of Earth Sciences Series. pp. 442-444. doi:10.1007/978-319-39312-4_222. ISBN 978-319-39311-7.
- ^ Mullay, John (1987). "Estimación de electronegatividades atómicas y de grupo". Electronegatividad. Estructura y Bonificación. Vol. 66. pp. 1–25. doi:10.1007/bfb0029834. ISBN 3-540-17740-X.
- ^ "21.1: Los Elementos del Grupo 13". Libretextos. 2013-11-26. Retrieved 2022-06-30.
- ^ Franz, Daniel; Inoue, Shigeyoshi (2016). "Avances en el desarrollo de complejos que contienen un elemento grupo 13 chalcogen múltiples lazos". Transacciones de Dalton. 45 (23): 9385–9397. doi:10.1039/C6DT01413E. PMID 27216700.
- ^ "Valencia". Diccionario de Gems y Gemología. 2009. p. 899. doi:10.1007/978-3-540-72816-0_22746. ISBN 978-3-540-72795-8.
- ^ "Valencia". Enciclopedia de Inmunotoxicología. 2016. p. 947. doi:10.1007/978-3-642-54596-2_201542. ISBN 978-3-642-54595-5.
- ^ Valency. Heidelberg Science Library. 1978. doi:10.1007/978-1-4612-626262-6. ISBN 978-0-387-90268-5.
- ^ O'Dwyer, M. F.; Kent, J. E.; Brown, R. D. (1978). "Muchos átomos electos". Valency. Heidelberg Science Library. pp. 59–86. doi:10.1007/978-1-4612-626262-6_4. ISBN 978-0-387-90268-5.
- ^ Gopinathan, M. S.; Jug, Karl (septiembre de 1983). "Valency. I. A quantum chemical definition and properties". Theoretica Chimica Acta. 63 (6): 497–509. doi:10.1007/BF02394809.
- ^ Daw, Murray S.; Foiles, Stephen M.; Baskes, Michael I. (marzo de 1993). "El método del átomo integrado: una revisión de la teoría y las aplicaciones". Materials Science Reports. 9 (7–8): 251–310. doi:10.1016/0920-2307(93)90001-U.
- ^ "C9.1 – Tendencias periódicas". IGCSE AID. 2018-03-05. Retrieved 2022-07-02.
- ^ a b Nazmul, Islam; Ghosh, Dulal C (17 de febrero de 2012). "Sobre el carácter electrofílico de las moléculas a través de su relación con electronegatividad y dureza química". International Journal of Molecular Sciences. 13 (2): 2160–2175. doi:10.3390/ijms13022160. PMC 3292014. PMID 22408445.
- ^ Savin, Kenneth A. (2014). "Introducción: Estructura molecular y reactividad". Escribir mecanismos de reacción en química orgánica. pp. 1–53. doi:10.1016/B978-0-12-411475-3.00001-4. ISBN 978-0-12-411475-3.
Más lectura
- Tabla periódica de elementos (IUPAC)