Glándulas gástricas
Las glándulas gástricas son glándulas en el revestimiento del estómago que juegan un papel esencial en el proceso de digestión. Todas las glándulas... (leer más)
El tejido linfoide asociado al intestino (GALT) es un componente del tejido linfoide asociado a la mucosa (MALT) que actúa en el sistema inmunitario para proteger al organismo de la invasión del intestino.
Debido a su función fisiológica en la absorción de alimentos, la superficie mucosa es delgada y actúa como una barrera permeable al interior del cuerpo. Igualmente, su fragilidad y permeabilidad crea vulnerabilidad a la infección y, de hecho, la gran mayoría de los agentes infecciosos que invaden el cuerpo humano utilizan esta vía. La importancia funcional de GALT en la defensa del cuerpo se basa en su gran población de células plasmáticas, que son productoras de anticuerpos, cuyo número excede el número de células plasmáticas en el bazo, los ganglios linfáticos y la médula ósea combinados. GALT constituye aproximadamente el 70% del peso del sistema inmunitario; GALT comprometido puede afectar significativamente la fuerza del sistema inmunológico en su conjunto.
El tejido linfoide asociado con el intestino se encuentra en todo el intestino y cubre un área de aproximadamente 260 a 300 m. Para aumentar la superficie de absorción, la mucosa intestinal está formada por proyecciones en forma de dedos (vellosidades), cubiertas por una monocapa de células epiteliales, que separa el GALT de la luz del intestino y su contenido. Estas células epiteliales están recubiertas por una capa de glucocáliz en su superficie luminal para proteger a las células del pH ácido.
Constantemente se producen nuevas células epiteliales derivadas de células madre en el fondo de las glándulas intestinales, regenerando el epitelio (el tiempo de renovación de las células epiteliales es inferior a una semana). Aunque en estas criptas los enterocitos convencionales son el tipo de células dominantes, también se pueden encontrar células de Paneth. Estos se ubican en el fondo de las criptas y liberan una serie de sustancias antibacterianas, entre ellas lisozima, y se cree que intervienen en el control de infecciones.
Debajo de ellos, hay una capa subyacente de tejido conectivo laxo llamada lámina propia. También hay circulación linfática a través del tejido conectado a los ganglios linfáticos mesentéricos.
Tanto el GALT como los ganglios linfáticos mesentéricos son sitios donde se inicia la respuesta inmunitaria debido a la presencia de células inmunitarias a través de las células epiteliales y la lámina propia.
El GALT también incluye las placas de Peyer del intestino delgado, folículos linfoides aislados presentes en todo el intestino y el apéndice en humanos.
Los siguientes ejemplos comprenden tejidos linfoides que actúan como interfaces entre el sistema inmunitario y los antígenos entrantes, ya sea como antígenos alimentarios o como antígenos de la microbiota patógena o comensal:
GALT también se puede dividir en dos categorías considerando la estructura de la que surge la función. Se pueden encontrar 1.) GALT organizado formado por folículos, como placas de Peyer, ganglios linfáticos mesentéricos e incluso un apéndice más organizado. Su función principal es inducir la reacción inmune. 2.) GALT difuso con células T y B individuales, macrófagos, eosinófilos, basófilos y mastocitos, que se encuentran preferentemente en la lámina propia. Esta parte de GALT se compone de células efectoras maduras listas para realizar sus acciones.
La placa de Peyer es un agregado de células linfoides proyectadas a la luz del intestino que actúa como un sitio muy importante para el inicio de la respuesta inmune. Forma un domo subepitelial donde se encuentran gran cantidad de folículos de células B con sus centros germinales, zonas de células T entre ellos en menor número y células dendríticas. En esta área, la cúpula subepitelial está separada de la luz intestinal por una capa de epitelio asociado a folículos. Este contiene células epiteliales intestinales convencionales y una pequeña cantidad de células epiteliales especializadas llamadas células microfold (células M) en el medio. A diferencia de los enterocitos, estas células M presentan una superficie luminal plegada en lugar de las microvellosidades, no secretan enzimas digestivas ni moco y carecen de una superficie gruesa de glicocalix.
En circunstancias normales, el sistema inmunitario de todo el organismo necesita una fuente intestinal de antígenos para entrenar y regular el desarrollo de diversas células inmunitarias. Sin tal estimulación, muchas propiedades de los sistemas inmunológicos no se desarrollan, como se muestra en el caso de los animales libres de gérmenes. Debido a que las células inmunitarias están en contacto constante con antígenos bacterianos y alimentarios, la respuesta primaria se configura como tolerogénica. Aun así, debe haber una defensa sólida en el caso de que los patógenos crucen la línea fronteriza del epitelio o produzcan sustancias nocivas como toxinas bacterianas. Tal caminar sobre el filo de un cuchillo está garantizado por diversos tipos de células inmunitarias:
Las células B plasmáticas que residen en la lámina propia producen altos niveles de anticuerpos IgA secretores específicos. Estas IgA se secretan en la luz del intestino a través de la capa epitelial por transcitosis. En primer lugar, la célula epitelial se une a un dímero de IgA a través del receptor de Ig polimérico en el lado basolateral y lo transporta en una vesícula al espacio luminal. Luego, el receptor se escinde proteolíticamente y el dímero de IgA se libera con una porción del receptor llamada componente secretor. El componente secretor protege los anticuerpos secretados contra el medio digestivo en el intestino.
Un alto nivel de IgA secretora resulta de la interacción de las células B y las células dendríticas presentadoras de antígeno intestinal (DC) en cooperación con las células T auxiliares foliculares (Tfh) en los centros germinales (GC) de las placas de Peyer. Hay dos formas principales de producción de IgA 1) dependiente de células T que da como resultado sIgA con alta afinidad y especificidad y 2) generación independiente de células T de sIgA, que utiliza células dendríticas y su producción de citoquinas BAFF y APRIL. Las sIgA producidas de forma independiente por células T tienen menor afinidad y recubren principalmente a los comensales.Las funciones generales de las IgA secretoras son recubrir cualquiera de las bacterias intestinales (comensales o patógenas) para alterar su motilidad y evitar que entren en contacto prolongado y directo con el epitelio intestinal y el sistema inmunitario intestinal del huésped. Esto se llama exclusión inmune. Las IgA secretadas se unen a las toxinas bacterianas y también las neutralizan.
Las células T CD4+ vírgenes se diferencian en Treg o en varios subconjuntos de células T auxiliares (Th1, Th2, Th17 o Tfh). En el tejido linfoide asociado al intestino, el proceso de diferenciación se produce mediante la presentación de antígenos derivados de la microbiota intestinal por parte de células presentadoras de antígenos, como las células dendríticas o las células M en las placas de Peyer. El proceso típico de una tolerancia oral hacia los antígenos alimentarios ingeridos se puede describir como un muestreo luminal continuo de antígenos por parte de las DC y su posterior migración seguida de la preparación de las células T vírgenes en los ganglios linfáticos mesentéricos para convertirse en células T inmunosupresoras (Treg).Los antígenos recibidos de esta manera aseguran la tolerancia frente a ellos. La microbiota comensal también activa la respuesta inmunitaria, de una manera que protege el tejido intestinal del huésped para que no lo dañen las reacciones de las células inmunitarias. El resultado final de las poblaciones de células T en individuos sanos difiere del espectro de células T resultantes de una infección aguda o una inflamación crónica. La estimulación inapropiada (típicamente por bacterias filamentosas segmentadas - SFB) de la respuesta crónica de células Th1 o Th17 juega un papel crucial en el daño patológico del huésped.
Se han descrito varias células linfoides novedosas asociadas al intestino. Son de diferentes orígenes y siguen diferentes procesos de maduración, pero comparten la misma función GALT: responder rápidamente a los patógenos y secretar citocinas efectoras. Dichos sistemas de protección multicapa resaltan la susceptibilidad de las mucosas a los agentes invasores. La vía mucosa es la vía más frecuente de entrada de infecciones patógenas al huésped. El compromiso sólido de una variedad de células linfoides que patrullan la capa epitelial también refleja la presión evolutiva y la carrera armamentista entre los sistemas inmunitarios y los patógenos que escapan a su control.
Los linfocitos intraepiteliales residenciales y de larga vida son una de las poblaciones más grandes de linfocitos T en el cuerpo. A diferencia de otros linfocitos periféricos, los IEL no circulan en el torrente sanguíneo ni en el sistema linfático, sino que residen en la capa epitelial del intestino. Tal ubicación es muy especial en sí misma: los IEL patrullan la condición dentro de una sola capa de células y tienen un aspecto dendrítico. Proporcionan la primera línea de defensa en caso de que un patógeno cruce la barrera epitelial. Los IEL abarcan una sorprendente diversidad de orígenes y se dividen en dos categorías principales: convencionales y no convencionales. Se basa en las propiedades moleculares de la superficie y el lugar donde adquieren su programa citotóxico efector final.
Los IEL convencionales tienen un receptor TCR clásico compuesto por subunidades α y β junto con correceptores CD4 o CD8. Representan una minoría relativa de los IEL intestinales totales en comparación con los IEL no convencionales. Se derivan de células T vírgenes que se encuentran con antígenos en la periferia (típicamente antígenos presentados por DC en las placas de Peyer). Después de esta activación, los IEL convencionales expresan moléculas intestinales trópicas que les permiten alojarse en el tejido intestinal después de pasar por el torrente linfático y el torrente sanguíneo posterior. Las células intraepiteliales convencionales son, por lo tanto, células T de memoria efectoras residentes en tejidos, capaces de responder rápidamente con actividad citolítica y liberación de citoquinas tales como INFγ y TNF.
Las IEL no convencionales presentan la mayoría de las células IEL en la capa epitelial intestinal y adquieren su programa efector después de salir del timo como células vírgenes y encontrar antígenos en GALT. Después de tal estimulación, los IEL no convencionales (principalmente células T γδ) residen en el epitelio intestinal. Las células T γδ expresan el receptor TCR formado por las subunidades γ y δ y no reconocen los péptidos antigénicos presentados en la forma unida al MHC. El proceso de su activación aún se desconoce en gran medida. La propiedad principal de las células T γδ es la formación de poblaciones de memoria de larga duración en tejidos de barrera como el epitelio intestinal o en la piel. Realizan la memoria inmunológica en un tejido particular incluso después de la eliminación del patógeno o el retroceso de la inflamación.
Las células linfoides innatas (ILC, por sus siglas en inglés) son la familia de células inmunitarias innatas descubierta más recientemente y el término "innato" significa que no necesitan un reordenamiento del gen del receptor de antígeno. Debido al desarrollo de métodos novedosos, como la secuenciación de ARN de células individuales, se describen subtipos de células linfoides innatas. Según su perfil transcripcional establecido por los principales factores de transcripción, las ILC se dividen en cinco subconjuntos distintos: células NK, ILC1, ILC2, ILC3 y células LTi. Las ILC prevalecen en las superficies de las mucosas y desempeñan un papel clave en la inmunidad y la homeostasis de las mucosas debido a su capacidad de secreción rápida de citoquinas inmunorreguladoras y, por lo tanto, se comunican con otras células inmunitarias.
Además de la inmunidad específica adaptativa, una inmunidad innata juega un papel importante en GALT porque proporciona una respuesta más rápida. El reconocimiento de la firma microbiana no propia ocurre mediante receptores de reconocimiento de patrones (PRR) que se pueden encontrar en células dendríticas, macrófagos, monocitos, neutrófilos y células epiteliales. Los PRR se unen a patrones microbianos conservados como componentes de las paredes celulares (LPS, ácido teicoico, flagelina, peptidoglicano) o ácido nucleico viral o bacteriano. Los PRR se localizan extracelularmente como receptores unidos a la membrana (receptores tipo Toll) o intracelularmente (receptores tipo NOD y tipo RIG). La paleta variada de receptores de reconocimiento de patrones se activa mediante varias señales denominadas PAMP (patrones moleculares asociados a patógenos) o mediante señales conectadas al daño tisular denominadas DAMP (patrones moleculares asociados a daños).
La mayoría de las células presentadoras de antígenos (APC) en el intestino se derivan de los macrófagos, que tienen un recambio muy rápido. Los macrófagos prevalecen en la lámina propia y en las capas más profundas de la submucosa, como la capa muscular. Los macrófagos pueden usar sus dendritas transepiteliales (extensiones citoplásmicas largas) y contactar directamente con la capa epitelial y tomar muestras de bacterias luminales. En condiciones saludables, los macrófagos engullen bacterias comensales y desechos celulares circundantes, secretan IL-10, impulsan la maduración de Treg y contribuyen a la homeostasis tisular. Debido a la baja expresión de receptores de respuesta innatos y moléculas de superficie coestimuladoras, los macrófagos intestinales no inician la inflamación. Pero ante la infección o la inflamación, el perfil de los macrófagos cambia y comienzan a secretar grandes cantidades de TNF- α.y convertirse en células efectoras proinflamatorias.
Los DC presentan menos del 10 % de lámina propia APC y, por lo general, no residen en las capas inferiores. La producción inherente de ácido retinoico y TGF-β (típico de las DC asociadas al intestino) induce la expresión de moléculas de localización intestinal y favorece el cambio de IgA durante la maduración de las células B en los folículos. Las DC también dirigen Treg y IEL convencionales para recibir su fenotipo final de células efectoras maduras en el intestino.
La inmunidad adaptativa, mediada por anticuerpos y células T, sólo se encuentra en vertebrados. Mientras que todos ellos tienen un tejido linfoide asociado al intestino y la gran mayoría tiene una versión de bazo y timo, no todos los vertebrados presentan médula ósea, ganglios linfáticos o centros germinales, lo que significa que no todos los vertebrados pueden generar linfocitos en la médula ósea. Esta distribución diferente de los órganos adaptativos en los diferentes grupos de vertebrados sugiere que GALT es la primera parte del sistema inmunitario adaptativo en los vertebrados. Se ha sugerido que a partir de este GALT existente, y debido a la presión ejercida por las bacterias comensales en el intestino que coevolucionaron con los vertebrados, aparecieron especializaciones posteriores como timo, bazo o ganglios linfáticos como parte del sistema inmunitario adaptativo.
 Linfáticos del colon.
Linfáticos del colon. Sección del esófago humano.
Sección del esófago humano.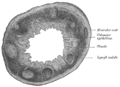 Sección transversal del proceso vermiforme humano. X 20.
Sección transversal del proceso vermiforme humano. X 20. Sección de la membrana mucosa del recto humano. X 60.
Sección de la membrana mucosa del recto humano. X 60.Las glándulas gástricas son glándulas en el revestimiento del estómago que juegan un papel esencial en el proceso de digestión. Todas las glándulas... (leer más)
El peso del cuerpo humano es la masa o el peso de una... (leer más)
Las glándulas olfatorias también conocidas como glándulas de Bowman, son un tipo de glándulas nasales situadas en la mucosa olfatoria, debajo del epitelio... (leer más)