Tamaño del genoma

Tamaño genoma es la cantidad total de ADN contenida en una copia de un único genoma completo. Se mide generalmente en términos de masa en picogramas (trillionths (10−12) de un gramo, pg abreviado) o menos frecuentemente en daltons, o como el número total de pares base nucleótidos, generalmente en megabases (millones de pares base, Mb abreviado o Mbp). Un picograma es igual a 978 megabases. En organismos diploides, el tamaño del genoma se utiliza a menudo intercambiablemente con el término C-valor.
La complejidad de un organismo no es directamente proporcional a su tamaño genoma; el contenido total de ADN es ampliamente variable entre taxones biológicos. Algunos organismos monocelulares tienen mucho más ADN que los humanos, por razones que siguen siendo poco claras (ver ADN no codificación y enigma de valor C).
Origen del término

El término "tamaño del genoma" a menudo se atribuye erróneamente a un artículo de 1976 de Ralph Hinegardner, incluso en discusiones que tratan específicamente de la terminología en esta área de investigación (por ejemplo, Greilhuber 2005). Cabe destacar que Hinegardner utilizó el término sólo una vez: en el título. En realidad, el término parece haber aparecido por primera vez en 1968, cuando Hinegardner se preguntó, en el último párrafo de otro artículo, si "el contenido de ADN celular refleja, de hecho, el tamaño del genoma". En este contexto, el "tamaño del genoma" se estaba usando en el sentido de genotipo para referirse al número de genes.
En un artículo presentado sólo dos meses después, Wolf et al. (1969) utilizaron el término "tamaño del genoma" en todo y en su uso actual; por lo tanto, probablemente se debería atribuir a estos autores el mérito de haber originado el término en su sentido moderno. A principios de la década de 1970, el "tamaño del genoma" era de uso común con su definición actual, probablemente como resultado de su inclusión en el influyente libro de Susumu Ohno Evolución por duplicación de genes, publicado en 1970.
Variación en el tamaño del genoma y el contenido genético
Con la aparición de diversas técnicas moleculares en los últimos 50 años, se han analizado los tamaños del genoma de miles de eucariotas y estos datos están disponibles en bases de datos en línea para animales, plantas y hongos (ver enlaces externos). El tamaño del genoma nuclear generalmente se mide en eucariotas mediante mediciones densitométricas de núcleos teñidos con Feulgen (anteriormente usando densitómetros especializados, ahora más comúnmente usando análisis de imágenes computarizados) o citometría de flujo. En los procariotas, la electroforesis en gel de campo pulsado y la secuenciación completa del genoma son los métodos predominantes para determinar el tamaño del genoma.
Es bien sabido que el tamaño del genoma nuclear varía enormemente entre las especies eucariotas. En los animales varían más de 3.300 veces, y en las plantas terrestres difieren en un factor de aproximadamente 1.000. Se ha informado que los genomas de protistas varían más de 300.000 veces en tamaño, pero se ha puesto en duda el extremo superior de este rango (Amoeba). En los eucariotas (pero no en los procariotas), el tamaño del genoma no es proporcional al número de genes presentes en el genoma, una observación que se consideraba totalmente contraria a la intuición antes del descubrimiento del ADN no codificante y que se conoció como el " Paradoja del valor C" como resultado. Sin embargo, aunque ya no existe ningún aspecto paradójico en la discrepancia entre el tamaño del genoma y el número de genes, el término sigue siendo de uso común. Por razones de clarificación conceptual, un autor ha sugerido que los diversos enigmas que quedan con respecto a la variación del tamaño del genoma comprenden con mayor precisión un rompecabezas o un enigma (el llamado "enigma del valor C"). .
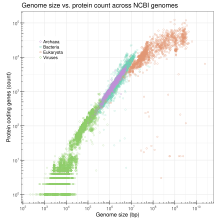
El tamaño del genoma se correlaciona con una variedad de características mensurables a nivel de células y organismos, incluido el tamaño celular, la tasa de división celular y, según el taxón, el tamaño corporal, la tasa metabólica, la tasa de desarrollo, la complejidad de los órganos, la distribución geográfica o riesgo de extinción. Según los datos del genoma completamente secuenciados actualmente disponibles (a abril de 2009), el número de genes transformados logarítmicamente forma una correlación lineal con el tamaño del genoma transformado logarítmicamente en bacterias, arqueas, virus y orgánulos combinados, mientras que un logaritmo no lineal (logaritmo seminatural) Se observa correlación en los eucariotas. Aunque esto último contrasta con la opinión anterior de que no existe correlación para los eucariotas, la correlación no lineal observada para los eucariotas puede reflejar un aumento desproporcionadamente rápido del ADN no codificante en genomas eucariotas cada vez más grandes. Aunque los datos genómicos secuenciados están prácticamente sesgados hacia genomas pequeños, lo que puede comprometer la precisión de la correlación derivada empíricamente, y la prueba definitiva de la correlación aún debe obtenerse mediante la secuenciación de algunos de los genomas eucariotas más grandes, los datos actuales no parecen descartar una posible correlación.
Tamaño del genoma humano

En los seres humanos, el genoma nuclear diploide femenino total por célula se extiende por 6,37 pares de gigabases (Gbp), mide 208,23 cm de largo y pesa 6,51 picogramos (pg). Los valores masculinos son 6,27 Gbp, 205,00 cm, 6,41 pg. Cada polímero de ADN puede contener cientos de millones de nucleótidos, como en el cromosoma 1. El cromosoma 1 es el cromosoma humano más grande con aproximadamente 220 millones de pares de bases y sería 85 mm de largo si está enderezado.
En los eucariotas, además del ADN nuclear, también existe el ADN mitocondrial (ADNmt) que codifica ciertas proteínas utilizadas por las mitocondrias. El ADNmt suele ser relativamente pequeño en comparación con el ADN nuclear. Por ejemplo, el ADN mitocondrial humano forma moléculas circulares cerradas, cada una de las cuales contiene 16.569 pares de bases de ADN, y cada una de esas moléculas normalmente contiene un conjunto completo de genes mitocondriales. Cada mitocondria humana contiene, en promedio, aproximadamente 5 de estas moléculas de ADNmt. Cada célula humana contiene aproximadamente 100 mitocondrias, lo que da un número total de moléculas de ADNmt por célula humana de aproximadamente 500. Sin embargo, la cantidad de mitocondrias por célula también varía según el tipo de célula, y un óvulo puede contener 100.000 mitocondrias, lo que corresponde a hasta 1.500.000 copias del genoma mitocondrial (que constituye hasta el 90% del ADN de la célula).
Reducción del genoma
reducción del genoma, también conocida como degradación del genoma, es el proceso mediante el cual el genoma de un organismo se reduce en relación con el de sus ancestros. Los genomas fluctúan de tamaño con regularidad y la reducción del tamaño del genoma es más significativa en las bacterias.
Los casos evolutivamente más significativos de reducción del genoma se pueden observar en los orgánulos eucariotas que se sabe derivan de bacterias: mitocondrias y plastidios. Estos orgánulos descienden de endosimbiontes primordiales, que eran capaces de sobrevivir dentro de la célula huésped y que ésta también necesitaba para sobrevivir. Muchas mitocondrias actuales tienen menos de 20 genes en todo su genoma, mientras que una bacteria moderna de vida libre generalmente tiene al menos 1.000 genes. Al parecer, muchos genes se han transferido al núcleo del huésped, mientras que otros simplemente se han perdido y su función ha sido reemplazada por procesos del huésped.
Otras bacterias se han convertido en endosimbiontes o patógenos intracelulares obligados y, como resultado, experimentaron una extensa reducción del genoma. Este proceso parece estar dominado por la deriva genética resultante del pequeño tamaño de la población, bajas tasas de recombinación y altas tasas de mutación, en contraposición a la selección de genomas más pequeños. Algunos bacterioplancton marinos de vida libre también muestran signos de reducción del genoma, que se supone que se debe a la selección natural.
En especies endosimbióticas obligadas
Las especies endosimbióticas obligadas se caracterizan por una total incapacidad para sobrevivir fuera del entorno de su huésped. Estas especies se han convertido en una amenaza considerable para la salud humana, ya que a menudo son capaces de evadir el sistema inmunológico humano y manipular el entorno del huésped para adquirir nutrientes. Una explicación común para estas habilidades manipuladoras es su estructura genómica consistentemente compacta y eficiente. Estos pequeños genomas son el resultado de pérdidas masivas de ADN extraño, un hecho que se asocia exclusivamente con la pérdida de una etapa de vida libre. Hasta el 90% del material genético puede perderse cuando una especie hace la transición evolutiva de un estilo de vida libre a un estilo de vida intracelular obligado. Durante este proceso el futuro parásito se somete a un ambiente rico en metabolitos donde de alguna manera necesita esconderse dentro de la célula huésped, esos factores reducen la retención y aumentan la deriva genética conduciendo a una aceleración de la pérdida de genes no esenciales. Ejemplos comunes de especies con genomas reducidos incluyen Buchnera aphidicola, Rickettsia prowazekii y Mycobacterium leprae. Un endosimbionte obligado de saltahojas, Nasuia deltocephalinicola, tiene el genoma más pequeño conocido actualmente entre los organismos celulares con 112 kb. A pesar de la patogenicidad de la mayoría de los endosimbiontes, algunas especies intracelulares obligadas tienen efectos positivos en la aptitud de sus huéspedes.
El modelo de evolución reductiva se ha propuesto como un esfuerzo por definir las similitudes genómicas observadas en todos los endosimbiontes obligados. Este modelo ilustra cuatro características generales de los genomas reducidos y las especies intracelulares obligadas:
- "genome streamlining" resultante de la selección relajada en genes que son superfluos en el ambiente intracelular;
- a bias towards deletions (rather than insertions), which heavily affects genes that have been disrupted by acumulación of mutations (pseudogenes);
- muy poca o ninguna capacidad para adquirir nuevo ADN; y
- reducción considerable del tamaño efectivo de la población en poblaciones endosimóticas, especialmente en especies que dependen de la transmisión vertical del material genético.
Con base en este modelo, está claro que los endosimbiontes enfrentan diferentes desafíos adaptativos que las especies de vida libre y, como surgió del análisis entre diferentes parásitos, sus inventarios de genes son extremadamente diferentes, lo que nos lleva a la conclusión de que la miniaturización del genoma sigue un patrón diferente para los diferentes simbiontes.
Conversión de picogramos (pg) a pares de bases (pb)
- Número de pares base=masa en pg× × 9.78× × 108{displaystyle {text{number of base pairs}}={text{mass in pg}times 9.78times 10^{8}}
o simplemente:
- 1pg=978 Mbp{displaystyle 1{text{pg}=978{text{ Mbp}}
El gobierno de Drake
En 1991, John W. Drake propuso una regla general: que la tasa de mutación dentro de un genoma y su tamaño están inversamente correlacionados. Se ha descubierto que esta regla es aproximadamente correcta para genomas simples como los de los virus de ADN y los organismos unicelulares. Se desconoce su base.
Se ha propuesto que el pequeño tamaño de los virus de ARN está encerrado en una relación de tres partes entre fidelidad de replicación, tamaño del genoma y complejidad genética. La mayoría de los virus de ARN carecen de una función de corrección de pruebas de ARN, lo que limita su fidelidad de replicación y, por tanto, el tamaño de su genoma. Esto también se ha descrito como la "paradoja propia". Una excepción a la regla del tamaño pequeño del genoma en los virus de ARN se encuentra en los Nidovirus. Estos virus parecen haber adquirido una exoribonucleasa (ExoN) de 3′ a 5′ que ha permitido un aumento en el tamaño del genoma.
Miniaturización genoma y tamaño óptimo
En 1972, Michael David Bennett planteó la hipótesis de que existía una correlación con el contenido de ADN y el volumen nuclear, mientras que Commoner y van't Hoff y Sparrow antes que él postularon que incluso el tamaño celular y la duración del ciclo celular estaban controlados por la cantidad de ADN. . Teorías más recientes nos han llevado a discutir sobre la posibilidad de la presencia de un mecanismo que limite físicamente el desarrollo del genoma a un tamaño óptimo.
Esas explicaciones han sido cuestionadas por el artículo de Cavalier-Smith donde el autor señaló que la forma de entender la relación entre el tamaño del genoma y el volumen celular estaba relacionada con la teoría esquelética. El núcleo de esta teoría está relacionado con el volumen celular, determinado por un equilibrio de adaptación entre ventajas y desventajas de un mayor tamaño celular, la optimización de la relación núcleo:citoplasma (proporción carioplasmática) y el concepto de que los genomas más grandes son más propensos a la acumulación de transposones duplicados como consecuencia de un mayor contenido de ADN esquelético no codificante. Cavalier-Smith también propuso que, como reacción consiguiente de una reducción celular, el núcleo será más propenso a una selección a favor de la deleción en comparación con la duplicación.
Desde el punto de vista económico, dado que el fósforo y la energía son escasos, una reducción del ADN debería ser siempre el foco de la evolución, a menos que se adquiera un beneficio. La eliminación aleatoria será principalmente perjudicial y no se seleccionará debido a la reducción de la aptitud adquirida, pero ocasionalmente la eliminación también será ventajosa. Este equilibrio entre economía y acumulación de ADN no codificante es la clave para el mantenimiento de la proporción carioplasmática.
Mecanismos de miniaturización del genoma
La pregunta básica detrás del proceso de miniaturización del genoma es si se produce a través de grandes pasos o debido a una erosión constante del contenido genético. Para evaluar la evolución de este proceso es necesario comparar un genoma ancestral con aquel en el que se supone que se produjo la contracción. Gracias a la similitud entre el contenido genético de Buchnera aphidicola y la bacteria entérica Escherichia coli, fue posible arrojar luz sobre una identidad del 89% para el ADNr 16S y del 62% para los genes ortólogos. sobre el mecanismo de miniaturización del genoma. El genoma del endosimbionte B. aphidicola se caracteriza por un tamaño de genoma siete veces menor que el de E. coli (643 kb en comparación con 4,6 Mb) y puede verse como un subconjunto del inventario de genes de bacterias entéricas. Del enfrentamiento de los dos genomas surgió que algunos genes persisten parcialmente degradados. indicando que la función se perdió durante el proceso y que los consiguientes eventos de erosión acortaron la longitud como se documenta en Rickettsia. Esta hipótesis se confirma mediante el análisis de los pseudogenes de Buchnera, donde el número de deleciones fue más de diez veces mayor en comparación con la inserción.
En Rickettsia prowazekii, como ocurre con otras bacterias de genoma pequeño, este endosimbionte mutualista ha experimentado una gran reducción de su actividad funcional, con una excepción importante en comparación con otros parásitos que aún conservan la capacidad biosintética de producción de aminoácido que necesita su huésped. Los efectos comunes de la reducción del genoma entre este endosimbionte y los otros parásitos son la reducción de la capacidad de producir fosfolípidos, la reparación y la recombinación y una conversión general de la composición del gen a un contenido de A-T más rico debido a mutaciones y sustituciones. La evidencia de la deleción de la función de reparación y recombinación es la pérdida del gen recA, gen implicado en la vía de la recombinasa. Este evento ocurrió durante la eliminación de una región más grande que contenía diez genes para un total de casi 10 kb. Lo mismo ocurrió con uvrA, uvrB y uvrC, genes que codifican enzimas de escisión implicadas en la reparación del ADN dañado debido a la exposición a los rayos UV.
Uno de los mecanismos más plausibles para la explicación de la reducción del genoma es el reordenamiento cromosómico porque la inserción/eliminación de una porción más grande de la secuencia se observa más fácilmente durante la recombinación homóloga en comparación con la ilegítima, por lo tanto, la propagación de la transposición Los elementos afectarán positivamente la tasa de eliminación. La pérdida de esos genes en las primeras etapas de la miniaturización no sólo desempeña esta función sino que debe desempeñar un papel en la evolución de las consiguientes deleciones. Evidencias del hecho de que se produjo un evento de eliminación más grande antes de una eliminación más pequeña surgieron de la comparación del genoma de Bucknera y un ancestro reconstruido, donde los genes que se perdieron, de hecho, no están dispersos aleatoriamente en el ancestro. gen pero agregado y la relación negativa entre el número de genes perdidos y la longitud de los espaciadores. El evento de pequeños indeles locales juega un papel marginal en la reducción del genoma, especialmente en las primeras etapas donde una mayor cantidad de genes se vuelven superfluos.
En cambio, se produjeron eventos únicos debido a la falta de presión de selección para la retención de genes, especialmente si formaban parte de una vía que perdió su función durante una eliminación previa. Un ejemplo de esto es la eliminación de recF, gen necesario para la función de recA, y sus genes flanqueantes. Una de las consecuencias de la eliminación de tal cantidad de secuencias afectó incluso a la regulación de los genes restantes. De hecho, la pérdida de una gran parte de los genomas podría provocar una pérdida de secuencias promotoras. De hecho, esto podría impulsar la selección de la evolución de regiones policistrónicas con un efecto positivo tanto para la reducción de tamaño como para la eficiencia de la transcripción.
Evidencias de miniaturización del genoma
Un ejemplo de miniaturización del genoma ocurrió en los microsporidios, un parásito intracelular anaeróbico de artrópodos que evolucionó a partir de hongos aeróbicos.
Durante este proceso, los mitosomas se formaron como consecuencia de la reducción de las mitocondrias a una reliquia desprovista de genomas y actividad metabólica, excepto para la producción de centros de hierro y azufre y la capacidad de ingresar a las células huésped. A excepción de los ribosomas, también miniaturizados, muchos otros orgánulos casi se han perdido durante el proceso de formación del genoma más pequeño que se encuentra en los eucariotas. A partir de su posible ancestro, un hongo zigomicotino, los microsporidios encogieron su genoma eliminando casi 1.000 genes y redujeron incluso el tamaño de las proteínas y de los genes codificantes de proteínas. Este proceso extremo fue posible gracias a la ventajosa selección por un menor tamaño celular impuesta por el parasitismo.
Otro ejemplo de miniaturización está representado por la presencia de nucleomorfos, núcleos esclavizados, dentro de la célula de dos algas diferentes, criptofitas y cloraracneas.
Los nucleomorfos se caracterizan por uno de los genomas más pequeños conocidos (551 y 380 kb) y como se observa en microsporidia, algunos genomas son notablemente reducidos en longitud en comparación con otros eucariotas debido a la falta virtual de ADN no codificación. El factor más interesante está representado por la coexistencia de esos pequeños núcleos dentro de una célula que contiene otro núcleo que nunca experimentó tal reducción del genoma. Además, incluso si las células anfitrionas tienen diferentes volúmenes de especies a especies y una consiguiente variabilidad en el tamaño del genoma, el núcleomorfo permanece invariable denotando un doble efecto de selección dentro de la misma célula.

