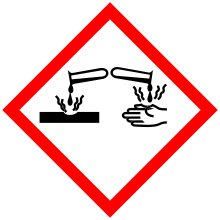
Sustancia corrosiva
Una sustancia corrosiva es aquella que daña o destruye otras sustancias con las que entra en contacto mediante una reacción química.
Etimología
La palabra corrosivo se deriva del verbo latino corrodere, que significa roer, lo que indica cómo estas sustancias parecen " roer" su camino a través de la carne u otros materiales.
Términos químicos
La palabra corrosivo se refiere a cualquier sustancia química que disolverá la estructura de un objeto. Pueden ser ácidos, oxidantes o bases. Cuando entran en contacto con una superficie, la superficie se deteriora. El deterioro puede ocurrir en minutos, p. ácido clorhídrico concentrado derramado sobre la piel; o lentamente durante días o años, p. la oxidación del hierro en un puente.
A veces, la palabra cáustico se utiliza como sinónimo de corrosivo al referirse al efecto sobre los tejidos vivos. A bajas concentraciones, una sustancia corrosiva se denomina irritante, y su efecto sobre los tejidos vivos se denomina irritación. En altas concentraciones, una sustancia corrosiva provoca una quemadura química, un tipo distinto de daño tisular. Los corrosivos se diferencian de los venenos en que los corrosivos son inmediatamente peligrosos para los tejidos con los que entran en contacto, mientras que los venenos pueden tener efectos tóxicos sistémicos que requieren tiempo para manifestarse. Coloquialmente, los corrosivos pueden llamarse venenos pero los conceptos son técnicamente distintos. Sin embargo, no hay nada que impida que un corrosivo sea un veneno; algunas sustancias son tanto corrosivas como venenosas.
La corrosión de superficies no vivas, como los metales, es un proceso distinto. Por ejemplo, una celda electroquímica de agua-aire corroe el hierro hasta óxido, corroe el cobre hasta pátina y corroe el cobre, plata y otros metales para deslustrar.
En el sistema internacional de etiquetas químicas simbólicas, tanto la corrosión rápida de los metales como la corrosión química de la piel califican para el símbolo corrosivo.
Efectos sobre el tejido vivo
Los corrosivos comunes son ácidos fuertes, bases fuertes o soluciones concentradas de ciertos ácidos o bases débiles. Pueden existir en cualquier estado de la materia, incluidos líquidos, sólidos, gases, nieblas o vapores.
Su acción sobre los tejidos vivos (p. ej., piel, carne y córnea) se basa principalmente en reacciones ácido-base de hidrólisis de amidas, hidrólisis de ésteres y desnaturalización de proteínas. Las proteínas (compuestas químicamente por enlaces amida) se destruyen por hidrólisis de amida, mientras que los lípidos (que tienen enlaces de éster) se descomponen por hidrólisis de éster. Estas reacciones conducen a quemaduras químicas y son el mecanismo de destrucción que presentan los corrosivos.
Algunos corrosivos poseen otras propiedades químicas que pueden extender sus efectos corrosivos en los tejidos vivos. Por ejemplo, el ácido sulfúrico (H2SO4) en una alta concentración también es un fuerte agente deshidratante, capaz de deshidratar carbohidratos y liberar calor adicional. Esto da como resultado quemaduras térmicas secundarias además de las quemaduras químicas y puede acelerar sus reacciones de descomposición en la superficie de contacto. Algunos corrosivos, como el ácido nítrico y el ácido sulfúrico concentrado, también son agentes oxidantes fuertes, lo que contribuye significativamente al daño adicional causado. El ácido fluorhídrico no necesariamente causa daño perceptible al contacto, pero produce daño tisular y toxicidad después de ser absorbido sin dolor. Las soluciones de cloruro de zinc son capaces de destruir la celulosa y corroer el papel y la seda, ya que los cationes de zinc en las soluciones atacan específicamente a los grupos hidroxilo, actuando como un ácido de Lewis. Este efecto no se limita a los ácidos; una base tan fuerte como el óxido de calcio, que tiene una fuerte afinidad por el agua (formando hidróxido de calcio, en sí mismo una base fuerte y corrosiva), también libera calor capaz de contribuir a las quemaduras térmicas, así como de proporcionar los efectos corrosivos de un álcali fuerte a la carne húmeda..
Además, algunos productos químicos corrosivos, en su mayoría ácidos como el ácido clorhídrico y el ácido nítrico, son volátiles y pueden emitir neblinas corrosivas al entrar en contacto con el aire. La inhalación puede dañar el tracto respiratorio.
Las sustancias corrosivas son las más peligrosas para la vista. Una gota de un corrosivo puede causar ceguera en 2 a 10 segundos por opacificación o destrucción directa de la córnea.
La ingestión de corrosivos puede inducir consecuencias graves, incluido daño grave del tracto gastrointestinal, que puede provocar vómitos, dolores de estómago intensos y la muerte.
Tipos comunes
Los productos químicos corrosivos comunes se clasifican en:
- Ácidos
- Ácidos fuertes – los más comunes son ácido sulfúrico, ácido nítrico y ácido clorhídrico (H)2SO4, HNO3 y HCl, respectivamente).
- Algunos ácidos débiles concentrados, por ejemplo ácido formico, ácido acético y ácido fósforo
- Ácidos fuertes de Lewis como cloruro de aluminio anhídrido y trifluoruro de hierro
- Ácidos Lewis con reactividad específica; por ejemplo, soluciones de cloruro de zinc
- Ácidos extremadamente fuertes (superácidos)
- Bases
- Caustics or alkalis, such as sodium hydroxide, potassium hydroxide, and calcio hydroxide
- Los metales de Alkali en la forma metálica (por ejemplo, sodio elemental), y los hidratos de metales de tierra alcalinos y alcalinos, como el hidrato de sodio, funcionan como bases fuertes e hidratos para dar caustica
- Bases extremadamente fuertes (superbases) como alkoxides, metal amides (por ejemplo, amida sodio) y bases organometállicas como butillitio
- Salas alcalizadas de ácidos débiles como el fosfato trisódico
- Algunas bases débiles concentradas, tales como amoníaco cuando anhidro o en una solución concentrada
- Agentes deshidratantes como ácido sulfúrico concentrado, pentóxido de fósforo, óxido de calcio, cloruro de zinc anhídrico, también metales alcalinos elementales
- Oxidizadores fuertes como el peróxido de hidrógeno concentrado
- Halógenos electrofilos: fluorina elemental, cloro, bromina y yodo, y sales electrofílicas como hipoclorito de sodio o compuestos N-cloro como cloro-T; iones de halogo no son corrosivos, excepto los fluoruros
- Halides orgánicos y halides ácido orgánico como cloruro de acetil y cloroformato benzyl
- Anhídridos ácidos
- Agentes alquilantes como sulfato de dimetil
- Algunos materiales orgánicos como el fenol ("ácido carbólico")
Equipo de protección personal
Normalmente, se recomienda el uso de equipo de protección personal, incluidos elementos como guantes protectores, delantales protectores, trajes para ácidos, gafas de seguridad, un protector facial o zapatos de seguridad, cuando se manipulan sustancias corrosivas. Los usuarios deben consultar una hoja de datos de seguridad para la recomendación específica de la sustancia corrosiva de interés. El material de construcción del equipo de protección personal también es de importancia crítica. Por ejemplo, aunque los guantes de goma y los delantales de goma pueden estar hechos de un elastómero químicamente resistente, como el caucho de nitrilo, el neopreno o el caucho de butilo, cada uno de estos materiales tiene una resistencia diferente a los diferentes corrosivos y no deben sustituirse entre sí.
Usos
Algunos productos químicos corrosivos se valoran para varios usos, el más común de los cuales es en los agentes de limpieza del hogar. Por ejemplo, la mayoría de los limpiadores de desagües contienen ácidos o álcalis debido a su capacidad para disolver grasas, proteínas o depósitos minerales como la cal dentro de las tuberías de agua.
En usos químicos, a menudo es deseable una alta reactividad química, ya que las velocidades de las reacciones químicas dependen de la actividad (concentración efectiva) de las especies reactivas. Por ejemplo, el ácido sulfúrico catalítico se usa en el proceso de alquilación en una refinería de petróleo: la actividad de los carbocationes, el intermedio reactivo, es mayor cuanto mayor es la acidez y, por lo tanto, la reacción avanza más rápido. Una vez utilizados, los corrosivos suelen reciclarse o neutralizarse. Sin embargo, ha habido problemas ambientales con efluentes corrosivos sin tratar o descargas accidentales.
Contenido relacionado
Isotiocianato
Carbamato de etilo
Cromatografía de exclusión molecular