Sulfato de plomo (II)
sulfato de plomo(II) (PbSO4) es un sólido blanco, que aparece blanco en forma microcristalina. También se le conoce como blanco rápido, blanco de leche, sal de plomo del ácido sulfúrico o anglesita.
A menudo se ve en las placas/electrodos de las baterías de los automóviles, ya que se forma cuando la batería se descarga (cuando se recarga la batería, el sulfato de plomo se transforma nuevamente en plomo metálico y ácido sulfúrico en el terminal negativo o dióxido de plomo y ácido sulfúrico en el terminal positivo). El sulfato de plomo es poco soluble en agua.
Estructura
La Anglesita (sulfato de plomo(II), PbSO4) adopta la misma estructura cristalina ortorrómbica que celestita (sulfato de estroncio, SrSO4) y barita (sulfato de bario, BaSO4). Los tres minerales' Las estructuras están en el grupo espacial Pbnm (número 62). Cada ion plomo (II) está rodeado por 12 átomos de oxígeno de 7 iones sulfato, formando un poliedro PbO12. Las distancias plomo-oxígeno varían de 2,612 Å a 3,267 Å y la distancia promedio es 2,865 Å.
| Coordinación principal | Coordinación de sulfatos |
|---|---|
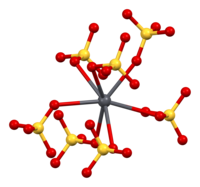 |  |
Fabricación
El sulfato de plomo (II) se prepara tratando óxido, hidróxido o carbonato de plomo con ácido sulfúrico tibio o tratando una sal de plomo soluble con ácido sulfúrico.
Alternativamente, se puede preparar mediante la interacción de soluciones de nitrato de plomo y sulfato de sodio.
Toxicología
El sulfato de plomo es tóxico por inhalación, ingestión y contacto con la piel. Es un veneno acumulativo y la exposición repetida puede provocar anemia, daño renal, daño a la vista o daño al sistema nervioso central (especialmente en niños). También es corrosivo: el contacto con los ojos puede provocar irritaciones graves o quemaduras. El valor límite de umbral típico es 0,15 mg/m3.
Minerales
El mineral natural anglesita, PbSO4, se produce como un producto de oxidación del mineral primario de sulfuro de plomo.
Sulfatos de plomo básicos y de hidrógeno
Se conocen varios sulfatos básicos de plomo: PbSO4·PbO; PbSO4·2PbO; PbSO4·3PbO; PbSO4·4PbO. Se utilizan en la fabricación de pasta activa para baterías de plomo-ácido. Un mineral relacionado es la plomohillita, 2PbCO3·PbSO4·Pb(OH)2.
A alta concentración de ácido sulfúrico (>80%), se forma hidrogenosulfato de plomo, Pb(HSO4)2.
Propiedades químicas
El sulfato de plomo(II) se puede disolver en HNO3, HCl, H2SO4 concentrados, produciendo sales ácidas o compuestos complejos. y en álcali concentrado dando complejos de tetrahidroxidoplumbato(II) [Pb(OH)4]2− solubles.
- PbSO4s) + H2SO4l) ⇌ Pb(HSO)4)2aq)
- PbSO4s) + 4NaOHaq) → Na2[Pb(OH)4]aq) + Na2SO4aq)
El sulfato de plomo (II) se descompone cuando se calienta por encima de 1000 °C:
- PbSO4s) → PbOs) + SO3g)
Aplicaciones
- Baterias de almacenamiento de plomo-ácido
- Pigmentos de pintura
- Reactivo de laboratorio
Contenido relacionado
Oro nórdico
Ácido abiético
Cloroetano