Stent liberador de fármacos
Un stent liberador de fármacos (SLF) es un tubo fabricado con un material similar a una malla que se utiliza para tratar arterias estrechas en procedimientos médicos tanto de forma mecánica (al proporcionar un armazón de soporte dentro de la arteria) como farmacológica (al liberar lentamente un compuesto farmacéutico). Un SLF se inserta en una arteria estrechada utilizando un catéter de administración que generalmente se inserta a través de una arteria más grande en la ingle o la muñeca. El conjunto del stent tiene el mecanismo del SLF unido hacia la parte delantera del stent y, por lo general, está compuesto por el stent colapsado sobre un mecanismo de globo polimérico colapsado; el mecanismo de globo se infla y se utiliza para expandir el stent de malla una vez en posición. El stent se expande y se incrusta en la pared de la arteria ocluida, manteniendo la arteria abierta, mejorando así el flujo sanguíneo. El diseño de la malla permite la expansión del stent y también el crecimiento de nuevas células endoteliales vasculares sanas a través y alrededor de él, asegurándolo en su lugar.
Un DES se diferencia de otros tipos de stents en que tiene un recubrimiento que libera el medicamento directamente en la pared del vaso sanguíneo. El stent libera lentamente un medicamento para evitar el crecimiento de tejido cicatricial y de nuevo material de placa obstructiva que causó la estenosis original del vaso sanguíneo; esta obstrucción del stent se denomina reestenosis. Un DES está completamente integrado con un sistema de administración de catéter y se considera un dispositivo médico integrado.
Los DES se utilizan habitualmente en el tratamiento de las arterias estrechas del corazón (enfermedad de las arterias coronarias), pero también en otras partes del cuerpo, especialmente en las piernas (enfermedad de las arterias periféricas). En las últimas tres décadas, la colocación de stents coronarios se ha convertido en una herramienta de tratamiento mínimamente invasiva primaria para el manejo de la CAD. La colocación de stents en las arterias coronarias está inherentemente vinculada a los procedimientos de intervención coronaria percutánea (ICP). La ICP es un procedimiento mínimamente invasivo que se realiza a través de un catéter (no mediante cirugía a tórax abierto), es el procedimiento médico utilizado para colocar un DES en las arterias coronarias estrechas. Los procedimientos de ICP son realizados por un cardiólogo intervencionista utilizando técnicas de imágenes fluoroscópicas para ver la ubicación de la colocación del DES requerida. La ICP utiliza arterias periféricas más grandes en los brazos o las piernas para introducir un catéter/dispositivo DES a través del sistema arterial y colocar el DES en la arteria o arterias coronarias estrechas. A menudo se utilizan múltiples stents según el grado de bloqueo y la cantidad de arterias coronarias enfermas que se estén tratando.

Diseño
Un stent liberador de fármacos (SLF) es un pequeño tubo de malla que se coloca en las arterias para mantenerlas abiertas durante el tratamiento de enfermedades vasculares. El stent libera lentamente un fármaco para bloquear la proliferación celular, evitando así el estrechamiento arterial que puede producirse después de la implantación del stent. Si bien estos stents se pueden utilizar en varias arterias del cuerpo, se colocan comúnmente en las arterias coronarias para tratar la enfermedad cardíaca coronaria.
El DES es un dispositivo médico con varias propiedades clave: funciona como un andamio estructural, manteniendo físicamente abierta una arteria para asegurar el flujo sanguíneo; el dispositivo tiene características específicas de administración de fármacos, y el fármaco elegido es fundamental para su eficacia: este fármaco, seleccionado por su idoneidad para inhibir la reestenosis y su farmacocinética, es un componente crucial del dispositivo. Aparte del fármaco, los materiales utilizados en la fabricación del dispositivo también son esenciales y se eligen cuidadosamente por su biocompatibilidad y durabilidad en un entorno biológico, como la sangre humana; estos materiales también deben soportar el movimiento constante de los latidos del corazón y ser adecuados para la obtención de imágenes de pacientes futuras mediante tecnologías de resonancia magnética, que emplean campos magnéticos elevados. Los productos DES son dispositivos médicos integrados y forman parte de un sistema de administración de intervención coronaria percutánea (ICP); otros componentes, como el diseño del catéter, también desempeñan un papel importante en la funcionalidad y la eficacia generales del dispositivo.
Los DES suelen estar compuestos de aleaciones metálicas, más comúnmente acero inoxidable o cromo-cobalto, pero también pueden estar hechos de otros materiales como platino-cromo o níquel-titanio. El stent suele estar recubierto con un polímero para controlar la liberación de fármacos. El papel de los polímeros en la administración de fármacos es crucial, ya que regulan la velocidad a la que el fármaco se libera en el tejido circundante. También existen stents sin polímeros en los que el fármaco se recubre directamente sobre el stent o se encuentra contenido en reservorios dentro del stent.
El diseño del stent incluye puntales, que son estructuras de alambre delgadas que forman el marco del stent. El grosor de los puntales puede influir en el rendimiento del stent; los puntales más delgados generalmente se asocian con tasas de reestenosis más bajas y un menor riesgo de trombosis.
La mayoría de los stents DES son expandibles mediante balón, lo que significa que se montan en un catéter con balón y se expanden cuando el balón se infla. También existen stents autoexpandibles, que se expanden automáticamente cuando se despliegan. El primer stent, introducido en 1986, era de este tipo; la malla del tubo del stent se pliega inicialmente sobre el catéter; en este estado plisado, es lo suficientemente pequeño como para pasar a través de arterias relativamente estrechas y luego se expande en su lugar de destino, presionando firmemente contra la pared arterial enferma.
Los compuestos farmacéuticos que emite el DES son agentes antiproliferativos como el sirolimus, everolimus, zotarolimus, paclitaxel y biolimus. Estos fármacos ayudan a prevenir el estrechamiento arterial que puede producirse tras la implantación del stent. Estos fármacos también se utilizan para otros fines, que implican moderar el sistema inmunitario o tratar el cáncer. Actúan inhibiendo el crecimiento celular. En el caso del DES, se utilizan en cantidades muy pequeñas y durante un breve periodo de tiempo, y sólo en la zona donde se coloca el stent.
Existe una distinción entre los stents coronarios y los stents periféricos. Si bien ambos se utilizan para prevenir el estrechamiento de las arterias, los stents coronarios se utilizan específicamente en las arterias coronarias, mientras que los stents periféricos se utilizan en cualquier otra arteria del cuerpo. Los stents periféricos son en su mayoría de metal desnudo; algunos DES periféricos, del tipo autoexpandible, se utilizan en las arterias de las piernas.
Los DES biorreabsorbibles están hechos de materiales que pueden ser absorbidos por el cuerpo con el tiempo, lo que reduce potencialmente las complicaciones a largo plazo asociadas con los stents permanentes.
Usos

Aterosclerosis: fondo general
La aterosclerosis es una enfermedad crónica que afecta a las arterias de calibre grande y mediano. Se caracteriza por la acumulación de calcio, grasas (como el colesterol) y otras sustancias en la capa más interna del endotelio, una capa de células que recubre la superficie interior de los vasos sanguíneos. La aterosclerosis se considera la forma más común de arteriosclerosis, que se refiere a la pérdida de elasticidad arterial causada por el engrosamiento y endurecimiento de los vasos sanguíneos.
La aterosclerosis puede comenzar en la infancia con el desarrollo de pequeñas "estrías grasas" dentro de las arterias. Estas estrías son esencialmente depósitos de grasa. Con el tiempo, estas lesiones iniciales se hacen más grandes y más gruesas, formando ateromas (placas ateroscleróticas).
Los stents liberadores de fármacos (SLF) se utilizan en el tratamiento de la aterosclerosis tanto en intervenciones coronarias como en intervenciones arteriales periféricas:
- En las intervenciones coronarias, los DES se utilizan para tratar la enfermedad coronaria, causada principalmente por la aterosclerosis. Los stents se insertan en arterias coronarias estrechas y luego se expanden para abrir la arteria estrecha. El compuesto de drogas liberado por los stents suprime el crecimiento celular en el área recién stente, reduciendo el potencial de bloqueo dentro del área de stent.
- En las intervenciones arteriales periféricas, los DES se han establecido como la opción de abordar la enfermedad arterial periférica sintomática (PAD). Estos stents altamente eficaces se despliegan en el tratamiento de la enfermedad oclusiva arterial periférica (PAOD), una afección que comparte resemblancos con la enfermedad coronaria pero afecta específicamente a las arterias periféricas. Al emplear DES, los profesionales de la salud pueden proporcionar atención e intervención óptimas para administrar PAOD, mejorando en última instancia los resultados de los pacientes y mitigar las complicaciones asociadas.
Los DES desempeñan un papel crucial en el tratamiento de la aterosclerosis, tanto en intervenciones coronarias como arteriales periféricas. Ayudan a mejorar el flujo sanguíneo y reducen el riesgo de reestenosis, mejorando así los resultados del paciente. El uso de DES se acompaña de un tratamiento médico adecuado y modificaciones del estilo de vida para tratar la aterosclerosis de manera eficaz.
Estenosis y reininosis de los vasos sanguíneos
La estenosis de los vasos sanguíneos se refiere al estrechamiento de los vasos sanguíneos, que puede restringir el flujo sanguíneo a los órganos y tejidos. Esta afección suele estar causada por la acumulación de depósitos grasos en las arterias, un proceso también llamado aterosclerosis.
En el contexto de los stents, la estenosis es un problema importante. Los stents se insertan en una arteria estrecha durante un procedimiento conocido como angioplastia. Los stents ayudan a abrir la arteria estrechada y mejorar el flujo sanguíneo. Sin embargo, con el tiempo, la arteria tratada puede cerrarse nuevamente, una afección conocida como reestenosis.
La reestenosis, o reestenosis intrastent, es un bloqueo o estrechamiento que reaparece en la parte de la arteria tratada previamente con un stent. La reestenosis suele ocurrir entre tres y seis meses después del procedimiento. Es incluso más probable que ocurra si no se hubiera utilizado un stent.
Cuando se produce una reestenosis, puede ser necesario otro procedimiento para corregir el problema, como la colocación de un DES que libera gradualmente un compuesto farmacológico que suprime el crecimiento celular, reduciendo así la posibilidad de bloqueo dentro del área del stent. Esta terapia reduce significativamente la aparición de eventos adversos posteriores a la colocación del stent.
Técnicamente, un dispositivo de implante de DES en un tubo de malla se utiliza en procedimientos de angioplastia para tratar la estenosis de los vasos sanguíneos y prevenir la restinosis: el stent, que libera fármacos, se implanta en el vaso sanguíneo para ayudar a mantener el vaso abierto y mejorar el flujo sanguíneo. Específicamente, los stents liberadores de fármacos se utilizan en el tratamiento de varias afecciones médicas, generalmente en el sitio de lesiones arteriales estenóticas u oclusivas, pero uno de los usos médicos principales es en el tratamiento de la enfermedad de la arteria coronaria. Los stents se insertan en arterias coronarias estrechas, donde el estrechamiento es causado principalmente por la aterosclerosis. Luego, los stents se expanden para abrir la arteria estrechada. Estos stents liberan gradualmente un compuesto farmacológico que suprime el crecimiento celular en el área recién implantada, reduciendo así el potencial de bloqueo dentro del área del stent. Este bloqueo se denomina reestenosis intrastent (ISR). Este bloqueo del stent suele deberse a una proliferación celular excesiva o a trombos (coágulos de sangre). La terapia anticoagulante (diluyentes sanguíneos) se ha convertido en un tratamiento estándar después de la colocación de un DES. Esta terapia reduce significativamente la aparición de eventos adversos posteriores a la colocación de un stent.
Intervenciones coronarias
Los DES han desempeñado un papel transformador en el tratamiento de la enfermedad de las arterias coronarias. Estos stents son tubos de malla diminutos y flexibles que se emplean durante la intervención coronaria percutánea (ICP) para tratar las arterias coronarias estrechadas. Lo que los distingue es su recubrimiento especial, que incorpora un sistema de administración de fármacos que permite la liberación controlada de la medicación durante un período específico, normalmente dentro de los primeros 30 a 45 días posteriores a la implantación. Este medicamento desempeña un papel crucial en la inhibición de la formación de tejido cicatricial dentro del stent y el posterior estrechamiento del vaso sanguíneo.
La PCI es un procedimiento mínimamente invasivo que implica la colocación de un stent liberador de fármacos (DES) en una arteria coronaria. Este procedimiento, anteriormente conocido como angioplastia con stent, se considera no quirúrgico ya que se realiza a través de una pequeña punción en una arteria periférica, lo que evita la necesidad de abrir la pared torácica. Si bien el sangrado en el lugar de la punción alguna vez fue una preocupación, los avances en las prácticas de PCI han mitigado este problema mediante el uso de bandas de presión y sistemas de cierre arterial. Los procedimientos modernos de DES/PCI generalmente son indoloros, aunque pueden experimentarse algunas molestias leves. En la PCI, a veces se implantan múltiples DES en un solo paciente; la decisión de utilizar múltiples stents generalmente depende de la extensión de la enfermedad de la arteria coronaria presente y la cantidad de arterias coronarias enfermas que requieren tratamiento.
Intervenciones arteriales periféricas
Los DES han surgido como el principal enfoque terapéutico para el manejo de la enfermedad arterial periférica sintomática (EAP). Estos stents especializados se utilizan ahora ampliamente en el tratamiento de la enfermedad arterial periférica oclusiva (EAOP), una afección que comparte similitudes con la enfermedad de la arteria coronaria pero que afecta las arterias periféricas. Al implementar DES, los profesionales de la salud pueden abordar y aliviar de manera efectiva las complicaciones asociadas con la EAP, mejorando los resultados y la calidad de vida de los pacientes. El uso de DES en intervenciones arteriales periféricas ha mostrado resultados alentadores en términos de permeabilidad primaria (PP) y revascularización de la lesión diana (TLR) en comparación con los stents de metal desnudo (BMS).
Existen distintos tipos de DES en el mercado, cada uno con distintas concentraciones de fármacos y con distinta eficacia. Entre los distintos DES, se ha comprobado que los stents liberadores de sirolimus y los stents liberadores de everolimus son más eficaces que los stents liberadores de paclitaxel.
Indicaciones clínicas
Se considera la colocación de un stent y una intervención coronaria percutánea cuando una persona muestra signos de flujo sanguíneo reducido en las arterias que irrigan el corazón o cuando las pruebas, como diferentes tipos de imágenes de las arterias coronarias, muestran un bloqueo en esas arterias.
Los síntomas pueden incluir:
- severo, presión-como dolor torácico sin aliviar por el descanso;
- falta de aliento, fatiga, ligereza;
- palpitaciones;
- síntomas atípicos: náuseas, vómitos, indigestión, confusión, dolor de espalda.
En el ámbito médico, no resulta muy útil que los médicos se basen únicamente en lo que las personas dicen sobre el origen de su dolor o cómo se siente, porque la forma en que las personas describen el dolor en el pecho causado por la reducción del flujo sanguíneo al corazón puede variar mucho y puede no coincidir con lo que se enseña habitualmente en la educación médica o se describe en libros y artículos.
Contraindicaciones
El DES no se recomienda en algunos casos, ya que puede causar más daño que beneficio. El DES no es adecuado:
- cuando los individuos tienen una tendencia sangrante;
- cuando una arteria coronaria no tiene un estrechamiento claro e identificable;
- cuando sólo una arteria coronaria enferma suministra sangre oxigenada al músculo cardíaco. Durante la colocación de stent, hay un corto período de bloqueo del flujo sanguíneo por la inflación del globo. Este tiempo de bloqueo es a menudo más de veinte segundos para permitir que el DES se expanda e incruste en la pared arterial. En este caso, esta vez puede ser demasiado larga y causar eventos graves debido a la falta de sangre al músculo cardíaco.
Los trastornos hemorrágicos hacen que el uso de DES no sea adecuado debido a la necesidad de medicamentos anticoagulantes (diluyentes de la sangre) durante el procedimiento y en el cuidado posterior a la colocación del stent. Otros factores que podrían descartar el uso de stents incluyen antecedentes de bloqueo en el stent, problemas de sangrado, anatomía coronaria compleja o inadecuada o una expectativa de vida corta debido a otras afecciones médicas graves.
Riesgos y complicaciones
Riesgos del procedimiento
Los riesgos de la colocación de stents incluyen hemorragia, reacciones alérgicas a los agentes de contraste utilizados para visualizar las arterias coronarias e infarto de miocardio. Con la intervención coronaria percutánea (ICP), la necesidad de una cirugía de derivación de la arteria coronaria de emergencia ha disminuido a medida que se han introducido mejores prácticas. En algunas situaciones, la colocación de stents coronarios está permitida en hospitales sin instalaciones de cirugía cardíaca, pero dicha autorización sigue siendo controvertida debido al riesgo poco frecuente pero impredecible de perforación de la arteria coronaria.
Riesgos de trombosis stent
Una complicación de la colocación de un stent coronario es la trombosis del stent (coágulos de sangre). Esto ocurre cuando se forma un nuevo coágulo dentro del stent y obstruye el flujo sanguíneo, lo que provoca un ataque cardíaco.
Riesgos de reestenosis in-stent (ISR)
Los DES fueron diseñados específicamente para combatir los problemas de reestenosis que se producían con los stents metálicos antiguos (BMS). Aunque es menos frecuente con los stents liberadores de fármacos, aún puede producirse reestenosis.
Desde la aparición de la tecnología DES, la incidencia de ISR ha disminuido significativamente.
Uso fuera del alcance de la aprobación reglamentaria típica
Se ha demostrado que los DES son superiores a los BMS en la reducción de las complicaciones a corto plazo de la colocación de stents en los injertos de vena safena. Sin embargo, el uso de DES en injertos de bypass no era su uso previsto originalmente ni estaba dentro del alcance de la aprobación regulatoria original (FDA de EE. UU., Agencia Europea de Medicamentos, etc.). La práctica de usar un dispositivo médico o medicamento de una manera no especificada en la etiqueta original o actual a menudo se conoce como uso "fuera de etiqueta".
En las regiones donde la colocación de stents cardíacos se ha vuelto algo común, los grupos de expertos y de defensa de los derechos de los pacientes expresan su preocupación por el uso excesivo de los stents, porque los pacientes que recibieron stents por razones no aprobadas a menudo tienen peores resultados en comparación con los pacientes que recibieron stents para usos aprobados.
Procedimiento clínico
Colocación de DES

Las personas que reciben un stent coronario tienen diferentes necesidades según su estado de salud. Algunos pacientes están sufriendo un ataque cardíaco y necesitan atención de emergencia inmediata para salvarles la vida. Otros pacientes tienen un alto riesgo de sufrir un ataque cardíaco en un futuro muy cercano. Para las personas de cada uno de estos grupos, los procedimientos de ICP pueden variar levemente, con modificaciones particulares en cuanto a cómo se los seda, el manejo del dolor y cuestiones más amplias de cuidados intensivos, como el soporte respiratorio.
Muchas personas que no se encuentran en situaciones de cuidados críticos suelen estar completamente despiertas durante el procedimiento de ICP y la colocación del DES, pero reciben anestesia local en el lugar de entrada del catéter para garantizar que no sientan dolor. Las distintas instituciones médicas y los profesionales utilizan diferentes prácticas de sedación y manejo del dolor, pero la comodidad del paciente siempre es una consideración primordial.
El sistema de catéter/stent se inserta en el cuerpo perforando una arteria periférica (una arteria del brazo o la pierna) y se desplaza a través del sistema arterial para administrar el DES a la arteria coronaria bloqueada. Luego, el stent se expande para ensanchar (abrir) las arterias coronarias bloqueadas o estrechadas (estrechadas por la acumulación de placa), causadas por una afección llamada aterosclerosis. El acceso arterial periférico suele realizarse a través de la arteria femoral (parte superior de la pierna) o la arteria radial (brazo o muñeca) y, con menos frecuencia, a través de la arteria braquial o cubital (muñeca o brazo). En el pasado, controlar el sangrado en el punto de acceso arterial después del procedimiento era un problema. Ahora existen bandas de presión arterial modernas y sistemas de cierre arterial que han ayudado a controlar el sangrado después del procedimiento, pero sigue siendo una preocupación.
Los sistemas modernos de catéter/stent son dispositivos médicos integrados, compuestos por un alambre guía, un catéter, un balón y un stent. La malla del tubo del stent se pliega inicialmente sobre el balón del dispositivo y es lo suficientemente pequeña como para pasar a través de arterias periféricas relativamente estrechas. Una vez en posición, el balón se infla introduciendo solución salina fisiológica, lo que empuja el stent superpuesto firmemente hacia la pared de la arteria enferma. Durante este procedimiento de colocación se registran el tiempo y la presión de inflado. Después de la colocación, se desinfla el balón y se retira el dispositivo del cuerpo, dejando el stent expandido en su lugar y abriendo la arteria.
El cardiólogo intervencionista decide cómo tratar la obstrucción de la mejor manera durante la colocación del stent, basándose en datos en tiempo real. El cardiólogo utiliza datos de imagen proporcionados tanto por la ecografía intravascular (IVUS) como por la imagen fluoroscópica (combinada con un colorante radiopaco). Durante el procedimiento, la información obtenida de estas dos fuentes permite al cardiólogo seguir la trayectoria del dispositivo catéter-DES a medida que se mueve a través de los vasos sanguíneos arteriales. Esta información también ayuda a determinar tanto la ubicación como las características de cualquier placa que cause estrechamiento en las arterias. Los datos de estas dos técnicas se utilizan para colocar correctamente el stent y obtener información detallada relacionada con la anatomía de la arteria coronaria. Dado que esta anatomía varía mucho entre individuos, tener esta información se vuelve crucial para un tratamiento eficaz. Los datos obtenidos se graban en video y pueden usarse en casos en los que se necesite un tratamiento adicional.
Recuperación y rehabilitación después de la observación
Para muchas personas, el procedimiento de colocación de stent no requiere permanecer en el hospital durante un período prolongado; la mayoría de las personas abandonan el hospital el mismo día. La mayor parte del tiempo inmediatamente posterior a la colocación de stent se pasa en una sala de recuperación para asegurarse de que el sitio de acceso no esté sangrando y de que los signos vitales estén estables.
En la mayoría de los hospitales, el cardiólogo intervencionista que realizó el procedimiento hablará directamente con el paciente y su familia y les dará información sobre cómo fue todo y las instrucciones de seguimiento. El personal de enfermería vigilará el estado de la persona y utilizará herramientas como el ECG para controlar su corazón. Para evitar que se forme un coágulo de sangre en el stent, se administran medicamentos inmediatamente después del procedimiento. Un medicamento común es Plavix, que es un potente anticoagulante que se presenta en forma de píldora. También se utilizan otros medicamentos que diluyen la sangre y es habitual combinar aspirina con Plavix. En el caso de las personas que han tenido un ataque cardíaco, la duración de la hospitalización depende del grado de daño al músculo cardíaco causado por el evento.
Un catéter con DES es un dispositivo médico, por lo que a las personas que lo reciben se les entrega una tarjeta de dispositivo médico. Esta tarjeta tiene información sobre el DES implantado y un número de serie del dispositivo médico. Esta información es importante para futuros procedimientos médicos, porque ayuda a los médicos a saber qué tipo de dispositivo está en el cuerpo de la persona. Algunos sistemas de cierre arterial, que son dispositivos que ayudan a sellar el sitio de acceso después del procedimiento, también son dispositivos médicos y tienen sus propias tarjetas informativas.
El sitio de acceso es el lugar donde el catéter ingresa a la arteria del brazo o la pierna. Generalmente, hay dolor y hematomas en este sitio. Estos hematomas y dolores suelen mejorar después de una semana aproximadamente. Se recomienda a las personas que descansen durante una semana o dos y que no levanten objetos pesados. Esto es principalmente para asegurarse de que el sitio de acceso se cure bien. Es normal tener citas de seguimiento con un cardiólogo o un médico de atención primaria/médico general dentro de una semana o dos después del procedimiento.
Las personas que reciben un stent coronario suelen tener más controles cada tres a seis meses durante el primer año, pero esto puede variar. Por lo general, no necesitan otra angiografía coronaria, que es una prueba que utiliza un tinte especial y rayos X para ver las arterias del corazón. Si los médicos sospechan que la enfermedad cardíaca está empeorando, pueden recetar una prueba de esfuerzo, que es una prueba que mide cómo funciona el corazón durante la actividad física. Las personas que tienen síntomas o muestran signos de flujo sanguíneo reducido al corazón en una prueba de esfuerzo pueden necesitar un nuevo cateterismo cardíaco diagnóstico.
Después de los procedimientos de colocación de stents mediante PCI, los exámenes físicos son importantes. Las personas que tienen un alto riesgo de complicaciones o problemas coronarios más complejos pueden necesitar una angiografía. Esto puede suceder incluso si los resultados de las pruebas de esfuerzo no invasivas, que son pruebas que miden cómo funciona el corazón durante la actividad física, parecen normales.
Las actividades de rehabilitación cardíaca dependen de muchos factores, pero principalmente de cuánto daño sufrió el músculo cardíaco antes del procedimiento PCI/DES. Muchas personas que se someten a este procedimiento no han tenido un ataque cardíaco y su corazón puede estar bien. Otras pueden haber tenido un ataque cardíaco y su corazón puede tener problemas para bombear sangre rica en oxígeno al cuerpo. Las actividades de rehabilitación se adaptan a las necesidades de cada persona.
Eficacia
Beneficios
Los DES son una mejora con respecto a los dispositivos BMS más antiguos, ya que reducen las posibilidades de bloqueos en el stent. Esto reduce la incidencia de eventos graves posteriores a la colocación del stent, como la aparición o recurrencia de angina, ataques cardíacos y muerte. También reducen la probabilidad de requerir otro procedimiento de ICP para abrir un bloqueo causado por el propio stent.
El principal beneficio de los stents liberadores de fármacos (SLF) en comparación con los stents metálicos (SMB) es la prevención de la reestenosis intrastent (ISR). La reestenosis es un estrechamiento gradual del segmento en el que se ha colocado el stent y que se produce con mayor frecuencia entre 3 y 12 meses después de la colocación del stent. Las altas tasas de reestenosis asociadas con los SMB impulsaron el desarrollo de los SLF, lo que dio como resultado una reducción de la incidencia de ISR a alrededor del 5-10%. El desarrollo continuo de SLF de nueva generación ha dado como resultado la casi eliminación de los SMB de la práctica clínica.
Resultados del procedimiento
Un beneficio clave del uso de DES en comparación con BMS es una menor incidencia de procedimientos repetidos de revascularización (re-colocación de stent, cirugías de bypass invasivas, etc.). Los procedimientos de revascularización son tratamientos que restablecen el flujo sanguíneo a las partes del corazón que no reciben suficiente sangre, un problema llamado isquemia. Esto puede suceder debido a la acumulación de placa en las arterias del corazón, que puede estrecharlas o bloquearlas. Las tasas de revascularizaciones repetidas y trombosis del stent (coágulos de sangre) son significativamente más bajas en aquellos que recibieron DES en comparación con BMS.
Las nuevas generaciones de dispositivos DES han mejorado sustancialmente los resultados de seguridad, específicamente en lo que respecta a la trombosis del stent, los infartos de miocardio recurrentes y la muerte.
Consideraciones relativas a la presentación, evaluación y aprobación reglamentarias
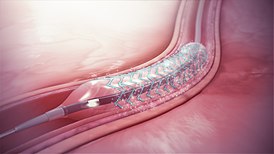
Existen varias consideraciones de diseño de dispositivos médicos muy detalladas para productos DES, que se incluyen en las presentaciones para aprobación ante autoridades regulatorias como la FDA de EE. UU.:
- Aspectos del diseño que se relacionan con un DES como dispositivos estructurales que mantienen una arteria abierta por medios puramente físicos.
- Elección de los materiales de construcción, con especial énfasis en biocompatibilidad, longevidad en el cuerpo humano, resistencia al estrés mecánico y la idoneidad del material elegido para futuras imágenes de pacientes utilizando tecnologías de resonancia magnética, debido a los altos campos magnéticos utilizados en tales imágenes.
- Elección de un mecanismo de liberación de drogas: cuánto dura el medicamento, y cómo hacer que el stent libere el medicamento de una manera que inhibe la reestenosis in-stent.
- Elección del agente químico que el stent entregará.
- Elección de la tecnología de entrega de stent como sistema integrado: diseño de catéter, visualización de colocación y evaluación del éxito de la reperfusión de arterias (es la arteria tratada que realmente proporciona músculo cardíaco con suficiente sangre oxigenada).
- Consideraciones de garantía de calidad como las definidas en ISO 13485.
- Consideraciones de control de calidad: qué pruebas se pueden realizar en cada unidad fabricada antes de la puesta en venta para demostrar su idoneidad de uso.
- Problemas de trazabilidad, se puede rastrear un único stent del fabricante al paciente en el que fue implantado. En el caso de un recuerdo de un producto es fundamental poder rastrear el stent del diseño, fabricación y distribución al paciente.
La elección del fármaco es un elemento de diseño fundamental y determinar su verdadera eficacia para inhibir el crecimiento neointimal debido a la proliferación de células musculares lisas que provocarían reestenosis puede ser un desafío de diseño. Gran parte de la hiperplasia neointimal parece estar causada por la inflamación.
Los stents vasculares están clasificados por los EE. UU. como dispositivos médicos de clase III, lo que significa que representan el mayor riesgo para los pacientes y están sujetos tanto a aprobación general como previa a la comercialización, lo que requiere ensayos clínicos y evidencia científica de seguridad y eficacia, así como pruebas mecánicas rigurosas. Durante el proceso de prueba mecánica, las máquinas de prueba universales inducen flexión, estiramiento, torsión y ejercen presión sobre los stents vasculares desde varios ángulos.
Las propiedades específicas de cada tipo de stent y su uso previsto dependen de los resultados de las pruebas, y viceversa: los distintos tipos de stents pueden necesitar pruebas diferentes o adicionales según el lugar del cuerpo en el que se colocarán y para qué se utilizarán. Algunas de estas pruebas adicionales pueden incluir comprobar la resistencia del stent a aplastamientos o deformaciones, su resistencia a las torceduras, si resiste la corrosión o los daños con el paso del tiempo, así como comprobar que los revestimientos del dispositivo permanezcan intactos.
Alternativas a los procedimientos de stent
La terapia farmacológica para la enfermedad de la arteria coronaria puede estar indicada en lugar del tratamiento invasivo o además de este. En aquellos pacientes que requieren una intervención coronaria percutánea o una cirugía, la terapia médica debe considerarse como un complemento de los procedimientos de revascularización, en lugar de una estrategia opuesta. La cirugía de bypass de la arteria coronaria (CABG, por sus siglas en inglés) es una alternativa a la intervención coronaria percutánea (ICP) con stents liberadores de fármacos (DES, por sus siglas en inglés) para pacientes con disfunción sistólica del ventrículo izquierdo (DSVI) isquémica. La CABG se asocia con menores riesgos de mortalidad por todas las causas, revascularización repetida e infarto de miocardio en comparación con la ICP. Sin embargo, no hay una diferencia significativa entre los dos procedimientos en términos de mortalidad cardiovascular, accidente cerebrovascular, eventos cardiovasculares y cerebrovasculares adversos mayores y taquicardia ventricular.
Historia
El primer procedimiento para tratar las arterias coronarias obstruidas fue la cirugía de bypass de la arteria coronaria (CABG), en la que se utiliza una sección de vena o arteria de otra parte del cuerpo para hacer un bypass del segmento enfermo de la arteria coronaria. En 1977, Andreas Grüntzig introdujo la angioplastia coronaria transluminal percutánea (ACTP), también llamada angioplastia con balón, en la que se introducía un catéter a través de una arteria periférica y se expandía un balón para dilatar el segmento estrechado de la arteria.
A medida que los equipos y las técnicas mejoraron, el uso de la angioplastia coronaria transluminal percutánea aumentó rápidamente y, a mediados de los años 1980, la angioplastia coronaria transluminal percutánea y la cirugía de derivación coronaria se realizaban en tasas equivalentes. La angioplastia con balón fue generalmente eficaz y segura, pero la reestenosis fue frecuente y se produjo en alrededor del 30-40% de los casos, generalmente dentro del primer año después de la dilatación. En alrededor del 3% de los casos de angioplastia con balón, el fracaso de la dilatación y el cierre agudo o amenaza de cierre de la arteria coronaria (a menudo debido a una disección) motivaron la realización de una cirugía de derivación coronaria de emergencia.
Charles Theodore Dotter y Melvin Judkins propusieron en 1964 el uso de dispositivos protésicos en el interior de las arterias de las piernas para mantener el flujo sanguíneo después de la dilatación. En 1986, Puel y Sigwart implantaron el primer stent coronario en un paciente humano. Varios ensayos realizados en la década de 1990 demostraron la superioridad de la colocación de stents sobre la angioplastia con balón. La reestenosis se redujo porque el stent actuó como un andamio para mantener abierto el segmento dilatado de la arteria. El cierre agudo de la arteria coronaria (y la necesidad de una cirugía de revascularización coronaria de emergencia) se redujo, porque el stent reparó las disecciones de la pared arterial. En 1999, los stents se utilizaban en el 84% de las intervenciones coronarias percutáneas (es decir, las realizadas a través de un catéter y no mediante cirugía a tórax abierto).
Entre las dificultades iniciales que presentaban los stents coronarios estaba el riesgo de trombosis precoz (coagulación) que provocaba la oclusión del stent. El recubrimiento de los stents de acero inoxidable con otras sustancias, como platino u oro, no eliminaba este problema. La expansión del stent con balón a alta presión para asegurar su total aposición a la pared arterial, combinada con una terapia farmacológica con aspirina y otro inhibidor de la agregación plaquetaria (normalmente ticlopidina o clopidogrel), casi eliminó este riesgo de trombosis precoz del stent.
Aunque se produjo con menos frecuencia que con la angioplastia con balón u otras técnicas, los stents siguieron siendo vulnerables a la reestenosis, causada casi exclusivamente por el crecimiento de tejido neointimal (formación de tejido en la estructura interna del "tubo" de la arteria). Para abordar este problema, los desarrolladores de stents liberadores de fármacos utilizaron los propios dispositivos como una herramienta para administrar medicamentos directamente a la pared arterial. Si bien los esfuerzos iniciales no tuvieron éxito, en 2001 se demostró que la liberación (elución) de fármacos con ciertas propiedades fisicoquímicas específicas desde el stent lograba altas concentraciones del fármaco localmente, directamente en la lesión diana, con efectos secundarios sistémicos mínimos. Tal como se utiliza actualmente en la práctica clínica, los stents "liberadores de fármacos" se refieren a stents metálicos que liberan un fármaco diseñado para limitar el crecimiento de tejido cicatricial neointimal, reduciendo así la probabilidad de reestenosis del stent.
El primer tipo de DES que fue aprobado por la Agencia Europea de Medicamentos (EMA) y la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) fueron los stents liberadores de sirolimus (SES), que liberan un producto natural llamado sirolimus, un fármaco inmunosupresor. Se demostró que los SES reducen la necesidad de procedimientos repetidos y mejoran los resultados de los pacientes con enfermedad de la arteria coronaria. El stent liberador de sirolimus Cypher recibió la aprobación de la marca CE en Europa en 2002, y luego se sometió a un ensayo más amplio para demostrar su seguridad y eficacia para el mercado estadounidense. El ensayo, publicado en 2003, inscribió a 1058 pacientes con lesiones más complejas y confirmó la superioridad de los SES sobre los stents de metal desnudo en términos de resultados angiográficos y clínicos. Basándose en estos resultados, el stent Cypher recibió la aprobación de la FDA y se comercializó en los EE. UU. en 2003. El proceso de aprobación de la FDA para el DES implica la presentación de una solicitud de exención de dispositivo en investigación (IDE) para realizar ensayos clínicos de conformidad con la Parte 812 del Título 21 del CFR y, a continuación, una solicitud de aprobación previa a la comercialización (PMA) para obtener la autorización de comercialización de conformidad con la Parte 8144 del Título 21 del CFR. La FDA asigna la responsabilidad principal de revisión al Centro de Dispositivos y Salud Radiológica (CDRH), pero también consulta con el Centro de Evaluación e Investigación de Medicamentos (CDER) para el componente farmacológico del producto combinado.
El segundo tipo de DES que fue aprobado por la EMA y la FDA fueron los stents liberadores de paclitaxel (PES), que liberan otro producto natural llamado paclitaxel. Los PES también redujeron la necesidad de procedimientos repetidos y mejoraron los resultados de los pacientes con diferentes tipos de lesiones y factores de riesgo. El stent liberador de paclitaxel Taxus recibió la aprobación de la FDA y se lanzó en los EE. UU. en 2004, después de una serie de ensayos que lo compararon con un stent de metal desnudo en varios entornos. Los ensayos mostraron una reducción significativa en la revascularización de la lesión diana y eventos cardíacos adversos importantes con el stent Taxus a los 9 y 12 meses. Tanto los SES como los PES utilizan productos naturales como agentes activos para prevenir la recurrencia de bloqueos en las arterias. Estos DES han cambiado la práctica de la cardiología intervencionista y se han convertido en el tratamiento preferido para muchos pacientes con enfermedad de la arteria coronaria.
La rápida aceptación inicial de los DES condujo a su uso máximo en 2005, representando el 90% de todos los implantes de stents, pero las preocupaciones sobre la trombosis tardía del stent condujeron a una disminución en el uso de DES a fines de 2006. Estudios posteriores tranquilizaron a la comunidad médica sobre su seguridad, mostrando que si bien los DES pueden tener un riesgo ligeramente mayor de trombosis muy tardía del stent, reducen significativamente la revascularización del vaso diana sin aumentar la incidencia de muerte o infarto de miocardio; estas garantías llevaron a un resurgimiento en el uso de DES, aunque no alcanzó las tasas de uso máximo observadas a principios de 2006.
El concepto de utilizar materiales absorbibles (también llamados biodegradables, bioabsorbibles o biorreabsorbibles) en stents fue reportado por primera vez en 1878 por Huse, quien utilizó alambres de magnesio como ligaduras para detener el sangrado en los vasos de tres pacientes. A pesar de una extensa búsqueda, el nombre completo de este pionero en el campo sigue siendo difícil de encontrar. En el siglo XX, la empresa Igaki Medical Planning Company en Japón desarrolló un stent reabsorbible probado en humanos y fue construido a partir de ácido poli-L-láctico (una forma de ácido poliláctico); publicaron sus resultados iniciales en 2000. La empresa alemana Biotronik desarrolló un stent absorbible (biorreabsorbible) de magnesio y publicó los resultados clínicos en 2007.
La primera empresa que introdujo en el mercado un stent biorreabsorbible fue Abbott Vascular, que recibió la aprobación para su comercialización en Europa en septiembre de 2012; la segunda fue Elixir, que recibió la marca CE en mayo de 2013.
A pesar de la promesa inicial, los stents bioabsorbibles de primera generación, como el stent bioabsorbible Absorb de Abbott, enfrentaron desafíos significativos en su desempeño. En comparación con los stents liberadores de fármacos de la generación actual, numerosos ensayos revelaron que estos stents bioabsorbibles de primera generación mostraron malos resultados. En particular, mostraron altas tasas de trombosis del stent (casos en los que un stent coronario implantado causó una oclusión trombótica), infarto de miocardio en la lesión diana (ataque cardíaco que ocurre en el lugar de la lesión tratada) y revascularización del vaso diana (la necesidad de procedimientos adicionales para restablecer el flujo sanguíneo en la arteria tratada). En 2017, Abbott retiró su stent bioabsorbible, Absorb, del mercado europeo después de la prensa negativa con respecto al dispositivo. Boston Scientific también anunció la finalización de su programa de stents coronarios bioabsorbibles Renuvia ya que los estudios mostraron un mayor riesgo de eventos adversos graves.
Actualmente, los stents totalmente bioabsorbibles no desempeñan un papel significativo en las intervenciones coronarias. Si bien varios fabricantes están proponiendo nuevos stents y continúan su desarrollo, sigue sin estar claro si tendrán un impacto sustancial, a menos que haya más datos de sus ensayos clínicos. Hasta el momento, estos stents no se utilizan ampliamente en la práctica.
Debido a los desafíos que presenta el desarrollo de stents reabsorbibles, muchos fabricantes han centrado sus esfuerzos en dirigir o reducir la liberación de fármacos a través de recubrimientos de polímeros bioabsorbibles. Se ha demostrado que el stent de polímero bioabsorbible Synergy de Boston Scientific tiene potencial para reducir la duración de la terapia antiplaquetaria dual posterior a la implantación. Se ha demostrado que el stent liberador de fármacos Firehawk de MicroPort no es inferior a los stents liberadores de fármacos tradicionales, al tiempo que utiliza un tercio de la cantidad de fármaco equivalente.
En cuanto a los materiales utilizados para fabricar un DES, los primeros productos DES disponibles para el tratamiento de pacientes eran aleaciones de acero inoxidable compuestas de hierro, níquel y cromo y se basaban en stents de metal desnudo existentes. Estos stents eran difíciles de visualizar con imágenes médicas, presentaban el riesgo de causar respuestas alérgicas y eran difíciles de colocar. Posteriormente se utilizaron nuevas aleaciones, a saber, cromo-cobalto y cromo-platino, con un rendimiento mejorado. Se han desarrollado stents biorreabsorbibles en los que el propio stent se disuelve con el tiempo. Los materiales explorados para su uso incluyen magnesio, ácido poliláctico, polímeros de policarbonato y polímeros de ácido salicílico. Los stents reabsorbibles han mantenido la promesa de proporcionar un tratamiento agudo que eventualmente permitiría que el vaso funcione normalmente, sin dejar un dispositivo permanente.
Para el recubrimiento del DES, se pueden utilizar de una a tres o más capas de polímero: una capa base para la adhesión, una capa principal que retiene y libera (libera) el fármaco en la pared arterial por transferencia de contacto y, a veces, una capa superior para ralentizar la liberación del fármaco y prolongar su efecto. Los primeros stents liberadores de fármacos que se autorizaron utilizaban recubrimientos duraderos. La primera generación de recubrimientos parece haber provocado reacciones inmunológicas en ocasiones y, posiblemente, algunas de ellas condujeron a trombosis. Esto ha impulsado la experimentación y el desarrollo de nuevos enfoques de recubrimiento.
Instrucciones de investigación
Una de las líneas de investigación de los DES es mejorar el material del que está hecho el dispositivo. Los DES de primera generación estaban hechos de acero inoxidable, mientras que los DES contemporáneos están compuestos principalmente de diferentes tipos de aleaciones, como cromo-cobalto y cromo-platino. En los DES de la generación actual, se emplean puntales más delgados que en los DES de primera generación, con resistencia radial y radioopacidad conservadas. Se cree que el menor grosor de los puntales está asociado con mejores resultados relacionados con el stent, incluida la revascularización de la lesión diana, el infarto de miocardio y la trombosis del stent.
Otra área de investigación de los DES se centra en los polímeros. La generación actual de DES incluye tanto stents recubiertos con polímeros duraderos como stents recubiertos con polímeros biodegradables. Se ha informado de que la presencia de un polímero duradero en el cuerpo durante un período prolongado puede provocar inflamación crónica y neoateroesclerosis. Para abordar esta posible limitación, los investigadores han desarrollado DES de polímeros biodegradables como una solución alternativa.
Los científicos también están estudiando diferentes fármacos que podrían utilizarse en el DES para prevenir la reestenosis. Estos fármacos, que tienen propiedades inmunosupresoras y anticancerígenas, tienen como objetivo inhibir el crecimiento de las células musculares lisas. Además, existe un tipo específico de stent que presenta una capa adicional de anticuerpos anti-CD4 en sus puntales. Esta capa adicional se coloca sobre el recubrimiento de polímero y tiene como objetivo capturar las células progenitoras endoteliales circulantes. El objetivo de este diseño es promover una mejor cicatrización del revestimiento de los vasos sanguíneos, conocido como endotelio.
Un posible objetivo de investigación para los DES es la aplicación de un DES sin polímeros en la práctica clínica: dejar de lado los DES basados en polímeros y utilizar en su lugar un DES sin polímeros o un stent coronario recubierto de fármaco. En el caso del DES sin polímeros, se utiliza un recubrimiento abluminal de probucol para controlar la liberación de sirolimus. Por otro lado, el stent coronario recubierto de fármaco tiene una superficie abluminal microestructurada que permite la aplicación directa de un fármaco antirrestenótico.
Sociedad y cultura
Marcas y fabricantes
A partir de 2023, hay más de 20 tipos diferentes de stents liberadores de fármacos disponibles, con diferencias en sus características y funciones.
Economía
La evaluación económica de los DES ha sido objeto de una amplia investigación. En 2007, la relación coste-efectividad incremental global en Europa fue de 98.827 € por año de vida ajustado por calidad ganado. Evitar una revascularización con DES costaría 4.794 €, mientras que la revascularización con BMS cuesta 3.2606 €.
Controversias
Hubo controversias relacionadas con el uso de DES. En 2012, un metaanálisis de datos de ensayos clínicos no mostró ningún beneficio del uso de DES para personas con enfermedad coronaria estable en comparación con el tratamiento con medicamentos; sin embargo, The New York Times entrevistó a David Brown, uno de los autores del análisis, quien dijo que a más de la mitad de los pacientes con enfermedad coronaria estable se les implantaron stents sin siquiera intentar un tratamiento farmacológico y que creía que esto sucedía porque los hospitales y los médicos querían ganar más dinero.
La entrevista desató un debate entre cardiólogos, investigadores y pacientes sobre la idoneidad y eficacia de los DES para la enfermedad coronaria estable: algunos estuvieron de acuerdo con los hallazgos del estudio y cuestionaron el uso excesivo de los stents, mientras que otros criticaron los métodos y las limitaciones del estudio y defendieron los beneficios de los stents, argumentando que la declaración del entrevistado era "escandalosa y difamatoria" y que estaba "insultando la integridad de toda la profesión".
En 2013, el Times of India informó que el DES se utilizaba en exceso y que los distribuidores indios utilizaban las ganancias obtenidas de los altos márgenes de beneficio del DES para sobornar a los médicos para que lo utilizaran.
En 2014, una investigación de la Administración de Alimentos y Medicamentos de Maharashtra concluyó que los altos márgenes de ganancia y los sobornos relacionados con el DES seguían siendo generalizados.
Conflictos de propiedad intelectual
Han surgido varias disputas sobre patentes relacionadas con los stents liberadores de fármacos. En una de ellas, Boston Scientific Corporation (BSC) ha sido declarada culpable de infringir una patente otorgada a la Universidad de Texas en Arlington en 2003 y licenciada a TissueGen. Esta patente involucra una tecnología desarrollada por el fundador de TissueGen, Kevin Nelson, durante su etapa como miembro del cuerpo docente de la Universidad. La tecnología está diseñada para administrar fármacos a través de una fibra extruida dentro de un stent vascular implantado. Como resultado, se ha ordenado a BSC que pague 42 millones de dólares en regalías perdidas tanto a TissueGen como a la Universidad.
Demandas de acción de clase
Los stents liberadores de fármacos han estado asociados con controversias legales y éticas, y ha habido demandas colectivas relacionadas. En 2014, los antiguos propietarios del St. Joseph Medical Center en Maryland llegaron a un acuerdo por 37 millones de dólares en una demanda colectiva con cientos de pacientes que recibieron implantes innecesarios de DES. La demanda alegaba que el Dr. Mark Midei, un cardiólogo del centro, falsificó el grado de estenosis de la arteria coronaria para justificar el uso de DES, exponiendo a los pacientes a mayores riesgos de trombosis, sangrado e infección. Otro fabricante de DES, Cordis Corporation, una subsidiaria de Johnson & Johnson, estuvo involucrado en demandas de personas que sufrieron eventos adversos por el Cypher Stent, un DES de acero inoxidable recubierto con sirolimus, un fármaco inmunosupresor. El Cypher Stent fue aprobado por la FDA en 2003, pero poco después, la FDA emitió una Advertencia de Seguridad tras 290 informes de trombosis subaguda y al menos 60 muertes relacionadas con el dispositivo.
Véase también
- stent bioresorbable – stent médico que se disuelve o se absorbe por el cuerpo;
- stent coronario: stent médico implantado en arterias coronarias;
- implante de elución de drogas: implante para la entrega de un fármaco.
Referencias
- ^ "Stent: MedlinePlus enciclopedia médica". Archivado desde el original el 5 de julio de 2016. Retrieved 10 de marzo 2024.
- ^ "Drug-Eluting Stents Information". Archivado desde el original el 10 de marzo de 2024. Retrieved 10 de marzo 2024.
- ^ Senst B, Goyal A, Basit H, Borger J (2024). "Drug Eluting Stent Compounds". StatPearls. PMID 30726034. Archivado desde el original el 11 de marzo de 2024. Retrieved 10 de marzo 2024.
- ^ Stone G (2006). "Robadas para la eliminación de drogas - Perspectivas actuales y futuras". Cardiología Intervencional. 1 (1): 28–29. doi:10.15420/icr.2006.1.1.28. Archivado desde el original el 20 de noviembre de 2023. Retrieved 20 de noviembre 2023.
- ^ "Onyx Frontier DES - Coronary Stents". Medtronic. Archivado desde el original el 19 de noviembre de 2023. Retrieved 23 de noviembre 2023.
- ^ "Promus PREMIERTM Drug-Eluting Coronary Stent System". www.bostonscientific.com. Archivado desde el original el 23 de noviembre de 2023. Retrieved 23 de noviembre 2023.
- ^ a b c d e Velagapudi C, Madassery S (Noviembre 2022). "Stents dinamizantes". Semin Intervent Radiol. 39 (4): 400–405. doi:10.1055/s-0042-1758078. PMC 9671677. PMID 36406018.
- ^ Iqbal J, Gunn J, Serruys PW (2013). "Stents coloniales: desarrollo histórico, estado actual y direcciones futuras". British Medical Bulletin. 106: 193–211. doi:10.1093/bmb/ldt009PMID 23532779. S2CID 14423973.
- ^ a b Bin QS, Wen LS, Bo X, Jue C, Bo LH, Jin YY, et al. (septiembre de 2009). "Resultados clínicos para stent único y múltiples stents en la práctica contemporánea". Clin Cardiol. 32 (9): E33–9. doi:10.1002/clc.20516. PMC 6653171. PMID 19645042.
- ^ a b Tsagalou E, Chieffo A, Iakovou I, Ge L, Sangiorgi GM, Corvaja N, et al. (mayo de 2005). "Multiple overlapping drug-eluting stents to treat diffuse disease of the left previous descending coronary artery". J Am Coll Cardiol. 45 (10): 1570–3. doi:10.1016/j.jacc.2005.01.049. PMID 15893168.
- ^ Niu Y, Bai N, Ma Y, Zhong P, Shang Y, Wang Z (2022). "Eficacia de implante de stents intravasculares guiados por imágenes de imágenes: revisión sistemática y metaanálisis de ensayos clínicos aleatorizados". Trastornos cardiovasculares BMC. 22 (1): 327. doi:10.1186/s12872-022-02772-w. PMC 9308935. PMID 35870904.
- ^ Wang Y, Mintz GS, Gu Z, Qi Y, Wang Y, Liu M, et al. (2018). "Meta-análisis y revisión sistemática del ultrasonido intravascular frente al implante de stent de desecho de drogas guiado por angiografía en la enfermedad coronaria principal izquierda en 4592 pacientes". Trastornos cardiovasculares BMC. 18 (1): 115. doi:10.1186/s12872-018-0843-z. PMC 6001000. PMID 29898668.
- ^ Li M, Tu H, Yan Y, Guo Z, Zhu H, Niu J, et al. (2023). "Meta-análisis de los resultados de la implantación de stents erradicados en las arterias femoropopliteales". PLOS ONE. 18 (9): e0291466. Bibcode:2023PLoSO..1891466L. doi:10.1371/journal.pone.0291466. PMC 10513203. PMID 37733656.
- ^ Chen K, Xu L, Liu X (2024). "Diferentes fármacos en stents diluyentes para la enfermedad arterial periférica: una evaluación sistemática y metaanálisis bayesiano". Revista de trombosis y trombolisis. 57 (3): 520-530. doi:10.1007/s11239-023-02932-5. PMID 38281227. S2CID 267309550. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ a b Hanawa T (1 de junio de 2009). "Materiales para stents metálicos". Journal of Artificial Organs. 12 (2): 73–79. doi:10.1007/s10047-008-0456-x. PMID 19536623. S2CID 20660118.
- ^ a b Gonzalo N, Macaya C (2012). "Stent Absorbable: enfoque en aplicaciones clínicas y beneficios". Gestión Vascular de Salud y Riesgo. 8: 125–132. doi:10.2147/VHRM.S22551. PMC 3295634. PMID 22399857.
- ^ a b Pradhan A, Vishwakarma P, Vankar S, Sethi R (2019). "El ABSORB impredecible" - Trombosis de Stent muy tardía del andamio Vascular bioresorbable". Vistas al corazón. 20 (2): 65–69. doi:10.4103/HEARTVIEWS.. PMC 6686611. PMID 31462962.
- ^ a b Lee DH, de la Torre Hernández JM (agosto 2018). "La más reciente generación de Stents y Más Allá". Cardiología europea. 13 (1): 54–59. doi:10.15420/ecr.2018:8:2. 6159420. PMID 30310472. Archivado desde el original el 22 de octubre de 2023. Retrieved 21 de octubre 2023.
- ^ Bozsak F, González-Rodriguez D, Sternberger Z, Belitz P, Bewley T, Chomaz J, et al. (2015). "Optimization of Drug Delivery by Drug-Eluting Stents". PLOS ONE. 10 (6): e0130182. Código:2015PLoSO..1030182B. doi:10.1371/journal.pone.0130182. PMC 4470631. PMID 26083626.
- ^ a b c d e f h i j Stevens JR, Zamani A, Osborne JI, Zamani R, Akrami M (2021). "Evaluación crítica de stents en angioplastia coronaria: revisión sistemática". BioMedical Engineering OnLine. 20 1): 46. doi:10.1186/s12938-021-00883-7. PMC 8105986. PMID 33964954.
- ^ Y, Xie H, Zeng Y, Zhao X, Tian Z, Zhang S (2013). "Eficacia y seguridad de los estantes Biolimus-Eluting Biolimus-Eluting Biolimus-Eluting de Polimer Durable: una meta-análisis". PLOS ONE. 8 (11): e78667. Código:2013PLoSO...878667Y. doi:10.1371/journal.pone.0078667. PMC 3823917. PMID 24244335.
- ^ Yuan H, Wu Z, Lu T, Wei T, Zeng Y, Liu Y, et al. (2022). "Comparison of biodegradable and durable polymer drug-eluting stents in acute coronary symbol: A meta-analysis". BMJ Abierto. 12 (6): e058075. doi:10.1136/bmjopen-2021-058075. PMC 9185674. PMID 35676012. Archivado desde el original el 8 de agosto de 2022. Retrieved 11 de marzo 2024.
- ^ Gao K, Sun Y, Yang M, Han L, Chen L, Hu W, et al. (2017). "Eficacia y seguridad del stent libre de polímeros contra el stent diluyente de fármacos de polímero en pacientes con síndrome coronario agudo: metaanálisis de ensayos de control aleatorizados". Trastornos cardiovasculares BMC. 17 (1): 194. doi:10.1186/s12872-017-0603-5. PMC 5518142. PMID 28724348.
- ^ Saito Y, Kobayashi Y (2024). "Stents coronarios contemporáneos de elución y recubrimiento de drogas: Una mini-revisión actualizada (2023)". Intervención cardiovascular y Terapéutica. 39 (1): 15–17. doi:10.1007/s12928-023-00954-7. PMID 37656338. S2CID 261430959. Archivado desde el original el 24 de noviembre de 2023. Retrieved 11 de marzo 2024.
- ^ Watson T, Webster MWI (2017). "Long y corto de diseño óptimo de stent". Corazón abierto. 4 (2): e000680. doi:10.1136/openhrt-2017-000680. PMC 5663262. PMID 29118997. Archivado desde el original el 30 de marzo de 2023. Retrieved 11 de marzo 2024.
- ^ McClean DR, Eigler NL (20 de noviembre de 2002). "Stent Design: Implications for Restenosis". Opiniones en Cardiovascular Medicina. 3 (S5): 16–22. Archivado desde el original el 8 de diciembre de 2023. Retrieved 11 de marzo 2024.
- ^ Liu L, Liu B, Ren J, Hui G, Qi C, Wang J (2018). "Comparación de balón de elución de drogas contra stent de elusión de drogas para el tratamiento de la enfermedad coronaria: metaanálisis de ensayos controlados aleatorizados". Trastornos cardiovasculares BMC. 18 1): 46. doi:10.1186/s12872-018-0771-y. PMC 5834842. PMID 29499651.
- ^ Abdelaziz A, Hafez A, Atta K, Elsayed H, Abdelaziz M, Elaraby A, et al. (2023). "Boletos con recubrimiento de fármacos contra stents diluidos en pacientes con infarto agudo de miocardio sometidos a intervención coronaria percutánea: Un metaanálisis actualizado con análisis secuencial de ensayo". Trastornos cardiovasculares BMC. 23 (1): 605. doi:10.1186/s12872-023-03633-w. PMC 10709955. PMID 38066453.
- ^ Enfermedad coronaria y evolución de los dispositivos de angioplastia. SpringerBriefs in Materials. 2020. doi:10.1007/978-3-030-42443-5. ISBN 978-3-030-42442-8. S2CID 218682351. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ McCormick C (2018). "Overview of cardiovascular stent designs". Stents cardiovasculares funcionales. pp. 3–26. doi:10.1016/B978-0-08-100496-8.00001-9. ISBN 978-0-08-100496-8. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ Murphy G, Naughton A, Durand R, Heron E, McCaughey C, Murphy R, et al. (2022). 50 Globos de elución de fármacos y stents de elusión en el tratamiento de pequeñas arterias coronarias: Revisión sistemática y metaanálisis de los resultados clínicos a largo plazo". Afiches generales. pp. A43–A46. doi:10.1136/heartjnl-2022-ICS.50. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ Jain KK (2011). "Angioplastia coronaria y esteroides de desecho de drogas". Aplicaciones de Biotecnología en Terapia Cardiovascular. pp. 259–313. doi:10.1007/978-1-61779-240-3_9. ISBN 978-1-61779-239-7. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ "Intervención coronaria percutánea (PCI)". Medicina Yale. Retrieved 21 de octubre 2023.
- ^ Medtronic. "Onyx Frontier DES - Coronary Stents". www.medtronic.com. Retrieved 19 de noviembre 2023.
- ^ Oliva G, Espallargues M, Pons JM (2004). "Sistentes antiproliferativos para el manejo de drogas: Revisión sistemática de los beneficios y estimación del impacto económico". Revista Española de Cardiología. 57 (7): 617–628. doi:10.1016/S1885-5857(06)60285-5. PMID 15274846. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ Hill R, Dündar Y, Bakhai A, Dickson R, Walley T (2004). "Stents dinamizadores: Una revisión sistemática temprana para informar de la política*1, *2". European Heart Journal. 25 (11): 902–919. doi:10.1016/j.ehj.2004.03.023. PMID 15172462. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ Kwon H, Park S (2014). "Entrega local de agentes antiproliferativos a través de Stents". Polímeros. 6 (3): 755–775. doi:10.3390/polym6030755.
- ^ Cassagnol M, Maha S. "Drug-Eluting Stents". www.uspharmacist.com. Archivado desde el original el 21 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ Tran B (2021). "Evaluación y manejo de la enfermedad arterial periférica: Lo que debe saber cada cardiólogo". Corazón. 107 (22): 1835-1843. doi:10.1136/heartjnl-2019-316164. PMC 8562307. PMID 33985986. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ Wei L, Leo HL, Chen Q, Li Z (2019). "Análisis estructural y hemodinámica de diferentes estructuras de stent en la arteria coronaria curvada y estenótica". Fronteras en Bioingeniería y Biotecnología. 7: 366. doi:10.3389/fbioe.2019.00366. PMC 6908811. PMID 31867313.
- ^ Al Suwaidi J, Berger PB, Holmes Jr DR (2000). "Cronary Artery Stents". JAMA. 284 (14): 1828-1836. doi:10.1001/jama.284.14.1828. PMID 11025836. S2CID 31919688. Archivado desde el original el 17 de junio de 2022. Retrieved 11 de marzo 2024.
- ^ Mao H, Bao J (2018). "Stent periférico". En Jing Z, Mao H (eds.). Cirugía endovascular y dispositivos. Springer. pp. 43–57. doi:10.1007/978-981-10-8270-2_5. ISBN 978-981-10-8270-2. Retrieved 5 de marzo 2024.
- ^ Yuan H, Wu Z, Lu T, Wei T, Zeng Y, Liu Y, et al. (2022). "Comparison of biodegradable and durable polymer drug-eluting stents in acute coronary symbol: A meta-analysis". BMJ Abierto. 12 (6): e058075. doi:10.1136/bmjopen-2021-058075. PMC 9185674. PMID 35676012. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ a b "Ateroesclerosis tención Descripción, Patofisiología, Factores de Riesgo, " Tratamiento en Britannica". 13 marzo 2024. Archivado desde el original el 13 de febrero de 2024. Retrieved 15 de marzo 2024.
- ^ a b c Zeng Y, Xu J, Deng Y, Li X, Chen W, Tang Y (2024). "Stents dinamizadores para la enfermedad coronaria en la perspectiva del análisis bibliométrico". Fronteras en Cardiovascular Medicina. 11. doi:10.3389/fcvm.2024.1288659. PMC 10910058. PMID 38440210.
- ^ Ernst A, Bulum J (2014). "New Generations of Drug-Eluting Stents – A Brief Review". EMJ Cardiología Intervencional: 100-106. doi:10.33590/emjintcardiol/10312250.
- ^ Hong SJ, Hong MK (Marzo 2022). "Stents dinamizadores para el tratamiento de la enfermedad coronaria: una revisión de los avances recientes". Expert Opin Drug Deliv. 19 (3): 269-280. doi:10.1080/17425247.2022.2044784. PMID 35180832.
- ^ Serruys PW, Kutryk MJ, Ong AT (2 de febrero de 2006). "Coronary-Artery Stents". New England Journal of Medicine. 354 (5): 483-495. doi:10.1056/NEJMra051091. PMID 16452560. Archivado desde el original el 15 de octubre de 2022. Retrieved 15 de marzo 2024.
- ^ Katib N, Varcoe RL (2023). "Intervención para la isquemia de la extremidad baja crónica". In Loftus I, Hinchliffe RJ (eds.). Cirugía Vascular y Endovascular (7a edición). Elsevier Health Sciences. pp. 39–57. ISBN 978-0-7020-8463-8. Archivado desde el original el 16 de marzo de 2024. Retrieved 4 de marzo 2024.
- ^ Nordanstig J, Behrendt CA, et al. (enero 2024). "La elección del editor - Sociedad Europea para la Cirugía Vascular (ESVS) 2024 Directrices de Práctica Clínica sobre la Gestión de la Enfermedad Arterial Periférica de la Tumba Baja Asintomática y la Claudicación Intermitente". Eur J Vasc Endovasc Surg. 67 (1): 9–96. doi:10.1016/j.ejvs.2023.08.067. Hdl:1854/LU-01HNCQY1BMAPW8FMXQ74XZ4S4X. PMID 37949800. Retrieved 3 de marzo 2024.
- ^ a b c Chen K, Xu L, Liu X (2024). "Diferentes fármacos en stents diluyentes para la enfermedad arterial periférica: una evaluación sistemática y metaanálisis bayesiano". Revista de trombosis y trombolisis. 57 (3): 520-530. doi:10.1007/s11239-023-02932-5. PMID 38281227.
- ^ a b c d Abdullah K, Bou Dargham B, Steinbrecher M, Sun B, Huiqiang Z, Khalili H, et al. (2018). "Sistentes para el tratamiento de la enfermedad de la arteria periférica". American Journal of Cardiovascular Drugs. 18 (3): 175–180. doi:10.1007/s40256-018-0265-4. PMID 29737505.
- ^ a b c d Bosiers M, Cagiannos C, Deloose K, Verbist J, Peeters P (2008). "Stents dinamizadores en la gestión de la enfermedad arterial periférica". Gestión Vascular de Salud y Riesgo. 4 (3): 553-559. doi:10.2147/VHRM.S1712. PMC 2515416. PMID 18827906.
- ^ Jang BS, Kim E, Gwak MA, Park SA, Park WH (2023). "Fabricación y aplicación de stent de lavado de fármacos para la enfermedad arterial periférica". Korean Journal of Chemical Engineering. 40 (2): 361–368. doi:10.1007/s11814-022-1286-x.
- ^ a b c d Pan C, Han Y, Lu J (2021). "Diseño estructural de Stents Vasculares: Una revisión". Micromachines. 12 (7): 770. doi:10.3390/mi12070770. PMC 8305143. PMID 34210099.
- ^ Majewska P, Oledzka E, Sobczak M (enero 2020). "Overview of the latest developments in the field of drug-eluting stent technology". Biomater Sci. 8 (2): 544-551. doi:10.1039/c9bm00468h. PMID 31701961. S2CID 207966529.
- ^ Yasmin F, Jawed K, Moeed A, Ali SH (enero 2024). "Eficacia de la implantación de Stents de Imaging-Imaging-Intravascular Implantation: A Systematic Review and Meta-Analysis of Randomized Clinical Trials". Curr Probl Cardiol. 49 (1 Pt A): 102002. doi:10.1016/j.cpcardiol.2023.102002. PMID 37544623. S2CID 260681557.
- ^ a b Waksman R (diciembre de 2017). "Una nueva generación de stents diluyentes: Indicaciones y resultados de andamios vasculares bioresorbables". Cleveland Clinic Journal of Medicine. 84 (12 Suppl 4): e20–e24. doi:10.3949/ccjm.84.s4.05. PMID 29281608. S2CID 3663635.
- ^ a b Fischetti M (julio de 2006). "Stents vasculares. Uso ampliado". Scientific American. 295 (1): 94–95. doi:10.1038/scientificamerican0706-94. PMID 16830686.
- ^ Cutlip DE (15 de febrero de 2017). "Terapia antiplaquetarios después de la stent coronaria: Rationale for Personalized Duración de la Terapia". US Cardiol Rev. 11: 31–36. doi:10.15420/usc.2017:7:2. S2CID 108846490. Archivado desde el original el 20 de noviembre de 2023. Retrieved 20 de noviembre 2023.
- ^ a b c Koźlik M, Harpula J, Chuchra PJ, Nowak M, Wojakowski W, Gąsior P (Febrero 2023). "Sistentes de manejo de drogas: progreso técnico y clínico". Biomimetics. 8 1): 72 doi:10.3390/biomimética8010072. PMC 9944483. PMID 36810403.
- ^ Slavin L, Chhabra A, Tobis JM (2007). "Stents dinamizadores: prevención de la reestenosis". Cardiología en revisión. 15 (1): 1–12. doi:10.1097/01.crd.0000200844.16899.fc. PMID 17172878. S2CID 24548420.
- ^ Dehmer GJ, Smith KJ (diciembre de 2009). "Sistentes de Arteria Coronaria de Drug-Eluting". American Family Fisician. 80 11): 1245–1251. PMID 19961137. Archivado desde el original el 30 de noviembre de 2023. Retrieved 15 de marzo 2024.
- ^ "UpToDate". Archivado desde el original el 20 de noviembre de 2023. Retrieved 15 de marzo 2024.
- ^ George S, Butler R, Nolan J, Mamas MA (30 de junio de 2016). "Intervención coronaria percutánea y complicaciones de sangrado". EMJ Cardiología Intervencional. 4 (1): 100–109. doi:10.33590/emjintcardiol/10314557. ISSN 2053-423X. S2CID 256147538. Archivado desde el original el 19 de noviembre de 2023. Retrieved 19 de noviembre 2023.
- ^ Ahmad M, Mehta P, Reddivari AK, Mungee S (2023). "Intervención coronaria percutánea". StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 32310583. Archivado desde el original el 4 de junio de 2023. Retrieved 21 de noviembre 2023.
- ^ a b "Intervención coronaria percutánea (PCI)". Medicina Yale. Archivado desde el original el 22 de octubre de 2023. Retrieved 21 de noviembre 2023.
- ^ Habib A, Mori H, Yahagi K, Finn AV (3 de febrero de 2017). "Contemporary Drug-Eluting Stents and Vascular Response". EMJ Cardiología Intervencional. 2 (1): 60–68. doi:10.33590/emj/10314324. ISSN 2053-423X. S2CID 13713278. Archivado desde el original el 5 de noviembre de 2023. Retrieved 5 de noviembre 2023.
- ^ Patel S, Patel KB, Patel Z, Konat A, Patel A, Doshi JS, et al. (Marzo 2023). "Evolving Coronary Stent Technologies - A Glimpse Into the Future". Cureus. 15 3): e35651. doi:10.7759/cureus.35651. PMC 10065169. PMID 37009355.
- ^ a b c d Piccolo R, Bonaa KH, Efthimiou O, Varenne O, Baldo A, Urban P, et al. (junio 2019). "Stents dinamáticos o metales desnudos para la intervención coronaria percutánea: revisión sistemática y metaanálisis individual de datos de pacientes de ensayos clínicos aleatorizados". Lancet. 393 (10190): 2503–2510. doi:10.1016/S0140-6736(19)30474-X. PMID 31056295. S2CID 144207970.
- ^ Wu PN, Chen JH, Yang CP, Hsu JC (diciembre 2022). "Avanzadas de DES sobre BMS en la prevención del riesgo de infarto miocárdico, estrofa isquémica y mortalidad en varias poblaciones". Journal of Clinical Medicine. 12 1): 24. doi:10.3390/jcm12010024. PMC 9820891. PMID 36614825.
- ^ Lawton JS, Tamis-Holland JE, Bangalore S, Bates ER, Beckie TM, Bischoff JM, et al. (enero 2022). "2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines". Circulación. 145 (3): e18–e114. doi:10.1161/CIR.0000000001038. PMID 34882435. S2CID 245072028.
- ^ Arnold SV (2018). "Indicaciones actuales para el Stent: Síntomas o CME de supervivencia". Metodista DeBakey Cardiovascular Journal. 14 (1): 7–13. doi:10.14797/mdcj-14-1-7. 5880567. PMID 29623167.
- ^ Fred HL (2009). "Dolor torácico típico: una típica moneda de dumpty húmedo". Texas Heart Institute Journal. 36 (5): 373–374. PMC 2763472. PMID 19876411.
- ^ Swap CJ, Nagurney JT (noviembre de 2005). "Valores y limitaciones de la historia del dolor torácico en la evaluación de pacientes con síndromes coronarios agudos sospechosos". JAMA. 294 (20): 2623–2629. doi:10.1001/jama.294.20.2623. PMID 16304077.
- ^ "La enfermedad coronaria". U.S. Centers for Disease Control and Prevention (CDC)19 de julio de 2021. Archivado desde el original el 2 de marzo de 2015. Retrieved 24 de noviembre 2023.
- ^ Aroesty JM (19 June 2023). Cutlip D, Parikh N (eds.). "Educación patiente: Stenting for the heart (Beyond the Basics)". UpToDate. Archivado desde el original el 23 de noviembre de 2023. Retrieved 23 de noviembre 2023.
- ^ Clark W, Burnes J (18 agosto 2016). "Angioplastia y inserción de stent". Intradiología. Archivado desde el original el 29 de noviembre de 2023. Retrieved 23 de noviembre 2023.
- ^ Iwamoto Y, Okamoto M, Hashimoto M, Fukuda Y, Iwamoto A, Iwasaki T, et al. (Marzo 2012). "Mejor expansión stent por la inflación dos veces del balón stent y su mecanismo responsable". Journal of Cardiology. 59 (2): 160-166. doi:10.1016/j.jcc.2011.12.003. PMID 22266460.
- ^ Griffin BP (2013). Manual de Cardiovascular Medicina (5th ed.). Philadelphia: Lippincott Williams & Wilkins. pp. 929-949. ISBN 978-1-4963-1260-0.
- ^ Spadaccio C, Benedetto U (Julio 2018). "Injerto de derivación coronaria (CABG) vs. intervención coronaria percutánea (PCI) en el tratamiento de la enfermedad coronaria multivaso: qu vadis? - una revisión de las evidencias sobre la enfermedad coronaria". Annals of Cardiothoracic Surgery. 7 (4): 506-515. doi:10.21037/acs.2018.05.17. PMC 6082779. PMID 30094215.
- ^ Peels JO, Hautvast RW, de Swart JB, Huybregts MA, Umans VA, Arnold AE, et al. (Febrero de 2009). "Intervención coronaria percutánea sin respaldo quirúrgico in situ; registro de dos años de un gran hospital comunitario holandés". International Journal of Cardiology. 132 (1): 59–65. doi:10.1016/j.ijcard.2007.10.037. PMID 18241941.
- ^ "Nueva Declaración muestra PCI Sin cirugía en el sitio es tan seguro como PCI con cirugía en el sitio". Society for Cardiovascular Angiography & Interventions (SCAI). Archivado desde el original el 23 de noviembre de 2023. Retrieved 23 de noviembre 2023.
- ^ Kirtane AJ, Stone GW (septiembre 2011). "Cómo minimizar la trombosis stent". Circulación. 124 11): 1283–1287. doi:10.1161/CIRCULATIONAHA.110.976829. PMID 21911796. S2CID 17063075.
- ^ Hassan S, Ali MN, Ghafoor B (abril 2022). "Perspectiva evolutiva de los stents de lavado de drogas: desde el polímero grueso hasta el enfoque libre de polímeros". Journal of Cardiothoracic Cirugía. 17 (1): 65. doi:10.1186/s13019-022-01812-y. PMC 8981810. PMID 35379273.
- ^ Denktas AE, Grimes C (2018). "Intervención coronaria percutánea". En Levine GN (ed.). Secretos de Cardiología. Elsevier. pp. 172–182. doi:10.1016/B978-0-323-47870-0.00019-2. ISBN 978-0-323-47870-0.
8 ¿Qué es la trombosis stent? La trombosis stent ocurre cuando hay oclusión completa de la arteria debido a la formación de un trombo en el stent.... La trombosis stent es un evento potencialmente catastrófico y a menudo presenta como STEMI, que requiere revascularización de emergencia. La trombosis stent conlleva una tasa de mortalidad del 20% al 45%.
- ^ Anstrom KJ, Kong DF, Shaw LK, Califf RM, Kramer JM, Peterson ED, et al. (agosto de 2008). "Resultados clínicos a largo plazo después del stent coronario". Archivos de Medicina Interna. 168 (15): 1647-1655. doi:10.1001/archinte.168.15.1647. PMID 18695078.
- ^ Serrano MC, Vavra AK, Jen M, Hogg ME, Murar J, Martinez J, et al. (mayo de 2011). "Poly (diol-co-citrato)s como nuevos envoltorios perivasculares elastómicos para la reducción de la hiperplasia neointimal". Macromolecular Biociencia. 11 (5): 700–709. doi:10.1002/mabi.201000509. PMC 4068126. PMID 21341372.
- ^ Shlofmitz E, Ali ZA, Maehara A, Mintz GS, Shlofmitz R, Jeremias A (diciembre 2020). "Intravascular Imaging-Guided Percutaneous Coronary Intervention: A Universal Approach for Optimization of Stent Implantation". Circulación. Intervenciones cardiovasculares. 13 (12): e008686. doi:10.1161/CIRCINTERVENCIONES.120.0086. PMID 33233934. S2CID 227169038.
- ^ Li M, Hou J, Gu X, Weng R, Zhong Z, Liu S (enero 2022). "Incidencia y factores de riesgo de reestenosis instentosa después de la intervención coronaria percutánea en pacientes del sur de China". European Journal of Medical Research. 27 1): 12. doi:10.1186/s40001-022-00640-z. PMC 8783476. PMID 35065663.
- ^ Lee MS, Shah AP, Aragon J, Jamali A, Dohad S, Kar S, et al. (diciembre de 2005). "El stent dinamizante es superior al stent de metal desnudo en injertos de vena saphenous". Calterización y Cardiovascular Intervenciones. 66 (4): 507–511. doi:10.1002/ccd.20498. PMID 16270361. S2CID 24315977.
- ^ Baldwin DE, Abbott JD, Trost JC, Vlachos HA, Selzer F, Glaser R, et al. (octubre de 2010). "Comparación de stents metálicos de elución de drogas y desnudos para lesiones de injerto de vena saphenous (del Registro Dinámico del Instituto Nacional de Corazón, Pulmón y Sangre)". El American Journal of Cardiology. 106 (7): 946–951. doi:10.1016/j.amjcard.2010.05.025. PMC 2945366. PMID 20854955.
- ^ Toleos A (31 de octubre de 2023). "PRESS RELEASE: Los stents coronarios innecesarios cuestan Medicare tanto como $800 millones al año". Lown Institute. Archivado desde el original el 3 de noviembre de 2023. Retrieved 3 de noviembre 2023.
- ^ Win HK, Caldera AE, Maresh K, Lopez J, Rihal CS, Parikh MA, et al. (Mayo 2007). "Los resultados clínicos y la trombosis stent después del uso fuera de la etiqueta de stents diluyentes". JAMA. 297 (18): 2001–2009. doi:10.1001/jama.297.18.2001. PMID 17488965.
- ^ Beohar N, Davidson CJ, Kip KE, Goodreau L, Vlachos HA, Meyers SN, et al. (Mayo 2007). "Los productos y las complicaciones asociadas con el uso no etiquetado y no probado de los stents de la droga". JAMA. 297 (18): 1992–2000. doi:10.1001/jama.297.18.1992. PMID 17488964.
- ^ "Evitando la sobreutilización: Stents Coronarios". Lown Institute Hospital Index. Archivado desde el original el 15 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ Dixon SR, Grines CL, O'Neill WW (mayo de 2010). "El año en cardiología intervencionista". Journal of the American College of Cardiology. 55 (20): 2272–86. doi:10.1016/j.jacc.2010.02.024. PMID 20466207.
- ^ Poorhosseini H, Kassaian SE, Aghajani H, Alidoosti M, Hajizeinali AM, Salarifar M, et al. (2012). "El uso de stents para la eliminación de drogas y fuera de la etiqueta: comparación de los resultados a corto y largo plazo". Texas Heart Institute Journal. 39 (1): 24–29. PMC 3298939. PMID 22412223.
- ^ "Intervención coronaria percutánea". Heart and Stroke Foundation of Canada. Archivado desde el original el 23 de noviembre de 2023. Retrieved 23 de noviembre 2023.
- ^ Song JW, Soh S, Shim JK (enero 2020). "Atención de Anestesia Monitorada para Intervenciones Cardiovasculares". Korean Circulation Journal. 50 (1): 1–11. doi:10.4070/kcj.2019.0269. PMC 6923237. PMID 31642214.
- ^ Stouffer III GA, Yadav PK, Todd JW, Yousuf MA (27 de noviembre de 2019). Peter K (ed.). Técnica de Intervención Coronaria Percutánea (PCI): Acceso, Procedimiento, Evaluación Anatómica y Fisiológica. emedicine.medscape.com. Archivado desde el original el 13 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ "TR BAND® Radial Compression Device". www.terumois.com. Archivado desde el original el 22 de octubre de 2023. Retrieved 21 de octubre 2023.
- ^ Shuvy M, Ko DT (28 de febrero de 2014). "Bleeding after percutaneous coronary intervention: can still ignore the obvious?". Corazón abierto. 1 (1): e000036. doi:10.1136/openhrt-2014-000036. PMC 4195920. PMID 25332793.
- ^ Thibert MJ, Fordyce CB, Cairns JA, Turgeon RD, Mackay M, Lee T, et al. (Julio 2021). "Access-Site vs Non-Access-Site Major Bleeding and In-Hospital Outcomes Among STEMI Patients Reception Primary PCI". CJC Abierto. 3 (7): 864–871. doi:10.1016/j.cjco.2021.02.009. PMC 8347846. PMID 34401693.
- ^ Canfield J, Totary-Jain H (octubre de 2018). "40 años de intervención coronaria percutánea: historia y direcciones futuras". Journal of Personalized Medicine. 8 4): 33. doi:10.3390/jpm8040033. PMC 6313463. PMID 30275411.
- ^ "Onyx Frontier DES - Coronary Stents". Medtronic. Archivado desde el original el 19 de noviembre de 2023. Retrieved 19 de noviembre 2023.
- ^ "IVUS in PCI Guidance". American College of Cardiology. Archivado desde el original el 24 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ Center for Devices and RadiologicalHealth (15 August 2023). "Fluoroscopia". FDA. Archivado desde el original el 11 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ Goergen S (13 de septiembre de 2016). "Medio de contraste que contiene yodo". Intradiología. Archivado desde el original el 7 de julio de 2022. Retrieved 21 de noviembre 2023.
- ^ Dalal F, Dalal HM, Voukalis C, Gandhi MM (julio de 2017). "Management of patients after primary percutaneous coronary intervention for myocardial infarction". BMJ. 358: j3237. doi:10.1136/bmj.j3237. PMID 28729460. S2CID 46847680.
- ^ Sociedad Radiológica de América del Norte (RSNA), American College of Radiology (ACR). "Angioplastia y Stent Vascular". Radiologyinfo.org. Archivado desde el original el 21 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ "Short Hospital se queda después de la angioplastia tras el ataque cardíaco con frecuencia suficiente". American College of Cardiology. Archivado desde el original el 24 de febrero de 2024. Retrieved 21 de noviembre 2023.
- ^ "Angioplastia coronaria y stents (PCI)". British Heart Foundation. Archivado desde el original el 21 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ "Stents - Qué esperar después de conseguir un Stent ← NHLBI, NIH". www.nhlbi.nih.gov24 de marzo de 2022. Archivado desde el original el 21 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ "Angioplastia coronaria e inserción stent - Recuperación". nhs.uk11 de junio de 2018. Archivado desde el original el 24 de diciembre de 2021. Retrieved 21 de noviembre 2023.
- ^ "Consejos de descarga después de su angiograma coronario, angioplastia o inserción de stent (PCI)". Hull University Teaching Hospitals NHS Trust9 de abril de 2021. Archivado desde el original el 21 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ "Stents - Vivir con un Stent ANTE NHLBI, NIH". www.nhlbi.nih.gov24 de marzo de 2022. Archivado desde el original el 21 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ "Cómo la rehabilitación cardíaca puede ayudar a curar su corazón". U.S. Centers for Disease Control and Prevention. 12 de septiembre 2022. Archivado desde el original el 27 de noviembre de 2023. Retrieved 21 de noviembre 2023.
- ^ Dangas GD, Claessen BE, Caixeta A, Sanidas EA, Mintz GS, Mehran R (noviembre de 2010). "La reestenosis in-stent en la era del stent diluido". Journal of the American College of Cardiology. 56 (23): 1897-1907. doi:10.1016/j.jacc.2010.07.028. PMID 21109112.
- ^ a b Bønaa KH, Mannsverk J, Wiseth R, Aaberge L, Myreng Y, Nygård O, et al. (septiembre 2016). "Sistentes Drug-Eluting o Bare-Metal para la enfermedad coronaria de la arteria". El New England Journal of Medicine. 375 (13): 1242–1252. doi:10.1056/NEJMoa1607991. PMID 27572953.
- ^ Shlofmitz E, Iantorno M, Waksman R (agosto 2019). "Restenosis of Drug-Eluting Stents: A New Classification System Based on Disease Mechanism to Guide Treatment and State-of-the-Art Review". Circulación. Intervenciones cardiovasculares. 12 (8): e007023. doi:10.1161/CIRCINTERVENCIONES.118.007023PMID 31345066. S2CID 198912657.
- ^ a b Palmerini T, Benedetto U, Biondi-Zoccai G, Della Riva D, Bacchi-Reggiani L, Smits PC, et al. (junio de 2015). "Seguridad de largo plazo de los fármacos de desecho y de los agentes de los medios de comunicación: evidencia de una red integral de metaanálisis". Journal of the American College of Cardiology. 65 (23): 2496–2507. doi:10.1016/j.jacc.2015.04.017. hdl:11392/2415452. PMID 26065988.
- ^ a b c Nikam N, Steinberg TB, Steinberg DH (2014). "Los avances en tecnologías de stent y su efecto en la eficacia clínica y la seguridad". Dispositivos médicos: pruebas e investigación. 7: 165–178. doi:10.2147/MDER.S31869. PMC 4051714. PMID 24940085. S2CID 5022642.
- ^ a b c Yalcin D (29 de noviembre de 2019). "Ensayo mecánico de Stents Vasculares". ADMET. Archivado desde el original el 23 de noviembre de 2023. Retrieved 23 de noviembre 2023.
- ^ "Overview of Medical Device Classification and Reclassification". FDA3 de noviembre de 2018. Archivado desde el original el 19 de noviembre de 2023. Retrieved 19 de noviembre 2023.
- ^ Jaiswal V, Ang SP, Shrestha AB, Joshi A, Ishak A, Chia JE, et al. (junio 2023). "Intervención coronaria percutánea contra injerto de bypass coronario entre pacientes con disfunción sistólica ventricular izquierda: revisión sistemática y metaanálisis". Anales de Medicina y Cirugía. 85 (6): 2849–2857. doi:10.1097/MS9.0000000000634. PMC 10289746. PMID 37363575.
- ^ Grüntzig AR, Senning A, Siegenthaler WE (Julio 1979). "Dilatación no operativa de estenosis coronaria-arteria: angioplastia coronaria transluminal percutánea". El New England Journal of Medicine. 301 (2): 61–68. doi:10.1056/NEJM197907123010201. PMID 449946.
- ^ a b c d Baim DS (2005) [1958]. "Revascularización coronaria percutánea". En Kasper DL, Fauci AS, Longo DL, Braunwald E, Hauser SL, Jameson JL (eds.). Principios de Harrison sobre Medicina Interna (16a edición). Nueva York: McGraw-Hill. pp. 1459–1462.
- ^ Dotter CT, Judkins MP (noviembre de 1964). "Tratamiento Transluminal de la Obstrucción Arteriosclerótica. Descripción de una nueva técnica y un informe preliminar de su aplicación". Circulación. 30 (5): 654-670. doi:10.1161/01.CIR.30.5.654. PMID 14226164.
- ^ a b c d e Serruys PW, Kutryk MJ, Ong AT (Febrero de 2006). "Stents de cortesía". El New England Journal of Medicine. 354 (5): 483-495. doi:10.1056/NEJMra051091. PMID 16452560. S2CID 13647055.
- ^ Hwang CW, Wu D, Edelman ER (Julio 2001). "Las fuerzas de transporte físico rigen la distribución de drogas para la entrega basada en stents". Circulación. 104 (5): 600-605. doi:10.1161/hc3101.092214. PMID 11479260.
- ^ Ellis SG, Holme DR (2006). Enfoques estratégicos en la intervención coronaria. Lippincott Williams & Wilkins. ISBN 978-0-7817-4294-8. Archivado desde el original el 20 de octubre de 2023. Retrieved 13 de mayo 2015.
- ^ "Guideline on the development of medicinal substances contained in drug-eluting (medicinal substance-eluting) coronary stents" (PDF). London: European Medicines Agency. 22 March 2007. Archivado (PDF) original el 8 de febrero de 2024. Retrieved 8 de febrero 2024.
- ^ a b c Mukherjee T, Shah BV (octubre de 2005). "Sirolimus: un nuevo inmunosupresor". J Assoc. 53: 885-90. PMID 16459533.
- ^ "Sirolimus-Eluting Stents for Chronic Total Coronary Occlusions - Full Text View - ClinicalTrials.gov". clínicos.gov5 de marzo de 2007. Archivado desde el original el 13 de abril de 2021. Retrieved 8 de febrero 2024.
- ^ "Sirolimus-eluting Stents with Biodegradable Polymer Versus an Everolimus-eluting Stents - Full Text View - ClinicalTrials.gov". clínicos.gov16 de octubre de 2018. Archivado desde el original el 15 de mayo de 2021. Retrieved 8 de febrero 2024.
- ^ "Ensayo clínico sobre la eficacia y seguridad del stent Sirolimus-Eluting (MiStent® System) - Vista completa del texto - ClinicalTrials.gov". clínicos.gov3 de septiembre de 2020. Archivado desde el original el 7 de abril de 2021. Retrieved 8 de febrero 2024.
- ^ Mauri L, Hsieh Wh, Massaro JM, Ho KK, D'Agostino R, Cutlip DE (8 de marzo de 2007). "Trombosis de stent en ensayos clínicos aleatorios de esteroides de eliminación de drogas". New England Journal of Medicine. 356 (10): 1020-1029. doi:10.1056/NEJMoa067731. PMID 17296821. Archivado desde el original el 3 de mayo de 2023. Retrieved 8 de febrero 2024 – via CrossRef.
- ^ "A Randomized, Double-blind Study to Assess Paclitaxel-eluting Stents in Treatment of Longer Lesions - Full Text View - ClinicalTrials.gov". clínicos.gov. Archivado desde el original el 6 de abril de 2021. Retrieved 8 de febrero 2024.
- ^ Dawkins KD, Grube E, Guagliumi G, Banning AP, Zmudka K, Colombo A, et al. (22 de noviembre de 2005). "Eficacia clínica de los estantes de Paclitaxel-Eluting de base polímero en el tratamiento de las lesiones complejas de la arteria coronaria larga Desde un ensayo multicéntrico, aleatorio: Apoyo al uso de esteroides para el manejo de drogas en la práctica clínica contemporánea". Circulación. 112 (21): 3306–3313. doi:10.1161/CIRCULATIONAHA.105.552190. PMID 16286586. Archivado desde el original el 8 de febrero de 2024. Retrieved 8 de febrero 2024 – via CrossRef.
- ^ "Resultados del ensayo clínico - Eluvia Drug-Eluting Stent". www.bostonscientific.com. Archivado desde el original el 8 de febrero de 2024. Retrieved 8 de febrero 2024.
- ^ Galløe AM, Thuesen L, Kelbæk H, Thayssen P, Rasmussen K, Hansen PR, et al. (30 de enero de 2008). "Comparison of Paclitaxel- and Sirolimus-Eluting Stents in Everyday Clinical PracticeThe SORT OUT II Randomized Trial". JAMA. 299 (4): 409-416. doi:10.1001/jama.299.4.409. PMID 18230778. Archivado desde el original el 24 de febrero de 2024. Retrieved 8 de febrero 2024 – a través de la silla de plata.
- ^ Dai Y, Wang R, Chen F, Zhang Y, Liu Y, Huang H, et al. (12 de noviembre de 2021). "Resultados clínicos en 2481 pacientes del mundo real no seleccionados tratados con un stent de silmo dilución libre de polímeros: 3 años de resultados del Registro multicéntrico de NANO". Trastornos cardiovasculares BMC. 21 (1): 537. doi:10.1186/s12872-021-02356-0. PMC 8588634. PMID 34772347.
- ^ Saito S, Bennett J, Nef HM, Webster M, Namiki A, Takahashi A, et al. (Noviembre 2023). "Primero ensayo controlado aleatorizado que compara el bioadaptor sirolímus-eluting con el stent de elución de fármacos zotarolimus en pacientes con lesiones coronarias de novo: datos clínicos e imágenes de 12 meses del multicéntrico, internacional, BIODAPTOR-RCT" (PDF). eClinicalMedicine. 65. doi:10.1016/j.eclinm.2023.102304. PMC 10725075. PMID 38106564. Archivado (PDF) original el 8 de febrero de 2024. Retrieved 8 de febrero 2024.
- ^ Comisionado Oo (3 de noviembre de 2018). "Actualización jurisdiccional: Stents Cardiovasculares para el manejo de drogas". FDA. Archivado desde el original el 8 de diciembre de 2023. Retrieved 8 de febrero 2024 – vía www.fda.gov.
- ^ a b Uhrin P, Wang D, Mocan A, Waltenberger B, Breuss JM, Tewari D, et al. (noviembre de 2018). "La proliferación de células musculares suaves vasculares como objetivo terapéutico. Parte 2: Productos naturales que inhiben la proliferación". Avances en biotecnología. 36 (6): 1608-1621. doi:10.1016/j.biotechadv.2018.04.002. PMID 29678389. S2CID 5027489.
- ^ "Stents dinamizantes o metales desnudos para la intervención coronaria percutánea: revisión sistemática y metaanálisis individual de datos de pacientes de ensayos clínicos aleatorizados - The Lancet" (PDF). Archivado (PDF) original el 8 de febrero de 2024. Retrieved 8 de febrero 2024.
- ^ Li M, Tu H, Yan Y, Guo Z, Zhu H, Niu J, et al. (21 de septiembre de 2023). "Meta-análisis de los resultados de la implantación de stents erradicados en las arterias femoropopliteales". PLOS ONE. 18 (9): e0291466. Bibcode:2023PLoSO..1891466L. doi:10.1371/journal.pone.0291466. PMC 10513203. PMID 37733656.
- ^ Brilakis ES, Wang TY, Rao SV, Banerjee S, Goldman S, Shunk K, et al. (2010). "Frequency and Predictors of Drug-Eluting Stent Use in Saphenous Vein Bypass Graft Percutaneous Coronary Interventions". JACC: Intervenciones cardiovasculares. 3 (10): 1068-1073. doi:10.1016/j.jcin.2010.07.009. PMID 20965466.
- ^ Krone RJ, Rao SV, Dai D, Anderson HV, Peterson ED, Brown MA y otros (2010). "Aceptancia, pánico y recuperación parcial". JACC: Intervenciones cardiovasculares. 3 (9): 902–910. doi:10.1016/j.jcin.2010.06.014. PMID 20850088.
- ^ a b Aljihmani L, Alic L, Boudjemline Y, Hijazi ZM, Mansoor B, Serpedin E, et al. (2019). "Magnesium-Based Bioresorbable Stent Materiales: Review of Reviews". Journal of Bio- and Tribo-Corrosion. 5. doi:10.1007/s40735-019-0216-x. S2CID 80811999. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ Witte F, Eliezer A (2012). "Biodegradable Metals". Degradation of Implant Materials. Springer. pp. 93–109. doi:10.1007/978-1-4614-3942-4_5. ISBN 978-1-4614-3941-7. Archivado desde el original el 18 de junio de 2018. Retrieved 11 de marzo 2024.
- ^ a b c Ormiston JA, Serruys PW (junio de 2009). "Stents coronarios Bioabsorbables". Circulación. Intervenciones cardiovasculares. 2 (3): 255–260. doi:10.1161/CIRCINTERVENTIONS.109.859173. PMID 20031723.
- ^ a b Charpentier E, Barna A, Guillevin L, Juliard JM (2015). "Complejos coronarios totalmente bioresorbables para la eliminación de drogas: una revisión". Archivos de Enfermedades Cardiovasculares. 108 (6–7): 385–397. doi:10.1016/j.acvd.2015.03.009. PMID 26113479.
- ^ Damian Garde for Fierce Medical Devices. 22 mayo 2013 Boston Scientific, Elixir hace olas en EuroPCR 2013 Archivado 16 enero 2016 en la máquina Wayback
- ^ Ni L, Chen H, Luo Z, Yu Y (28 de enero de 2020). "Stents vasculares fluoresorbables y stents diluidos en el tratamiento de la enfermedad coronaria del corazón: un metaanálisis". Journal of Cardiothoracic Cirugía. 15 1): 26. doi:10.1186/s13019-020-1041-5. PMC 6986072. PMID 31992360.
- ^ Husten L (6 de abril de 2017). "Abbott Pulls Troubled Absorb Stent From European Market". CardioBrief. Archivado desde el original el 21 de enero de 2021. Retrieved 2 de noviembre 2017.
- ^ Densford F (31 de julio de 2017). "Boston Scientific to end Renuvia bioresorbable coronary stent program – MassDevice". +MassDevice. Archivado desde el original el 7 de noviembre de 2017. Retrieved 2 de noviembre 2017.
- ^ a b Omar WA, Kumbhani DJ (2019). "La literatura actual sobre los esteroides bioabsorbables: una revisión" (PDF). Aterosclerosis actual Informes. 21 (12): 54. doi:10.1007/s11883-019-0816-4. PMID 31768641. S2CID 208278983. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ Yeazel TR, Becker ML (2020). "Advancing Toward 3D Printing of Bioresorbable Shape Memory Polymer Stents". Biomacromoléculas. 21 (10): 3957–3965. doi:10.1021/acs.biomac.0c01082. PMID 32924443.
- ^ Kirillova A, Yeazel TR, Asheghali D, Petersen SR, Dort S, Gall K, et al. (22 de septiembre de 2021). "Fabricación de andamios biomédicos usando polímeros biodegradables". Reseñas químicas. 121 (18): 11238–11304. doi:10.1021/acs.chemrev.0c01200. PMID 33856196. Archivado desde el original el 13 de marzo de 2024. Retrieved 13 de marzo 2024 – via CrossRef.
- ^ "Abbott reinicia ensayos clínicos bioresorbables con nuevo esprit de bajo el carril de rodilla". 3 septiembre 2020. Archivado desde el original el 1 de octubre de 2023. Retrieved 11 de marzo 2024.
- ^ Jackson-Smith E, Zioupos S, Banerjee P (2022). "Cambios vasculares fluoresorbables contra stents convencionales de dispersión de drogas a través del tiempo: un metaanálisis de ensayos controlados aleatorizados". Corazón abierto. 9 (2): e002107. doi:10.1136/openhrt-2022-002107. PMC 9615997. PMID 36288820. Archivado desde el original el 1 de noviembre de 2022. Retrieved 11 de marzo 2024.
- ^ Malmonge SM, Cliquet C (2023). "Ropa Vascular Totalmente Bioresorbable". Tendencias actuales en Ingeniería Biomédica. Springer. pp. 255–268. doi:10.1007/978-3-031-38743-2_14. ISBN 978-3-031-38742-5. Archivado desde el original el 11 de marzo de 2024. Retrieved 11 de marzo 2024.
- ^ Kirtane AJ, Mauri L, Stoler R, Feldman R, Neumann FJ, Boutis L, et al. (22 de septiembre de 2018). "TCT-841 Características basales y resultados de 3 meses de la prueba EVOLVE Short DAPT: Una investigación prospectiva de la terapia antiplaquetas abreviada en pacientes de alto riesgo de sangrado tratados con un stent coronario recubierto bioabsorbable de polímero, siempreolimus eluting". Journal of the American College of Cardiology. 72 (13 Suplemento): B335–B336. doi:10.1016/j.jacc.2018.08.2086. ISSN 0735-1097.
- ^ Lansky A, Wijns W, Xu B, Kelbæk H, van Royen N, Zheng M, et al. (septiembre de 2018). "Terapia forzada con un groove abluminal localizado, stent coronario de polímero biodegradable de baja dosis (TARGET All Comers): un ensayo multicéntrico, abierto y aleatorizado de no inferioridad". Lancet. 392 (10153): 1117–1126. doi:10.1016/S0140-6736(18)31649-0. PMID 30190206. S2CID 52169067.
- ^ Gogas BD, Farooq V, Onuma Y, Serruys PW (2012). "El andamio vascular bioresorbable ABSORB: ¿una evolución o revolución en la cardiología intervencionista?" (PDF). Hellenic Journal of Cardiology. 53 (4): 301–309. PMID 22796817. Archivado (PDF) del original el 9 de agosto de 2017. Retrieved 13 de enero 2016.
- ^ a b c d Saito Y, Kobayashi Y (septiembre 2023). "Stents coronarios contemporáneos de elución y recubrimiento de drogas: una mini-revisión actualizada (2023)". Intervención cardiovascular y Terapéutica. 39 (1): 15–17. doi:10.1007/s12928-023-00954-7. PMID 37656338. S2CID 261430959.
- ^ "Drug-Eluting Stents Market: Global Industry Trends, Share, Size, Growth, Opportunity and Forecast 2023-2028". Research and Markets Ltd. Archivado desde el original el 24 de noviembre de 2023. Retrieved 24 de noviembre 2023.
- ^ "Drug-eluting Stent Market Size, share " Growth Research Report". www.bccresearch.com. Archivado desde el original el 24 de noviembre de 2023. Retrieved 24 de noviembre 2023.
- ^ Nicolas J, Pivato CA, Chiarito M, Beerkens F, Cao D, Mehran R (mayo 2023). "Evolución de stents coronarios diluidos por drogas: un viaje de vuelta y salida del banco a la cama". Cardiovascular Research. 119 (3): 631-646. doi:10.1093/cvr/cvac105. PMID 35788828.
- ^ Willich SN, Müller-Riemenschneider F, McBride D, Silber S, Kuck KH, Nienaber CA, et al. (Febrero de 2012). "Evaluación económica de la salud del uso de stents diluyentes de drogas: Primeros resultados del Registro de Stents de Medicamentos (DES.de)". Herz. 38 (1): 57–64. doi:10.1007/s00059-012-3581-5. PMID 22301731. S2CID 25967413.
- ^ Kuukasjärvi P, Räsänen P, Malmivaara A, Aronen P, Sintonen H (2007). "Evaluación económica de los stents diluidos por drogas: una revisión sistemática de la literatura y un análisis de la calidad de los costos basado en modelos". International Journal of Technology Assessment in Health Care. 23 (4): 473-479. doi:10.1017/S0266462307070560. PMID 17937836. S2CID 31846667.
- ^ Stergiopoulos K, Brown DL (febrero de 2012). "Implantación coronaria initial con terapia médica vs terapia médica sola para enfermedad coronaria estable: metaanálisis de ensayos controlados aleatorizados". Archivos de Medicina Interna. 172 (4): 312-319. doi:10.1001/archinternmed.2011.1484. PMID 22371919.
- ^ Bakalar N (27 de febrero de 2012). "No hay beneficios extras en los esteroides para la enfermedad coronaria". El New York Times. ISSN 0362-4331. Archivado desde el original el 24 de noviembre de 2023. Retrieved 24 de noviembre 2023.
- ^ Kolata G (16 de noviembre de 2019). "La cirugía para las arterias bloqueadas es a menudo injustificada, los investigadores encuentran". El New York Times. ISSN 0362-4331. Archivado desde el original el 29 de diciembre de 2022. Retrieved 24 de noviembre 2023.
- ^ Guzick DS (2020). Una introducción a la industria de la salud de los Estados Unidos: equilibrar la atención, el costo y el acceso. Baltimore: Johns Hopkins University Press. ISBN 978-1-4214-3882-5.
- ^ Vani A (6 de noviembre de 2013). "¿Para Stent o no para Stent?". Correlaciones clínicas. Departamento de Medicina de la Universidad de Nueva York. Archivado desde el original el 24 de noviembre de 2023. Retrieved 24 de noviembre 2023.
- ^ Kureshi F, Jones PG, Buchanan DM, Abdallah MS, Spertus JA (septiembre de 2014). "Variación en las percepciones de los pacientes de intervención coronaria percutánea electiva en enfermedad coronaria estable: estudio transversal de la sección". BMJ. 349: g5309. doi:10.1136/bmj.g5309. PMC 4157615. PMID 25200209.
- ^ "Expert Answers on E.M.D.R." Consults Blog. The New York Times. 16 de marzo de 2012. Archivado desde el original el 21 de enero de 2024. Retrieved 24 de noviembre 2023.
- ^ "Patients Before Profits (1 Letter)". El New York Times. 5 marzo 2012. ISSN 0362-4331. Archivado desde el original el 24 de noviembre de 2023. Retrieved 24 de noviembre 2023.
- ^ John DA (30 de enero de 2013). "El uso de stent innecesario preocupa a los médicos de toda la India". Times of India. Archivado desde el original el 26 de junio de 2017. Retrieved 13 de mayo 2015.
- ^ Hollmer M (30 de enero de 2013). "En India, un llamamiento para detener los incentivos financieros para el uso de stents". Fierce Medical Devices. Archivado desde el original el 18 de mayo de 2015. Retrieved 13 de mayo 2015.
- ^ Nagarajan R (15 de septiembre de 2014). "Profits from medical devices used to bribe doctors?". Los tiempos de la India. Archivado desde el original el 16 de diciembre de 2016. Retrieved 13 de mayo 2015.
- ^ a b Parque A (3 de febrero de 2023). "Boston Scientific finó $42M en demanda de patentes de stent". Fierce Biotech. Archivado desde el original el 24 de noviembre de 2023. Retrieved 24 de noviembre 2023.
- ^ a b "Boston Scientific hit with $42M verdict in drug-eluting stents IP case". 2 febrero 2023. Archivado desde el original el 8 de febrero de 2024. Retrieved 8 de febrero 2024.
- ^ "Anual Review of Medical Device Patent Litigation TEN Publicaciones TENISTERIAS". Faegre Bebedor Biddle & Reath LLP. Archivado desde el original el 24 de noviembre de 2023. Retrieved 24 de noviembre 2023.
- ^ a b "Heart Stent Problems - Drug Eluting Stent Lawsuits". Saiontz & Kirk, P.A. Archivado desde el original el 24 de noviembre de 2023. Retrieved 24 de noviembre 2023.
- ^ a b "Heart Stent Class Action Lawsuit". El Schmidt Firm, PLLC. Archivado desde el original el 24 de noviembre de 2023. Retrieved 24 de noviembre 2023.