Sistema termodinámico
Un sistema termodinámico es un cuerpo de materia y/o radiación, confinado en el espacio por paredes, con permeabilidades definidas, que lo separan de su entorno. El entorno puede incluir otros sistemas termodinámicos o sistemas físicos que no son sistemas termodinámicos. Una pared de un sistema termodinámico puede ser puramente nocional, cuando se describe como "permeable" a toda la materia, toda la radiación y todas las fuerzas. Un estado de un sistema termodinámico se puede describir completamente de varias maneras diferentes, mediante varios conjuntos diferentes de variables de estado termodinámico.
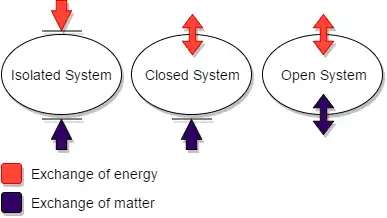
Una distinción ampliamente utilizada es entre sistemas termodinámicos aislados, cerrados y abiertos.
Un sistema termodinámico aislado tiene paredes que no conducen el calor y reflejan perfectamente toda la radiación, que son rígidas e inamovibles, y que son impermeables a todas las formas de materia y todas las fuerzas. (Algunos escritores usan la palabra 'cerrado' cuando aquí se usa la palabra 'aislado').
Un sistema termodinámico cerrado está confinado por paredes que son impermeables a la materia, pero que, mediante operaciones termodinámicas, pueden hacerse alternativamente permeables (descritos como 'diatérmicos') o impermeables ('adiabáticos') al calor, y eso, para los procesos termodinámicos (iniciados y terminado por operaciones termodinámicas), alternativamente se puede permitir o no permitir que se mueva, con cambio de volumen del sistema o agitación con fricción interna en el contenido del sistema, como en la demostración original de Joule del equivalente mecánico del calor, y alternativamente puede hacerse rugoso o liso., para permitir o no permitir el calentamiento del sistema por fricción en su superficie.
Un sistema termodinámico abierto tiene al menos una pared que lo separa de otro sistema termodinámico, el cual para estos efectos se cuenta como parte del entorno del sistema abierto, siendo la pared permeable a al menos una sustancia química, así como a la radiación; tal pared, cuando el sistema abierto está en equilibrio termodinámico, no soporta una diferencia de temperatura a través de sí misma.
Un sistema termodinámico está sujeto a intervenciones externas llamadas operaciones termodinámicas; estos alteran las paredes del sistema o su entorno; como resultado, el sistema sufre procesos termodinámicos transitorios según los principios de la termodinámica. Tales operaciones y procesos efectúan cambios en el estado termodinámico del sistema.
Cuando las variables de estado intensivas de su contenido varían en el espacio, un sistema termodinámico puede considerarse como muchos sistemas contiguos entre sí, siendo cada uno un sistema termodinámico diferente.
Un sistema termodinámico puede comprender varias fases, como hielo, agua líquida y vapor de agua, en equilibrio termodinámico mutuo, sin separarse entre sí por ninguna pared; o puede ser homogéneo. Dichos sistemas pueden considerarse como 'simples'.
Un sistema termodinámico 'compuesto' puede comprender varios subsistemas termodinámicos simples, separados entre sí por una o varias paredes de permeabilidades respectivas definidas. A menudo es conveniente considerar tal sistema compuesto inicialmente aislado en un estado de equilibrio termodinámico, luego afectado por una operación termodinámica de aumento de alguna permeabilidad de la pared entre subsistemas, para iniciar un proceso termodinámico transitorio, a fin de generar un final. nuevo estado de equilibrio termodinámico. Esta idea fue utilizada, y quizás introducida, por Carathéodory. En un sistema compuesto, inicialmente aislado en un estado de equilibrio termodinámico, una reducción de la permeabilidad de una pared no produce un proceso termodinámico, ni un cambio de estado termodinámico. Esta diferencia expresa la Segunda Ley de la termodinámica.
En termodinámica de equilibrio, el estado de un sistema termodinámico es un estado de equilibrio termodinámico, a diferencia de un estado de no equilibrio.
De acuerdo con las permeabilidades de las paredes de un sistema, se producen transferencias de energía y materia entre éste y su entorno, que se suponen invariables en el tiempo, hasta alcanzar un estado de equilibrio termodinámico. Los únicos estados considerados en la termodinámica de equilibrio son los estados de equilibrio. La termodinámica clásica incluye (a) termodinámica de equilibrio; (b) sistemas considerados en términos de secuencias cíclicas de procesos más que de estados del sistema; tales fueron históricamente importantes en el desarrollo conceptual del tema. Los sistemas considerados en términos de procesos persistentes descritos por flujos constantes son importantes en ingeniería.
La existencia misma del equilibrio termodinámico, que define los estados de los sistemas termodinámicos, es el postulado esencial, característico y más fundamental de la termodinámica, aunque rara vez se cita como una ley numerada. Según Bailyn, la declaración comúnmente ensayada de la ley cero de la termodinámica es una consecuencia de este postulado fundamental. En realidad, prácticamente nada en la naturaleza está en estricto equilibrio termodinámico, pero el postulado del equilibrio termodinámico a menudo proporciona idealizaciones o aproximaciones muy útiles, tanto teórica como experimentalmente; los experimentos pueden proporcionar escenarios de equilibrio termodinámico práctico.
En termodinámica de equilibrio las variables de estado no incluyen flujos porque en un estado de equilibrio termodinámico todos los flujos tienen valores cero por definición. Los procesos termodinámicos de equilibrio pueden involucrar flujos, pero estos deben haber cesado en el momento en que se completa un proceso u operación termodinámica, lo que lleva a un sistema a su estado termodinámico final. La termodinámica de no equilibrio permite que sus variables de estado incluyan flujos distintos de cero, que describen transferencias de masa o energía o entropía entre un sistema y su entorno.
En 1824, Sadi Carnot describió un sistema termodinámico como la sustancia de trabajo (como el volumen de vapor) de cualquier motor térmico en estudio.
Visión de conjunto
El equilibrio termodinámico se caracteriza por la ausencia de flujo de masa o energía. La termodinámica del equilibrio, como materia de física, considera cuerpos macroscópicos de materia y energía en estados de equilibrio termodinámico interno. Utiliza el concepto de procesos termodinámicos, por los cuales los cuerpos pasan de un estado de equilibrio a otro por transferencia de materia y energía entre ellos. El término "sistema termodinámico" se utiliza para referirse a cuerpos de materia y energía en el contexto especial de la termodinámica. Los posibles equilibrios entre cuerpos están determinados por las propiedades físicas de las paredes que separan los cuerpos. La termodinámica de equilibrio en general no mide el tiempo. La termodinámica del equilibrio es un tema relativamente simple y bien resuelto. Una razón de esto es la existencia de una cantidad física bien definida llamada '
La termodinámica del no equilibrio, como tema de la física, considera cuerpos de materia y energía que no están en estados de equilibrio termodinámico interno, pero que por lo general participan en procesos de transferencia que son lo suficientemente lentos como para permitir la descripción en términos de cantidades que están estrechamente relacionadas. a las variables de estado termodinámicas. Se caracteriza por la presencia de flujos de materia y energía. Para este tema, muy a menudo los cuerpos considerados tienen inhomogeneidades espaciales suaves, por lo que los gradientes espaciales, por ejemplo, un gradiente de temperatura, están suficientemente bien definidos. Así, la descripción de los sistemas termodinámicos que no están en equilibrio es una teoría de campo, más complicada que la teoría de la termodinámica en equilibrio. La termodinámica de no equilibrio es un tema en crecimiento, no un edificio establecido. En general, no es posible encontrar una entropía exactamente definida para problemas de no equilibrio. Para muchos problemas termodinámicos de no equilibrio, una cantidad aproximadamente definida llamada "tasa de producción de entropía en el tiempo" es muy útil. La termodinámica de no equilibrio está más allá del alcance del presente artículo.
En ingeniería se considera otro tipo de sistema termodinámico. Participa en un proceso de flujo. La explicación se da en términos que aproximan, bastante bien en la práctica en muchos casos, conceptos termodinámicos de equilibrio. Esto está más allá del alcance del presente artículo y se establece en otros artículos, por ejemplo, el proceso de flujo del artículo.
Historia
El primero en crear el concepto de un sistema termodinámico fue el físico francés Sadi Carnot, cuyas Reflexiones sobre la potencia motriz del fuego de 1824 estudiaron lo que él llamó la sustancia de trabajo, por ejemplo, típicamente un cuerpo de vapor de agua, en las máquinas de vapor, con respecto a la capacidad del sistema para realizar trabajo cuando se le aplica calor. La sustancia de trabajo podría ponerse en contacto con un depósito de calor (una caldera), un depósito frío (una corriente de agua fría) o un pistón (sobre el cual el cuerpo de trabajo podría trabajar empujándolo). En 1850, el físico alemán Rudolf Clausius generalizó esta imagen para incluir el concepto de entorno y comenzó a referirse al sistema como un "cuerpo de trabajo". En su manuscrito de 1850 Sobre la fuerza motriz del fuego, Clausius escribió:
“Con cada cambio de volumen (para el cuerpo de trabajo), el gas o sobre él debe realizar una cierta cantidad de trabajo, ya que por su expansión vence una presión externa, y dado que su compresión solo puede lograrse por un ejercicio de fuerza externa. A este exceso de trabajo realizado por el gas o sobre él debe corresponder, según nuestro principio, un exceso proporcional de calor consumido o producido, y el gas no puede ceder al "medio circundante" la misma cantidad de calor que recibe".
El artículo Motor térmico de Carnot muestra el diagrama original de pistón y cilindro utilizado por Carnot al discutir su motor ideal; a continuación, vemos el motor de Carnot como se modela típicamente en el uso actual:
 Diagrama de motor de Carnot (moderno): donde el calor fluye desde un horno
Diagrama de motor de Carnot (moderno): donde el calor fluye desde un horno
T H de alta temperatura a través del fluido del "cuerpo de trabajo" (sustancia de trabajo) y hacia el disipador frío
T C, lo que obliga a la sustancia de trabajo a realizar trabajo mecánico
W en el entorno, a través de ciclos de contracciones y expansiones.
En el diagrama que se muestra, el "cuerpo de trabajo" (sistema), un término introducido por Clausius en 1850, puede ser cualquier cuerpo de fluido o vapor a través del cual se puede introducir o transmitir calor Q para producir trabajo. En 1824, Sadi Carnot, en su famoso artículo Reflexiones sobre la fuerza motriz del fuego, había postulado que el cuerpo fluido podía ser cualquier sustancia capaz de expandirse, como el vapor de agua, el vapor de alcohol, el vapor de mercurio, un gas permanente, o aire, etc. Aunque, en estos primeros años, los motores venían en varias configuraciones, típicamente Q H era alimentado por una caldera, donde el agua hervía sobre un horno; QC _era típicamente una corriente de agua fría que fluía en forma de un condensador ubicado en una parte separada del motor. El trabajo de salida W era el movimiento del pistón al hacer girar una manivela, que típicamente hacía girar una polea para sacar agua de las minas de sal inundadas. Carnot definió el trabajo como "peso levantado a través de una altura".
Sistemas en equilibrio
En el equilibrio termodinámico, las propiedades de un sistema son, por definición, inmutables en el tiempo. Los sistemas en equilibrio son mucho más simples y fáciles de entender que los sistemas que no están en equilibrio. En algunos casos, cuando se analiza un proceso termodinámico, se puede suponer que cada estado intermedio del proceso está en equilibrio. Esto simplifica considerablemente el análisis.
En sistemas aislados se observa consistentemente que a medida que pasa el tiempo los reordenamientos internos disminuyen y se acercan a condiciones estables. Las presiones y las temperaturas tienden a igualarse y la materia se ordena en una o varias fases relativamente homogéneas. Un sistema en el que todos los procesos de cambio se han completado prácticamente se considera en un estado de equilibrio termodinámico. Las propiedades termodinámicas de un sistema en equilibrio no cambian en el tiempo. Los estados de equilibrio del sistema son mucho más fáciles de describir de manera determinista que los estados de no equilibrio.
Para que un proceso sea reversible, cada paso del proceso debe ser reversible. Para que un paso en un proceso sea reversible, el sistema debe estar en equilibrio durante todo el paso. Ese ideal no se puede lograr en la práctica porque no se puede dar ningún paso sin perturbar el equilibrio del sistema, pero se puede alcanzar el ideal haciendo cambios lentamente.
Paredes
| tipo de pared | tipo de transferencia | ||
|---|---|---|---|
| Materia | Trabaja | Calor | |
| permeable a la materia | |||
| permeable a la energía peroimpermeable a la materia | |||
| adiabático | |||
| adinámico yimpermeable a la materia | |||
| aislando |
Un sistema está encerrado por muros que lo limitan y lo conectan con su entorno. A menudo, una pared restringe el paso a través de alguna forma de materia o energía, lo que hace que la conexión sea indirecta. A veces una pared no es más que una superficie cerrada bidimensional imaginaria a través de la cual la conexión con el entorno es directa.
Una pared puede ser fija (por ejemplo, un reactor de volumen constante) o móvil (por ejemplo, un pistón). Por ejemplo, en un motor alternativo, una pared fija significa que el pistón está bloqueado en su posición; entonces, puede ocurrir un proceso de volumen constante. En ese mismo motor, se puede desbloquear un pistón y permitir que se mueva hacia adentro y hacia afuera. Idealmente, un muro puede declararse adiabático, diatérmico, impermeable, permeable o semipermeable. Los materiales físicos reales que proporcionan paredes con propiedades tan idealizadas no siempre están disponibles.
El sistema está delimitado por muros o límites, ya sean reales o teóricos, a través de los cuales las cantidades conservadas (como la materia y la energía) o no conservadas (como la entropía) pueden entrar y salir del sistema. El espacio fuera del sistema termodinámico se conoce como entorno, reservorio o medio ambiente. Las propiedades de las paredes determinan qué transferencias pueden ocurrir. Se dice que una pared que permite la transferencia de una cantidad es permeable a ella, y un sistema termodinámico se clasifica por las permeabilidades de sus diversas paredes. Una transferencia entre el sistema y los alrededores puede surgir por contacto, como la conducción de calor, o por fuerzas de largo alcance, como un campo eléctrico en los alrededores.
Se dice que un sistema con paredes que impiden todas las transferencias está aislado. Esta es una concepción idealizada, porque en la práctica siempre es posible alguna transferencia, por ejemplo, por fuerzas gravitatorias. Es un axioma de la termodinámica que un sistema aislado eventualmente alcanza el equilibrio termodinámico interno, cuando su estado ya no cambia con el tiempo.
Las paredes de un sistema cerrado permiten la transferencia de energía en forma de calor y trabajo, pero no de materia, entre él y su entorno. Las paredes de un sistema abierto permiten la transferencia tanto de materia como de energía. Este esquema de definición de términos no se usa uniformemente, aunque es conveniente para algunos propósitos. En particular, algunos escritores usan 'sistema cerrado' donde aquí se usa 'sistema aislado'.
Cualquier cosa que cruce la frontera y efectúe un cambio en el contenido del sistema debe ser contabilizado en una ecuación de balance apropiada. El volumen puede ser la región que rodea a un solo átomo de energía resonante, como lo definió Max Planck en 1900; puede ser un cuerpo de vapor o aire en una máquina de vapor, tal como lo definió Sadi Carnot en 1824. También podría ser un solo nucleido (es decir, un sistema de quarks) como se planteó como hipótesis en la termodinámica cuántica.
Alrededores
El sistema es la parte del universo que se estudia, mientras que el entorno es el resto del universo que se encuentra fuera de los límites del sistema. También se le conoce como el medio ambiente o el embalse. Dependiendo del tipo de sistema, puede interactuar con el sistema intercambiando masa, energía (incluyendo calor y trabajo), cantidad de movimiento, carga eléctrica u otras propiedades conservadas. El entorno se ignora en el análisis del sistema, excepto en lo que respecta a estas interacciones.
Sistema cerrado
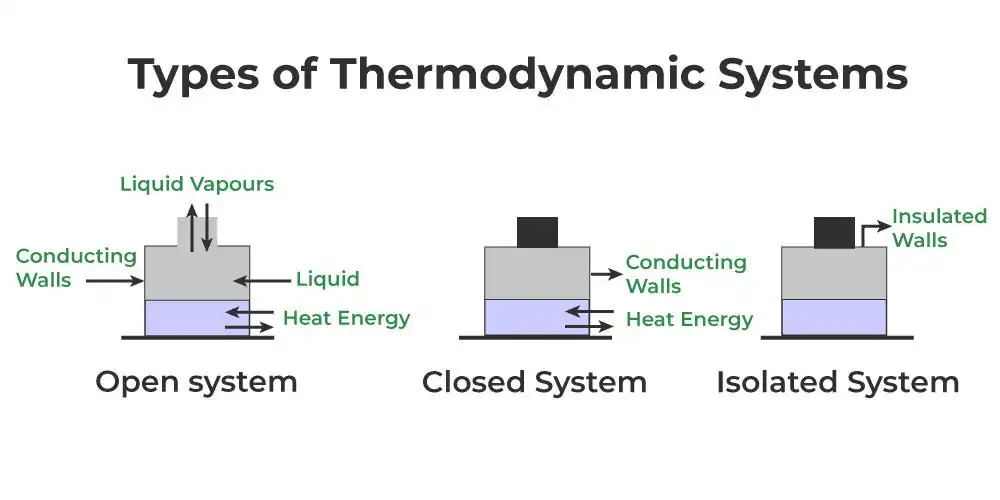
En un sistema cerrado, no se puede transferir masa dentro o fuera de los límites del sistema. El sistema siempre contiene la misma cantidad de materia, pero el calor y el trabajo pueden intercambiarse a través de los límites del sistema. Que un sistema pueda intercambiar calor, trabajo o ambos depende de la propiedad de su frontera.
- Límite adiabático: no permite ningún intercambio de calor: un sistema aislado térmicamente
- Límite rígido que no permite el intercambio de trabajo: un sistema mecánicamente aislado
Un ejemplo es el fluido comprimido por un pistón en un cilindro. Otro ejemplo de un sistema cerrado es una bomba calorimétrica, un tipo de calorímetro de volumen constante que se usa para medir el calor de combustión de una reacción en particular. La energía eléctrica viaja a través del límite para producir una chispa entre los electrodos e inicia la combustión. La transferencia de calor se produce a través del límite después de la combustión, pero no se produce transferencia de masa en ningún sentido.
La primera ley de la termodinámica para transferencias de energía para sistemas cerrados puede enunciarse:
donde 


Si el trabajo se debe a una expansión de volumen por 

Para una transferencia de calor casi reversible, la segunda ley de la termodinámica dice:
donde 

Para un sistema simple, con un solo tipo de partícula (átomo o molécula), un sistema cerrado equivale a un número constante de partículas. Para los sistemas que experimentan una reacción química, puede haber todo tipo de moléculas generadas y destruidas por el proceso de reacción. En este caso, el hecho de que el sistema sea cerrado se expresa afirmando que se conserva el número total de cada átomo elemental, sin importar de qué tipo de molécula forme parte. Matemáticamente:
donde 






Sistema aislado
Un sistema aislado es más restrictivo que un sistema cerrado ya que no interactúa con su entorno de ninguna manera. La masa y la energía permanecen constantes dentro del sistema y no se produce ninguna transferencia de energía o masa a través de la frontera. A medida que pasa el tiempo en un sistema aislado, las diferencias internas en el sistema tienden a nivelarse y las presiones y temperaturas tienden a igualarse, al igual que las diferencias de densidad. Un sistema en el que todos los procesos de igualación se han completado prácticamente se encuentra en un estado de equilibrio termodinámico.
Los sistemas físicos verdaderamente aislados no existen en la realidad (excepto quizás para el universo como un todo), porque, por ejemplo, siempre hay gravedad entre un sistema con masa y masas en otros lugares. Sin embargo, los sistemas reales pueden comportarse casi como un sistema aislado durante tiempos finitos (posiblemente muy largos). El concepto de un sistema aislado puede servir como un modelo útil que se aproxima a muchas situaciones del mundo real. Es una idealización aceptable utilizada en la construcción de modelos matemáticos de ciertos fenómenos naturales.
En el intento de justificar el postulado del aumento de entropía en la segunda ley de la termodinámica, el teorema H de Boltzmann utilizó ecuaciones que suponían que un sistema (por ejemplo, un gas) estaba aislado. Esos son todos los grados de libertad mecánicos que podrían especificarse, tratando las paredes simplemente como condiciones de contorno de espejo. Esto inevitablemente condujo a la paradoja de Loschmidt. Sin embargo, si se considera el comportamiento estocástico de las moléculas en las paredes reales, junto con el efecto aleatorio de la radiación térmica ambiental de fondo, la suposición de caos molecular de Boltzmann puede justificarse.
La segunda ley de la termodinámica para sistemas aislados establece que la entropía de un sistema aislado que no está en equilibrio tiende a aumentar con el tiempo, acercándose al valor máximo en equilibrio. En general, en un sistema aislado, la energía interna es constante y la entropía nunca puede disminuir. La entropía de un sistema cerrado puede disminuir, por ejemplo, cuando se extrae calor del sistema.
Es importante señalar que los sistemas aislados no son equivalentes a los sistemas cerrados. Los sistemas cerrados no pueden intercambiar materia con el entorno, pero pueden intercambiar energía. Los sistemas aislados no pueden intercambiar ni materia ni energía con su entorno, y como tales son sólo teóricos y no existen en la realidad (excepto, posiblemente, el universo entero).
Vale la pena señalar que 'sistema cerrado' se usa a menudo en discusiones de termodinámica cuando 'sistema aislado' sería correcto, es decir, se supone que la energía no entra ni sale del sistema.
Transferencia selectiva de materia
Para un proceso termodinámico, las propiedades físicas precisas de las paredes y los alrededores del sistema son importantes, porque determinan los posibles procesos.
Un sistema abierto tiene una o varias paredes que permiten la transferencia de materia. Para dar cuenta de la energía interna del sistema abierto, esto requiere términos de transferencia de energía además de los de calor y trabajo. También conduce a la idea del potencial químico.
Una pared selectivamente permeable solo a una sustancia pura puede poner el sistema en contacto difusivo con un reservorio de esa sustancia pura en los alrededores. Entonces es posible un proceso en el que esa sustancia pura se transfiera entre el sistema y el entorno. Además, a través de esa pared es posible un equilibrio de contacto con respecto a esa sustancia. Mediante operaciones termodinámicas adecuadas, el depósito de sustancia pura puede tratarse como un sistema cerrado. Su energía interna y su entropía se pueden determinar en función de su temperatura, presión y número de moles.
Una operación termodinámica puede volver impermeable a la materia todas las paredes del sistema que no sean la pared de equilibrio de contacto para esa sustancia. Esto permite la definición de una variable de estado intensivo, con respecto a un estado de referencia del entorno, para esa sustancia. La variable intensiva se llama potencial químico; para la sustancia componente i, generalmente se denota como μ i. La variable extensiva correspondiente puede ser el número de moles N i de la sustancia componente en el sistema.
Para un equilibrio de contacto a través de una pared permeable a una sustancia, los potenciales químicos de la sustancia deben ser los mismos a ambos lados de la pared. Esto es parte de la naturaleza del equilibrio termodinámico y puede considerarse relacionado con la ley cero de la termodinámica.
Sistema abierto
En un sistema abierto, hay un intercambio de energía y materia entre el sistema y el entorno. La presencia de reactivos en un vaso de precipitados abierto es un ejemplo de un sistema abierto. Aquí el límite es una superficie imaginaria que encierra el vaso de precipitados y los reactivos. Se denomina cerrada, si las fronteras son impenetrables para la sustancia, pero permiten el tránsito de energía en forma de calor, y aislada, si no hay intercambio de calor y sustancias. El sistema abierto no puede existir en el estado de equilibrio. Para describir la desviación del sistema termodinámico del equilibrio, además de las variables constitutivas que se describieron anteriormente, un conjunto de variables internas 
 | (1) |
donde 

La contribución específica a la termodinámica de los sistemas abiertos fuera del equilibrio fue realizada por Ilya Prigogine, quien investigó un sistema de sustancias que reaccionan químicamente. En este caso, las variables internas parecen ser medidas de incompletitud de las reacciones químicas, es decir, medidas de cuánto está fuera de equilibrio el sistema considerado con reacciones químicas. La teoría se puede generalizar para considerar cualquier desviación del estado de equilibrio, como la estructura del sistema, los gradientes de temperatura, la diferencia de concentraciones de sustancias, etc., por no hablar de los grados de completitud de todas las reacciones químicas, como internas. variables
Los incrementos de la energía libre de Gibbs 



 | (2) |
 | (3) |
Los estados estacionarios del sistema existen debido al intercambio de energía térmica 





Esta aproximación al sistema abierto permite describir el crecimiento y desarrollo de los objetos vivos en términos termodinámicos.
Contenido relacionado
Eje óptico
Proceso endotérmico
Augustin-Louis Cauchy





