Sintetasa de ácidos grasos
La sintasa de ácidos grasos es una proteína multienzimática que cataliza la síntesis de ácidos grasos. No es una enzima única, sino un sistema enzimático completo compuesto por dos polipéptidos multifuncionales idénticos de 272 kDa, en los que los sustratos se transfieren de un dominio funcional al siguiente.
Su función principal es catalizar la síntesis de palmitato (C16:0, un ácido graso saturado de cadena larga) a partir de acetil-CoA y malonil-CoA, en presencia de NADPH.
Los ácidos grasos se sintetizan mediante una serie de reacciones de condensación de Claisen descarboxilativas a partir de acetil-CoA y malonil-CoA. Después de cada ronda de elongación, el grupo beta ceto se reduce a la cadena carbonada completamente saturada mediante la acción secuencial de una cetorreductasa (KR), una deshidratasa (DH) y una enoil reductasa (ER). La cadena de ácidos grasos en crecimiento se transporta entre estos sitios activos mientras está unida covalentemente al grupo prostético fosfopanteteína de una proteína transportadora de acilo (ACP), y se libera mediante la acción de una tioesterasa (TE) al alcanzar una longitud de cadena carbonada de 16 (ácido palmítico).
Clases
Existen dos clases principales de sintetasas de ácidos grasos.
- Los sistemas Tipo I utilizan un solo polipéptido grande y multifuncional y son comunes a los animales y hongos (aunque el arreglo estructural de las sintetías fúngicas y animales difiere). En el grupo de bacterias CMN se encuentra también un sistema de sintesis de ácidos grasos tipo I (corynebacteria, micobacteria y nocardia). En estas bacterias, el sistema FAS I produce ácido palmítico y coopera con el sistema FAS II para producir una mayor diversidad de productos lípidos.
- El tipo II se encuentra en arqueas, bacterias y plastoides vegetales, y se caracteriza por el uso de enzimas discretas y monofuncionales para la síntesis de ácidos grasos. Los inhibidores de esta vía (FASII) están siendo investigados como posibles antibióticos.
El mecanismo de elongación y reducción de FAS I y FAS II es el mismo, ya que los dominios de las enzimas FAS II son en gran medida homólogos a sus contrapartes de dominio en los polipéptidos multienzimáticos FAS I. Sin embargo, las diferencias en la organización de las enzimas (integradas en FAS I, discretas en FAS II) dan lugar a muchas diferencias bioquímicas importantes.
La historia evolutiva de las sintetasas de ácidos grasos está muy entrelazada con la de las sintetasas de policétidos (PKS). Las sintetasas de policétidos utilizan un mecanismo similar y dominios homólogos para producir lípidos metabolitos secundarios. Además, las sintetasas de policétidos también presentan una organización de tipo I y tipo II. Se cree que la sintetasa de ácidos grasos I en animales surgió a través de la modificación de la PKS I en hongos, mientras que la sintetasa de ácidos grasos I en hongos y el grupo de bacterias CMN parecen haber surgido por separado a través de la fusión de genes de la sintetasa de ácidos grasos II.
Estructura
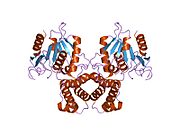
La FAS de los mamíferos consiste en un homodímero de dos subunidades proteicas idénticas, en el que tres dominios catalíticos en la sección N-terminal (β-cetoacil sintasa (KS), malonil/acetiltransferasa (MAT) y deshidrasa (DH)), están separados por una región central (conocida como interdominio) de 600 residuos de cuatro dominios C-terminales (enoil reductasa (ER), β-cetoacil reductasa (KR), proteína transportadora de acilo (ACP) y tioesterasa (TE)). La región interdominio permite que los dos dominios monoméricos formen un dímero.
El modelo convencional para la organización de FAS (ver el modelo "cabeza a cola" a la derecha) se basa en gran medida en las observaciones de que el reactivo bifuncional 1,3-dibromopropanona (DBP) es capaz de reticular el tiol de cisteína del sitio activo del dominio KS en un monómero de FAS con el grupo prostético fosfopanteteína del dominio ACP en el otro monómero. El análisis de complementación de los dímeros de FAS que llevan diferentes mutaciones en cada monómero ha establecido que los dominios KS y MAT pueden cooperar con el ACP de cualquiera de los monómeros. y una nueva investigación de los experimentos de reticulación de DBP reveló que el tiol Cys161 del sitio activo de KS podría reticularse con el tiol ACP 4'-fosfopanteteína de cualquiera de los monómeros. Además, se ha informado recientemente que un FAS heterodímero que contiene sólo un monómero competente es capaz de sintetizar palmitato.
Las observaciones anteriores parecían incompatibles con el modelo clásico de "cabeza a cola" para la organización de FAS, y se ha propuesto un modelo alternativo, que predice que los dominios KS y MAT de ambos monómeros se encuentran más cerca del centro del dímero de FAS, donde pueden acceder al ACP de cualquiera de las subunidades (ver la figura en la parte superior derecha).
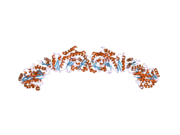
Se ha resuelto la estructura cristalográfica de rayos X de baja resolución de FAS de cerdo (homodímero) y de levadura (heterododecámero) junto con una estructura de FAS de levadura obtenida por criomicroscopía electrónica (crio-EM) con una resolución de ~6 Å.
Mecanismo de cierre de sustrato
Las estructuras resueltas de la FAS de levadura y la FAS de mamíferos muestran dos organizaciones distintas de dominios/enzimas catalíticos altamente conservados en esta máquina celular multienzimática. La FAS de levadura tiene una estructura rígida en forma de barril altamente eficiente con 6 cámaras de reacción que sintetizan ácidos grasos de forma independiente, mientras que la FAS de mamíferos tiene una estructura abierta y flexible con solo dos cámaras de reacción. Sin embargo, en ambos casos el ACP conservado actúa como el dominio móvil responsable de transportar los sustratos de ácidos grasos intermedios a varios sitios catalíticos. Una primera visión estructural directa de este mecanismo de transporte de sustratos se obtuvo mediante análisis crio-EM, donde se observa que el ACP está unido a los diversos dominios catalíticos en la sintasa de ácidos grasos de levadura en forma de barril. Los resultados crio-EM sugieren que la unión del ACP a varios sitios es asimétrica y estocástica, como también lo indican los estudios de simulación por computadora.
Reglamento
El metabolismo y la homeostasis de la sintasa de ácidos grasos están regulados transcripcionalmente por los factores estimulantes ascendentes (USF1 y USF2) y la proteína de unión al elemento regulador de esteroles 1c (SREBP-1c) en respuesta a la alimentación/insulina en animales vivos.
Aunque los receptores X del hígado (LXR) modulan la expresión de la proteína de unión al elemento regulador de esteroles 1c (SREBP-1c) durante la alimentación, la regulación de la FAS por SREBP-1c depende del USF.
Los acilfloroglucinoles aislados del helecho Dryopteris crassirhizoma muestran una actividad inhibidora de la sintetasa de ácidos grasos.
Significado clínico
El gen FASN ha sido investigado como posible oncogén. El FAS está sobreexpresado en los cánceres de mama y gástrico, además de ser un indicador de mal pronóstico, por lo que puede ser útil como objetivo quimioterapéutico. Por lo tanto, los inhibidores de FAS son un área activa de investigación para el descubrimiento de fármacos.
El FAS también puede estar involucrado en la producción de un ligando endógeno para el receptor nuclear PPARalfa, el objetivo de los fármacos fibratos para la hiperlipidemia, y se está investigando como un posible objetivo farmacológico para el tratamiento del síndrome metabólico. El orlistat, que es un inhibidor de la lipasa gastrointestinal, también inhibe el FAS y tiene potencial como medicamento contra el cáncer.
En algunas líneas celulares cancerosas, se ha descubierto que esta proteína está fusionada con el receptor de estrógeno alfa (ER-alfa), en el que el extremo N-terminal de FAS está fusionado en marco con el extremo C-terminal de ER-alfa.
Se ha informado de una asociación con leiomiomas uterinos.
Véase también
- Descubrimiento y desarrollo de inhibidores de la lipasa gastrointestinal
- Síntesis de ácido graso
- metabolismo de ácidos grasos
- Degradación de ácidos grasos
- Reductasa de proteína portadora de enoilo
- Lista de trastornos del metabolismo del ácido graso
Referencias
- ^ a b c Paiva P, Medina FE, Viegas M, Ferreira P, Neves RP, Sousa JP, Ramos MJ, Fernandes PA (2021-08-11). "Animal Fatty Acid Synthase: A Chemical Nanofactory". Reseñas químicas. 121 (15): 9502–9553. doi:10.1021/acs.chemrev.1c00147. ISSN 0009-2665. S2CID 235595027.
- ^ Jayakumar A, Chirala SS, Chinault AC, Baldini A, Abu-Elheiga L, Wakil SJ (febrero de 1995). "Isolación y cartografía cromosómica de clones genómicos encodificando el gen de sintetasa de ácido graso humano". Genómica. 23 (2): 420-424. doi:10.1006/geno.1994.1518. PMID 7835891.
- ^ Jayakumar A, Tai MH, Huang WY, al-Feel W, Hsu M, Abu-Elheiga L, Chirala SS, Wakil SJ (Oct 1995). "Sintesis de ácido graso humano: propiedades y clonación molecular". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 92 (19): 8695–8699. Código:1995PNAS...92.8695J. doi:10.1073/pnas.92.19.8695. PMC 41033. PMID 7567999.
- ^ Persson B, Kallberg Y, Bray JE, Bruford E, Dellaporta SL, Favia AD, Duarte RG, Jörnvall H, Kavanagh KL, Kedishvili N, Kisiela M, Maser E, Mindnich R, Orchard S, Penning TM, Thornton JM, Adamski J, Oppermann U (Feb 2009). "La iniciativa de nomenclatura de la SDR (dehidrogenasa/reductasa y enzimas relacionadas con la cadena corta). Interacciones Chemico-Biológicas. 178 (1–3): 94–98. Código:2009CBI...178...94P. doi:10.1016/j.cbi.2008.10.040. PMC 2896744. PMID 19027726.
- ^ a b c "Entrez Gene: FASN sinthase ácido graso".
- ^ Alberts AW, Strauss AW, Hennessy S, Vagelos PR (octubre de 1975). "Regulación de síntesis de sintetizador de ácidos grasos hepáticos: unión de anticuerpos de sintetosis de ácidos grasos a poliomas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 72 (10): 3956–3960. Bibcode:1975PNAS...72.3956A. doi:10.1073/pnas.72.10.3956. PMC 433116. PMID 1060077.
- ^ Stoops JK, Arslanian MJ, Oh YH, Aune KC, Vanaman TC, Wakil SJ (Mayo 1975). "Presence of two polypeptide chains comprising fatty acid synthetase". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 72 (5): 1940-1944. Bibcode:1975PNAS...72.1940S doi:10.1073/pnas.72.5.1940. PMC 432664. PMID 1098047.
- ^ Smith S, Agradi E, Libertini L, Dileepan KN (abril de 1976). "La liberación específica del componente de la tioesterasa del complejo multienzima de ácido graso por la trippsinización limitada". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 73 (4): 1184-1188. Bibcode:1976PNAS...73.1184S. doi:10.1073/pnas.73.4.1184. PMC 430225. PMID 1063400.
- ^ Smith S, Witkowski A, Joshi AK (julio de 2003). "Organización estructural y funcional del ácido graso animal sinthase". Progress in Lipid Research. 42 (4): 289–317. doi:10.1016/S0163-7827(02)00067-X. PMID 12689621.
- ^ a b Jenke-Kodama H, Sandmann A, Müller R, Dittmann E (octubre de 2005). "Consecuencias evolutivas de los sintéticos de poliketida bacteriana". Biología molecular y evolución. 22 (10): 2027–2039. doi:10.1093/molbev/msi193. PMID 15958783.
- ^ Fulmer T (marzo de 2009). "No tan FAS". Cambio de conocimiento científico. 2 11): 430. doi:10.1038/scibx.2009.430.
- ^ Stevens L, Price NC (1999). Fundamentos de enzimología: la biología celular y molecular de proteínas catalíticas. Oxford [Oxfordshire]: Oxford University Press. ISBN 978-0-19-850229-6.
- ^ a b Chirala SS, Jayakumar A, Gu ZW, Wakil SJ (marzo de 2001). "Sintesis de ácido graso humano: papel de interdominio en la formación de dimer sintético activo catalíticamente". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 98 (6): 3104–3108. Bibcode:2001PNAS...98.3104C. doi:10.1073/pnas.051635998. PMC 30614. PMID 11248039.
- ^ Smith S (diciembre de 1994). "El ácido graso animal sintasa: un gen, un polipéptido, siete enzimas". FASEB Journal. 8 (15): 1248–1259. doi:10.1096/fasebj.8.15.8001737PMID 8001737. S2CID 22853095.
- ^ Stoops JK, Wakil SJ (mayo de 1981). "Sintetasa de ácido graso animal. Un arreglo novedoso de los sitios de sintetasa beta-ketoacyl que comprenden dominios de las dos subunidades". Journal of Biological Chemistry. 256 (10): 5128–5133. doi:10.1016/S0021-9258(19)69376-2. PMID 6112225.
- ^ Stoops JK, Wakil SJ (marzo de 1982). "Sintetasa de ácido graso animal. Identificación de los residuos que comprenden el nuevo arreglo del sitio de sintetasa beta-ketoacilo y su papel en su inactivación fría". Journal of Biological Chemistry. 257 (6): 3230–3235. doi:10.1016/S0021-9258(19)81100-6. PMID 7061475.
- ^ Joshi AK, Rangan VS, Smith S (febrero de 1998). "El etiquetado de afinidad diferencial de las dos subunidades del ácido graso animal homodímico permite el aislamiento de heterodimeros consistentes en subunidades que han sido modificadas independientemente". Journal of Biological Chemistry. 273 (9): 4937–4943. doi:10.1074/jbc.273.9.4937. PMID 9478938.
- ^ Rangan VS, Joshi AK, Smith S (septiembre de 2001). "Mapping the functional topology of the animal fatty acid synthase by mutant complementation in vitro". Bioquímica. 40 (36): 10792–18799. doi:10.1021/bi015535z. PMID 11535054.
- ^ Witkowski A, Joshi AK, Rangan VS, Falick AM, Witkowska HE, Smith S (abril de 1999). "Dibromopropanone cross-linking of the phosphopantetheine and active-site cysteine thiols of the animal fatty acid synthase can occur both inter- and intrasubunit. Reevaluation of the side-by-side, antiparallel subunit model". Journal of Biological Chemistry. 274 (17): 11557–11563. doi:10.1074/jbc.274.17.11557. PMID 10206962.
- ^ Joshi AK, Rangan VS, Witkowski A, Smith S (febrero de 2003). "Engineering of an active animal fatty acid synthase dimer with only one competent subunit". Química y Biología. 10 (2): 169-173. doi:10.1016/S1074-5521(03)00023-1. PMID 12618189.
- ^ Asturias FJ, Chadick JZ, Cheung IK, Stark H, Witkowski A, Joshi AK, Smith S (marzo de 2005). "Strutura y organización molecular de la sinthasa de ácidos grasos mamíferos". Naturaleza Biología estructural y molecular. 12 (3): 225–232. doi:10.1038/nsmb899. PMID 15711565. S2CID 6132878.
- ^ Maier T, Leibundgut M, Ban N (septiembre de 2008). "La estructura cristalina de un ácido graso mamífero sinthase". Ciencia. 321 (5894): 1315–1322. Código:2008...321.1315M. doi:10.1126/ciencia.1161269. PMID 18772430. S2CID 3168991.
- ^ Lomakin IB, Xiong Y, Steitz TA (abril de 2007). "La estructura de cristal de la levadura de ácido graso sinthase, una máquina celular con ocho sitios activos trabajando juntos". Celular. 129 (2): 319-332. doi:10.1016/j.cell.2007.03.013. PMID 17448991. S2CID 8209424.
- ^ a b Gipson P, Mills DJ, Wouts R, Grininger M, Vonck J, Kühlbrandt W (mayo de 2010). "Direct structural insight into the substrate-shuttling mechanism of leeast fatty acid synthase by electron cryomicroscopy". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 107 (20): 9164–9169. Código:2010PNAS..107.9164G. doi:10.1073/pnas.0913547107. PMC 2889056. PMID 20231485.
- ^ Anselmi C, Grininger M, Gipson P, Faraldo-Gómez JD (septiembre de 2010). "Mecanismo de obturación de sustrato por la proteína acyl-carrier dentro de la mega-sintasa ácido graso". Journal of the American Chemical Society. 132 (35): 12357–12364. doi:10.1021/ja103354w. PMID 20704262.
- ^ Paulauskis JD, Sul HS (enero de 1989). "Regulación Hormonal de la transcripción de genes sinthase ácido del ratón en el hígado". Journal of Biological Chemistry. 264 (1): 574-577. doi:10.1016/S0021-9258(17)31298-X. PMID 2535847.
- ^ a b Latasa MJ, Griffin MJ, Moon YS, Kang C, Sul HS (agosto de 2003). "Ocupación y función del elemento regulatorio de esteroles -150 y -65 E-box en regulación nutricional del gen de sintesis ácido graso en animales vivos". Biología molecular y celular. 23 (16): 5896–5907. doi:10.1128/MCB.23.16.5896-5907.2003. PMC 166350. PMID 12897158.
- ^ Griffin MJ, Wong RH, Pandya N, Sul HS (febrero de 2007). "Direct interaction between USF and SREBP-1c mediates synergistic activation of the fatty-acid synthase promoter". Journal of Biological Chemistry. 282 (8): 5453-5467. doi:10.1074/jbc.M610566200. PMID 17197698.
- ^ Yoshikawa T, Shimano H, Amemiya-Kudo M, Yahagi N, Hasty AH, Matsuzaka T, Okazaki H, Tamura Y, Iizuka Y, Ohashi K, Osuga J, Harada K, Gotoda T, Kimura S, Ishibashi S, Yamada N (mayo de 2001). "Identificación del receptor X retinoide del receptor del hígado X como activador de la proteína reguladora de esterol que une el elemento proteína 1c promotor del gen". Biología molecular y celular. 21 (9): 2991-3000. doi:10.1128/MCB.21.9.2991-3000.2001. PMC 86928. PMID 11287605.
- ^ Repa JJ, Liang G, Ou J, Bashmakov Y, Lobaccaro JM, Shimomura I, Shan B, Brown MS, Goldstein JL, Mangelsdorf DJ (noviembre 2000). "Regulación del gen de proteína-1c regulador de elementos esteroles del ratón (SREBP-1c) por receptores de oxysterol, LXRalpha y LXRbeta". Genes " Development. 14 (22): 2819–2830. doi:10.1101/gad.844900. PMC 317055. PMID 11090130.
- ^ Na M, Jang J, Min BS, Lee SJ, Lee MS, Kim BY, Oh WK, Ahn JS (septiembre de 2006). "Fatty acid synthasehibiory activity of acylphloroglucinols isolated from Dryopteris crasirhizoma". Bioorgánico & Medicinal Cartas de química. 16 (18): 4738–4742. doi:10.1016/j.bmcl.2006.07.018. PMID 16870425.
- ^ Barón A, Migita T, Tang D, Loda M (enero de 2004). "Sintasa de ácido débil: un oncogeno metabólico en cáncer de próstata?". Journal of Cellular Biochemistry. 91 (1): 47–53. doi:10.1002/jcb.10708. PMID 14689581. S2CID 26175683.
- ^ Hunt DA, Lane HM, Zygmont ME, Dervan PA, Hennigar RA (2007). "La estabilidad de MRNA y la sobreexpresión de la sintesis de ácidos grasos en las líneas celulares de cáncer de mama humana". Anticancer Research. 27 (1A): 27–34. PMID 17352212.
- ^ Gansler TS, Hardman W, Hunt DA, Schaffel S, Hennigar RA (junio de 1997). "La creciente expresión de sintetas de ácidos grasos (OA-519) en neoplasias ováricas predice una supervivencia más corta". Patología humana. 28 (6): 686–692. doi:10.1016/S0046-8177(97)90177-5. PMID 9191002.
- ^ Ezzeddini R, Taghikhani M, Somi MH, Samadi N, Rasaee, MJ (mayo 2019). "Clinical importance of FASN in relation to HIF-1α and SREBP-1c in gastric adenocarcinoma". Ciencias de la vida. 224: 169–176. doi:10.1016/j.lfs.2019.03.056. PMID 30914315. S2CID 85532042.
- ^ "Primero estudio humano tomando lugar con inhibidor sintético ácido graso". oncotherapynetwork.com. 7 de abril de 2017. Archivado desde el original el 15 de abril de 2019. Retrieved 4 de junio 2018.
- ^ Lu T, Schubert C, Cummings MD, Bignan G, Connolly PJ, Smans K, Ludovici D, Parker MH, Meyer C, Rocaboy C, Alexander R, Grasberger B, De Breucker S, Esser N, Fraiponts E, Gilissen R, Janssens B, Peeters D, Van Nuffel L, Vermeoffel PMay. "Diseño y síntesis de una serie de inhibidores de dominio KR biodisponibles de ácidos grasos (FASN) para terapia de cáncer". Bioorgánico & Medicinal Cartas de química. 28 (12): 2159–2164. doi:10.1016/j.bmcl.2018.05.014. PMID 29779975. S2CID 29159508.
- ^ Hardwicke MA, Rendina AR, Williams SP, Moore ML, Wang L, Krueger JA, Plant RN, Totoritis RD, Zhang G, Briand J, Burkhart WA, Brown KK, Parrish CA (septiembre de 2014). "Un inhibidor de sintetasa de ácido graso humano se une β-ketoacyl reductase en el sitio de ceto-sustrato". Nature Chemical Biology. 10 (9): 774–779. doi:10.1038/nchembio.1603. PMID 25086508.
- ^ Vander Heiden MG, DeBerardinis RJ (Febrero 2017). "Apoyando las intersecciones entre metabolismo y biología del cáncer". Celular. 168 (4): 657–669. doi:10.1016/j.cell.2016.12.039. PMC 5329766. PMID 28187287.
- ^ Sgro CD (2009-01-01). Una investigación sobre la región interdominio de Caenorhabditis elegans sintetiza ácido graso y sus implicaciones como meta de drogas (tesis). La Trobe.
- ^ Chakravarthy MV, Lodhi IJ, Yin L, Malapaka RR, Xu HE, Turk J, Semenkovich CF (agosto de 2009). "Identificación de un ligando endógeno fisiológicamente relevante para PPARalpha en el hígado". Celular. 138 (3): 476-488. doi:10.1016/j.cell.2009.05.036. PMC 2725194. PMID 19646743.
- ^ Wu M, Singh SB, Wang J, Chung CC, Salituro G, Karanam BV, Lee SH, Powles M, Ellsworth KP, Lassman ME, Miller C, Myers RW, Tota MR, Zhang BB, Li C (marzo 2011). "Efectos antidiabéticos y antisteatóticos de la sinthasa de ácido graso selectivo (FAS) inhibidor de la platensimicina en modelos de ratón de diabetes". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 108 (13): 5378–5383. Código:2011PNAS..108.5378W. doi:10.1073/pnas.1002588108. PMC 3069196. PMID 21389266.
- ^ Flavin R, Peluso S, Nguyen PL, Loda M (abril de 2010). "Sintesis de ácido débil como objetivo terapéutico potencial en el cáncer". Future Oncology. 6 (4): 551–562. doi:10.2217/fon.10.11. 3197858. PMID 20373869.
- ^ Richardson RD, Ma G, Oyola Y, Zancanella M, Knowles LM, Cieplak P, Romo D, Smith JW (septiembre de 2008). "Sintesis de los nuevos inhibidores de beta-lactona de la sintesis de ácidos grasos". Revista de Química Medicinal. 51 (17): 5285–5296. doi:10.1021/jm800321h. PMC 3172131. PMID 18710210.
- ^ Eggert SL, Huyck KL, Somasundaram P, Kavalla R, Stewart EA, Lu AT, Painter JN, Montgomery GW, Medland SE, Nyholt DR, Treloar SA, Zondervan KT, Heath AC, Madden PA, Rose L, Buring JE, Ridker PM, Chasman DI, Martin NG, Cantor RM (2012) "Análisis de vinculación y asociación en todo el genoma implican a FASN en predisposición a la leiomyomata uterina". American Journal of Human Genetics. 91 (4): 621-628. doi:10.1016/j.ajhg.2012.08.009. PMC 3484658. PMID 23040493.
Más lectura
- Wakil SJ (1989). "Sintasa de ácido débil, una enzima multifuncional competente". Bioquímica. 28 (11): 4523–4530. doi:10.1021/bi00437a001. PMID 2669958.
- Baron A, Migita T, Tang D, Loda M (2004). "Sintasa de ácido débil: un oncogeno metabólico en cáncer de próstata?". Journal of Cellular Biochemistry. 91 (1): 47–53. doi:10.1002/jcb.10708. PMID 14689581. S2CID 26175683.
- Lejin D (1978). "[Viscosimetry in clinic practice]". Medicinski Pregled. 30 (9–10): 477–482. PMID 600212.
- Wronkowski Z (1976). "[El diagnóstico del cáncer del sistema respiratorio]". Pielȩgniarka I Połozna (12): 7-8. PMID 1044453.
- Semenkovich CF, Coleman T, Fiedorek FT (1995). "Human fatty acid synthase mRNA: tissue distribution, genetic mapping, and kinetics of decay after glucose deprivation". Journal of Lipid Research. 36 (7): 1507-1521. doi:10.1016/S0022-2275(20)39738-8. PMID 7595075.
- Kuhajda FP, Jenner K, Wood FD, Hennigar RA, Jacobs LB, Dick JD, Pasternack GR (1994). "Sintesis de ácido débil: un posible objetivo selectivo para la terapia antineoplásica". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 91 (14): 6379–6383. Código:1994PNAS...91.6379K doi:10.1073/pnas.91.14.6379. PMC 44205. PMID 8022791.
- Hsu MH, Chirala SS, Wakil SJ (1996). "Human fatty-acid synthase gene. Evidencia para la presencia de dos promotores y su interacción funcional". Journal of Biological Chemistry. 271 (23): 13584–13592. doi:10.1074/jbc.271.23.13584. PMID 8662758.
- Pizer ES, Kurman RJ, Pasternack GR, Kuhajda FP (1997). "La expresión de la sintesis de ácidos grasos está estrechamente vinculada a la proliferación y la decidualización estromal en el endometrio ciclista". International Journal of Gynecological Pathology. 16 (1): 45–51. doi:10.1097/00004347-199701000-00008. PMID 8986532. S2CID 45195801.
- Jayakumar A, Chirala SS, Wakil SJ (1997). "Sintasa de ácido graso humano: ensamblar las mitades recombinantes de la proteína de subunidad de ácido graso reconstituye la actividad enzima". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 94 (23): 12326–12330. Código:1997PNAS...9412326J. doi:10.1073/pnas.94.23.12326. PMC 24928. PMID 9356448.
- Kusakabe T, Maeda M, Hoshi N, Sugino T, Watanabe K, Fukuda T, Suzuki T (2000). "La sintasa de ácidos grasos se expresa principalmente en células sensibles a hormonas adultas o células con alto metabolismo lipídico y en células fetales proliferantes". Journal of Histochemistry and Cytochemistry. 48 (5): 613–622. doi:10.1177/002215540004800505. PMID 10769045.
- Ye Q, Chung LW, Li S, Zhau HE (2000). "Identificación de una nueva transcripción de fusión FAS/ER-alpha expresada en células cancerosas humanas". Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression. 1493 (3): 373–377. doi:10.1016/s0167-4781(00)00202-5. PMID 11018265.
- Rochat-Steiner V, Becker K, Micheau O, Schneider P, Burns K, Tschopp J (2000). "FIST/HIPK3: a Fas/FADD-interacting serine/threonine kinase que induce la fosforilación de FADD e inhibe la activación de la cinasa artificial mediada Jun NH(2)-terminal". Journal of Experimental Medicine. 192 (8): 1165–1174. doi:10.1084/jem.192.8.1165. PMC 2311455. PMID 11034606.
- Chirala SS, Jayakumar A, Gu ZW, Wakil SJ (2001). "Sintesis de ácido graso humano: papel de interdominio en la formación de dimer sintético activo catalíticamente". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 98 (6): 3104–3108. Bibcode:2001PNAS...98.3104C. doi:10.1073/pnas.051635998. PMC 30614. PMID 11248039.
- Brink J, Ludtke SJ, Yang CY, Gu ZW, Wakil SJ, Chiu W (2002). "La estructura cuaternaria de la sintesis de ácidos grasos humanos por criomicroscopia electrones". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 99 (1): 138–143. Bibcode:2002PNAS...99..138B. doi:10.1073/pnas.012589499. PMC 117528. PMID 11756679.
- Joseph SB, Laffitte BA, Patel PH, Watson MA, Matsukuma KE, Walczak R, Collins JL, Osborne TF, Tontonoz P (2002). "Mecanismos directos e indirectos para la regulación de la expresión de genes sintátanos ácidos grasos por los receptores del hígado X". Journal of Biological Chemistry. 277 (13): 11019–11025. doi:10.1074/jbc.M111041200. PMID 11790787.
- Ming D, Kong Y, Wakil SJ, Brink J, Ma J (2002). "Los movimientos de dominio en la sintesis de ácidos grasos humanos por modelo deformacional elástico cuantificado". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América. 99 (12): 7895–7899. Bibcode:2002PNAS...99.7895M. doi:10.1073/pnas.112222299. PMC 122991. PMID 12060737.
- Field FJ, Born E, Murthy S, Mathur SN (2003). "Los ácidos grasos poliinsaturados disminuyen la expresión de proteína de unión de elementos esteroles-1 en las células CaCo-2: efecto en la síntesis de ácidos grasos y el transporte triacilglicerol". Biochemical Journal. 368 (Pt 3): 855–864. doi:10.1042/BJ20020731. PMC 1223029. PMID 12213084.
Enlaces externos
- Fatty+Acid+Synthase at the U.S. National Library of Medicine Medical Subject Headings (MeSH)
- Fatty Acid Synthesis: Rensselaer Polytechnic Institute
- Fatty Acid Synthase: RCSB PDB Molécula del Mes Archivado 2014-07-14 en la máquina Wayback
- Estructuras de microscopía de electrones 3D de sintesis de ácidos grasos del EM Data Bank(EMDB)
- PDBe-KB ofrece una visión general de toda la información de la estructura disponible en el PDB para la sintesis de ácido graso humano