Síntesis total de paclitaxel


La Síntesis total de paclitaxel en química orgánica es un importante esfuerzo de investigación en curso en la síntesis total de paclitaxel (Taxol). Este diterpenoide es un fármaco importante en el tratamiento del cáncer, pero también caro porque el compuesto se obtiene de un recurso escaso, a saber, el tejo del Pacífico (Taxus brevifolia). La reproducción sintética del compuesto en sí no sólo es de gran importancia comercial y científica, sino que también abre el camino a derivados del paclitaxel que no se encuentran en la naturaleza pero que tienen mayor potencial.
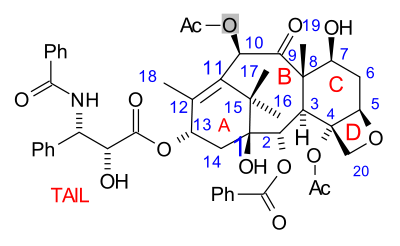
La molécula de paclitaxel consta de un núcleo tetracíclico llamado bacatina III y una cola de amida. Los anillos centrales se denominan convenientemente (de izquierda a derecha) anillo A (un ciclohexeno), anillo B (un ciclooctano), anillo C (un ciclohexano) y anillo D (un oxetano).
El proceso de desarrollo del fármaco paclitaxel duró más de 40 años. La actividad antitumoral de un extracto de corteza del tejo del Pacífico se descubrió en 1963 como seguimiento de un programa de detección de plantas del gobierno de Estados Unidos que ya existía 20 años antes. La sustancia activa responsable de la actividad antitumoral se descubrió en 1969 y la elucidación de la estructura se completó en 1971. Robert A. Holton, de la Universidad Estatal de Florida, logró la síntesis total de paclitaxel en 1994, un proyecto que había iniciado en 1982. En 1989, Holton también desarrolló una ruta semisintética para el paclitaxel a partir de 10-desacetilbacatina III. Este compuesto es un precursor biosintético y se encuentra en mayores cantidades que el propio paclitaxel en el Taxus baccata (el tejo europeo). En 1990 Bristol-Myers Squibb compró una licencia para la patente de este proceso, que en los años siguientes le valió a la Universidad Estatal de Florida y a Holton (con una participación del 40%) más de 200 millones de dólares.
Síntesis total
La síntesis total de taxol se considera una de las más controvertidas de la década de 1990, con alrededor de 30 grupos de investigación compitiendo en 1992. El número de grupos de investigación que realmente han informado sobre una síntesis total actualmente es de 11, con el grupo Holton (artículo primero aceptado para publicación) y el grupo Nicolaou (artículo publicado por primera vez) primero y segundo en lo que se llama un foto final.
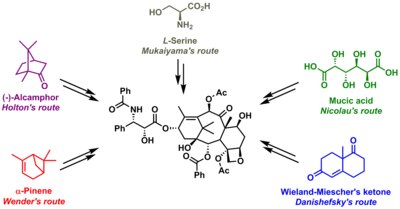
Algunos de los esfuerzos son verdaderamente sintéticos, pero en otros se incluye una molécula precursora que se encuentra en la naturaleza. Los datos clave se recogen a continuación. Lo que todas las estrategias tienen en común es la síntesis de la molécula de bacatina seguida de la última etapa de la adición de la cola, un proceso (excepto uno) basado en la lactama Ojima.
- Holton Taxol síntesis total - año: 1994 - precursor: Estrategia Patchoulol: síntesis lineal AB luego C después D - referencias: ver artículo relacionado
- Nicolaou Taxol síntesis total - año: 1994 - precursor: Estrategia de ácido mucico: síntesis convergente A y C se unen a ABC luego D - referencias: ver artículo relacionado
- Danishefsky Taxol síntesis total - año: 1996 - precursor: Estrategia Wieland-Miescher ketone: síntesis convergente C se fusiona con D luego con A se fusiona con ABCD - referencias: Véase el artículo conexo
- Wender Taxol síntesis total - año: 1997 - precursor: Estrategia Pinene: síntesis lineal AB luego C después D - referencias:
- Kuwajima Resumen total de Taxol I. Kuwajima, - año: 1998 - precursor: estrategia de bloques de construcción sintética: síntesis lineal A then B then C then D
- Mukaiyama Taxol síntesis total - año: 1998 - Precursor: L-serine estrategia: síntesis lineal B, luego C, luego A entonces D. Referencias: ver artículo relacionado.
- Takahashi Taxol síntesis total - año: 2006 - Precursor: estrategia geraniol: síntesis convergente A y C se unen a ABC luego D
- Sato-Chida Resumen total de Taxol - año: 2015, síntesis formal a un intermedio de Takahashi
- Nakada Taxol síntesis total - año: 2015, síntesis formal a un intermedio Takahashi
- Resumen total de Baran Taxol - año: 2020, síntesis total a través de un enfoque sintético de dos fases.
- Li Taxol síntesis total - año: 2021, síntesis total a través del cierre del anillo B mediante la formación de bono C1–C2.
Los esfuerzos de investigación en curso están dirigidos a la síntesis de taxadieno y taxadienona intermedios. Se ha informado sobre la síntesis de taxanos relacionados decinamoiltaxinina E y taxabacatina III.
Semisíntesis
La semisíntesis comercial (de Bristol-Myers Squibb) de paclitaxel a partir de 10-desacetilbacatina III (aislada del tejo europeo) se basa en la adición de la cola de la llamada lactama Ojima a su grupo hidroxilo libre:
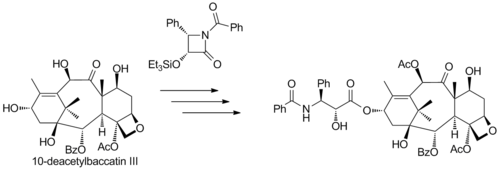
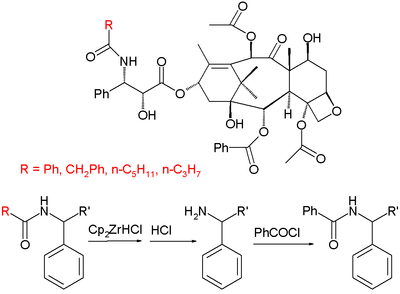
Otra semisíntesis comercial (realizada por la empresa Natural Pharmaceuticals) se basa en el aislamiento de un grupo de derivados de paclitaxel aislados de taxanos ornamentales primarios. Estos derivados tienen el mismo esqueleto que el paclitaxel excepto por el residuo orgánico R del grupo amida de la cola terminal que puede ser fenilo, propilo o pentilo (entre otros), mientras que en el paclitaxel es un grupo fenilo explícito. La semisíntesis consiste en la conversión del grupo amida en una amina con el reactivo de Schwartz a través de una imina seguida de un tratamiento ácido y una benzoilación.
En el proceso de producción, los tejos cultivados en Michigan que maduran en 8 años se cubren y se secan periódicamente. Este material se envía a México para un primer paso de extracción (10 % de contenido de paclitaxel) y luego a Canadá para una purificación adicional hasta un 95 % de pureza. La semisíntesis hasta el producto final se lleva a cabo en China.
Biosíntesis
Se ha investigado la vía biosintética del paclitaxel y consta de aproximadamente 20 pasos enzimáticos. El esquema completo aún no está disponible. Los segmentos que se conocen son muy diferentes de las vías sintéticas probadas hasta ahora (Esquema 1). El compuesto de partida es difosfato de geranilgeranilo 2, que es un dímero de geraniol 1. Este compuesto ya contiene los 20 átomos de carbono necesarios para el esqueleto de paclitaxel. Un mayor cierre del anillo a través del intermediario 3 (taxadieno) conduce a la taxusina 4. Las dos razones principales por las que este tipo de síntesis no es factible en el laboratorio es que la naturaleza hace un trabajo mucho mejor controlando la estereoquímica y activando un esqueleto de hidrocarburo con sustituyentes de oxígeno de los cuales el citocromo P450 es responsable en algunas de las oxigenaciones. El 5 intermedio se llama 10-desacetilbacatina III.
Se informó una producción bioquímica de taxadieno a escala de kilogramos utilizando E. coli en 2011.
Referencias y notas
- ^ Tenga en cuenta que las publicaciones originales sobre la síntesis total utilizan el nombre "taxol", que solía ser el nombre genérico antes de ser aceptado como marca registrada en 1992.
- ^ Nina Hall (2003) "Creando complejidad – la belleza y la lógica de la síntesis" Comuna. 2003 (6), 661-664. doi:10.1039/b212248k
- ^ Robert A. Holton; Carmen Somoza; Hyeong Baik Kim; Feng Liang; Ronald J. Biediger; P. Douglas Boatman; Mitsuru Shindo; Chase C. Smith; Soekchan Kim; Hossain Nadizadeh; Yukio Suzuki; Chunlin Tao; Phong Vu; Suhan Tang; Pingsheng Zhang; Krishna K. Murthi; Lisa N. Gentile; Jyanwei H. Liu (1994). "Primera síntesis total de taxones. 1. Funcionalización del anillo B". J. Am. Chem. Soc. 116 (4): 1597–1598. doi:10.1021/ja00083a066.
- ^ Robert A. Holton; Hyeong-Baik Kim; Carmen Somoza; Feng Liang; Ronald J. Biediger; P. Douglas Boatman; Mitsuru Shindo; Chase C. Smith; Soekchan Kim; Hossain Nadizadeh; Yukio Suzuki; Chunlin Tao; Phong Vu; Suhan Tang; Pingsheng Zhang; Krishna K. Murthi; Lisa N. Gentile; Jyanwei H. Liu (1994). "Primero Sintesis Total de Taxol. 2. Finalización de los anillos C y D". J. Am. Chem. Soc. 116 (4): 1599–1600. doi:10.1021/ja00083a067.
- ^ Nicolaou, K.C.; Yang, Z.; Liu, J.; Ueno, H.; Nantermet, P. G.; Guy, R. K.; Claiborne, C. F.; Renaud, J.; Couladouros, E. A.; Paulvannan, K.; Sorenson, E. J. (1994). "Total síntesis de taxonomía". Naturaleza. 367 (6464): 630-634. Bibcode:1994Natur.367..630N. doi:10.1038/367630a0. PMID 7906395. S2CID 4371975.
- ^ Paul A. Wender, Neil F. Badham, Simon P. Conway, Paul E. Floreancig, Timothy E. Glass, Christian Gränicher, Jonathan B. Houze, Jan Jänichen, Daesung Lee, Daniel G. Marquess, Paul L. McGrane, Wei Meng, Thomas P. Mucciaro, Michel Mühlebach, Michael G. Natchenefsky 5. Sintesis controlada por Stereo de un Precursor Taxano Versatil" J. Am. Chem. Soc. 119 11), 2755-2756 (Comunicación) doi:10.1021/ja9635387
- ^ Paul A. Wender, Neil F. Badham, Simon P. Conway, Paul E. Floreancig, Timothy E. Glass, Jonathan B. Houze, Nancy E. Krauss, Daesung Lee, Daniel G. Marquess, Paul L. McGrane, Wei Meng, Michael G. Natchus, Anthony J. Shuker, James C. Sutton, and Richard E. Taylor Taxan Pathan (1997) 6. Una síntesis concisa controlada por estereo de Taxol" J. Am. Chem. Soc. 119 11), 2757-2758 (Comunicación) doi:10.1021/ja963539z
- ^ Koichiro Morihira, Ryoma Hara, Shigeru Kawahara, Toshiyuki Nishimori, Nobuhito Nakamura, Hiroyuki Kusama, e Isao Kuwajima (1998) "Sintesis total contrapuesta de Taxol" J. Am. Chem. Soc. 120 (49), 12980-12981 (Comunicación) doi:10.1021/ja9824932
- ^ Hiroyuki Kusama, Ryoma Hara, Shigeru Kawahara, Toshiyuki Nishimori, Hajime Kashima, Nobuhito Nakamura, Koichiro Morihira e Isao Kuwajima (2000) "Sintesis total de (−)-Taxol" J. Am. Chem. Soc. 122 (16) 3811-3820. doi:10.1021/ja9939439
- ^ Isamu Shiina, Hayato Iwadare, Hiroki Sakoh, Masatoshi Hasegawa, Yu-ichirou Tani y Teruaki Mukaiyama (1998) "Un nuevo método para la síntesis de Baccatin III" Cartas de química 27 (1), 1-2 doi:10.1246/cl.1998.1
- ^ Takayuki Doi, Shinichiro Fuse, Shigeru Miyamoto, Kazuoki Nakai, Daisuke Sasuga y Takashi Takahashi (2006) "Una síntesis total formal de Taxol ayudado por un sintetizador automatizado" Química: Revista Asiática 1 (3), 370-383. doi:10.1002/asia.200600156
- ^ Keisuke Fukaya, Yuta Tanaka, Ayako C. Sato, Keisuke Kodama, Hirohisa Yamazaki, Takeru Ishimoto, Yasuyoshi Nozaki, Yuki M. Iwaki, Yohei Yuki, Kentaro Umei, Tomoya Sugai, Yu Yamaguchi, Ami Watanabe, Takeshi Oishi, Takaaki Saynsis, y Noritaka Chidael 1. Síntesis del Anillo ABC de Paclitaxel por SmI2- Ciclización Medida" Cartas orgánicas 17 11), 2570-2573 doi:10.1021/acs.orglett.5b01173
- ^ Keisuke Fukaya, Keisuke Kodama, Yuta Tanaka, Hirohisa Yamazaki, Tomoya Sugai, Yu Yamaguchi, Ami Watanabe, Takeshi Oishi, Takaaki Sato y Noritaka Chida (2015) "Sintesis de Paclitaxel. 2. Construcción del anillo ABCD y síntesis formal" Cartas orgánicas 17 11), 2574-2577 doi:10.1021/acs.orglett.5b01174
- ^ D. F. Taber (5 de octubre de 2015) Sintesis Sato/Chida de Paclitaxel Aspectos destacados de la química orgánica (www.organic-chemistry.org)
- ^ Sho Hirai, Masayuki Utsugi, Mitsuhiro Iwamoto, Masahisa Nakada (2015), "Formal Total Synthesis of (−)-Taxol through Pd-Catalyzed Eight-Membered Carbocyclic Ring Formation" Química: Un Diario Europeo 21 (1), 355-359. doi:10.1002/chem.201404295
- ^ Yuzuru Kanda, Hugh Nakamura, Shigenobu Umemiya, Ravi Kumar Puthukanoori, Venkata Ramana Murthy Appala, Gopi Krishna Gaddamanugu, Bheema Rao Paraselli, y Phil Baran (2020), "Doi:10.1021/jacs.0c03592
- ^ Hu, Ya-Jian; Gu, Chen-Chen; Wang, Xin-Feng; Min, Long; Li, Chuang-Chuang (2021-10-27). "Sintesis Total asimétrica de Taxol". Journal of the American Chemical Society. 143 (42): 17862–17870. doi:10.1021/jacs.1c09637. ISSN 0002-7863. S2CID 238744886.
- ^ Changxia Yuan, Yehua Jin, Nathan C. Wilde, Phil S. Baran (2016) "Short, Enantioselective Total Synthesis of Highly Oxidized Taxanes" Angew. Int. Ed. 55 (29), 8280-8284 doi:10.1002/anie.201602235
- ^ Bruce Ganem y Roland R. Franke (2007) "Paclitaxel de los taxanos primarios: una perspectiva sobre la invención creativa en la química organozirconium" J. Org. Chem. 72 (11), 3981-3987. doi:10.1021/jo070129s
- ^ MyDoanh Chau, Stefan Jennewein, Kevin Walker, y Rodney Croteau (2004) Taxol Biosynthesis: Clonación molecular y caracterización de un citocromo P450 Taxoide 7β-Hydroxylase Química & Biología, 11 (5), 663-672, doi:10.1016/j.chembiol.2004.02.025
- ^ Ajikumar, Parayil Kumaran; Xiao, Wen-Hai; Tyo, Keith E. J.; Wang, Yong; Simeon, Fritz; Leonard, Effendi; Mucha, Oliver; Phon, Too Heng; Pfeifer, Blaine; Stephanopoulos, Gregory (2010). "Isoprenoide Pathway Optimization for Taxol Precursor Overproducción en Escherichia coli". Ciencia. 330 (6000): 70–74. Código:2010Sci...330...70A doi:10.1126/ciencia.1191652. 3034138. PMID 20929806.