Síntesis total de aflatoxinas
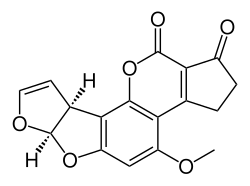
Síntesis total de aflatoxinas se refiere a la síntesis total de un grupo de compuestos orgánicos llamados aflatoxinas. Estos compuestos se encuentran naturalmente en varios hongos. Al igual que con otros objetivos de compuestos químicos en la química orgánica, la síntesis orgánica de aflatoxinas tiene varios propósitos. Tradicionalmente servía para demostrar la estructura de un biocompuesto complejo además de la evidencia obtenida mediante espectroscopia. También demuestra nuevos conceptos en química orgánica (reactivos, tipos de reacciones) y abre el camino a derivados moleculares que no se encuentran en la naturaleza. Y a efectos prácticos, un biocompuesto sintético es una alternativa comercial al aislamiento del compuesto de recursos naturales. Las aflatoxinas en particular añaden otra dimensión porque se sospecha que en el pasado se produjeron en masa a partir de fuentes biológicas como parte de un programa de armas biológicas.
La síntesis de aflatoxina B1 racémica ha sido informada por Buechi et al. en 1967 y el de la aflatoxina B2 racémica de Roberts et al. en 1968 El grupo de Barry Trost de la Universidad de Stanford es responsable de la síntesis enantioselectiva total de (+)-Aflatoxina B1 y B2a en 2003. En 2005 el grupo de E. J. Corey de la Universidad de Harvard presentó la síntesis enantioselectiva de la aflatoxina B2.
Síntesis de aflatoxina B2
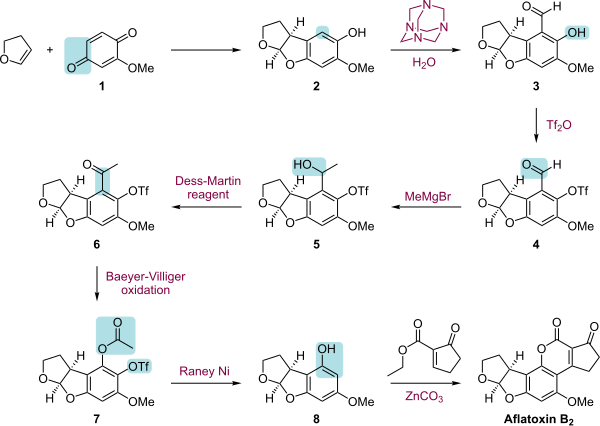
La síntesis total de la Aflatoxina B2 es una secuencia de varios pasos que comienza con una cicloadición [2+3] entre la quinona 1 y el 2,3-Dihidrofurano. Esta reacción está catalizada por un catalizador CBS y es enantioselectiva. El siguiente paso es la ortoformilación del producto de reacción 2 en una reacción de Duff. El grupo hidroxilo en 3 está esterificado con anhídrido tríflico que añade un grupo protector triflato. Este paso permite una reacción de Grignard del grupo aldehído en 4 con bromuro de metilmagnesio al alcohol 5 que luego se oxida con el periodinano de Dess-Martin a la cetona 6<. /b>. Una oxidación de Baeyer-Villiger convierte la cetona en un éster (7) y una reducción con níquel Raney convierte el éster en un alcohol y elimina el grupo ácido tríflico. En el paso final, el esqueleto de cumarina se añade a 9 mediante una reacción de acoplamiento combinada con carbonato de zinc del bromuro de vinilo en 8 y un paso de transesterificación entre el grupo fenol y el grupo etilo. grupo éster.
 |
| Aflatoxin B2 síntesis total |
|---|