Síntesis de cetonas de Weinreb
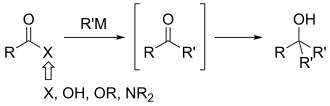
La síntesis de cetonas de Weinreb o la síntesis de cetonas de Weinreb-Nahm es una reacción química utilizada en química orgánica para formar enlaces carbono-carbono. Fue descubierto en 1981 por Steven M. Weinreb y Steven Nahm como método para sintetizar cetonas. La reacción original implicó dos sustituciones de acilo nucleófilas posteriores: la conversión de un cloruro de ácido con N,O-dimetilhidroxilamina, para formar una amida de Weinreb-Nahm, y el tratamiento posterior de esta especie con un reactivo organometálico como un reactivo de Grignard o un reactivo de organolitio. Nahm y Weinreb también informaron sobre la síntesis de aldehídos mediante la reducción de la amida con un exceso de hidruro de litio y aluminio (ver reducción de amida).

La principal ventaja de este método sobre la adición de reactivos organometálicos a compuestos acilo más típicos es que evita el problema común de la adición excesiva. Para estas últimas reacciones, se añaden dos equivalentes del grupo entrante para formar un alcohol en lugar de una cetona o un aldehído. Esto ocurre incluso si los equivalentes de nucleófilo están estrechamente controlados.
Desde entonces, los químicos orgánicos han adoptado la amida de Weinreb-Nahm como un método confiable para la síntesis de cetonas. Estos grupos funcionales están presentes en una gran cantidad de productos naturales y pueden reaccionar de manera confiable para formar nuevos enlaces carbono-carbono o convertirse en otros grupos funcionales. Este método se ha utilizado en varias síntesis, incluidas las macrosfélidas A y B, la anfidinolida J y las espirofunginas A y B.
Mecanismo
Weinreb y Nahm propusieron originalmente el siguiente mecanismo de reacción para explicar la selectividad mostrada en las reacciones de la amida de Weinreb-Nahm. Su sugerencia fue que el intermedio tetraédrico (A a continuación) formado como resultado de la adición nucleofílica del reactivo organometálico se estabiliza mediante quelación del grupo metoxi como se muestra. Este intermedio es estable sólo a bajas temperaturas, por lo que requiere un enfriamiento a baja temperatura.

Esta quelación contrasta con el mecanismo de formación del producto de sobreadición en el que el colapso del intermedio tetraédrico permite una segunda adición. La conjetura mecanicista de Weinreb fue inmediatamente aceptada por la comunidad académica, pero no fue hasta 2006 que fue confirmada mediante análisis espectroscópicos y cinéticos.
Preparación
Además del procedimiento original mostrado anteriormente (que puede tener problemas de compatibilidad con sustratos sensibles), las amidas de Weinreb se pueden sintetizar a partir de una variedad de compuestos acilo. La gran mayoría de estos procedimientos utilizan la sal clorhidrato de N,O-dimetilhidroxilamina [MeO(Me)NH·HCl] disponible comercialmente, que normalmente es más fácil de manipular que la amina libre.
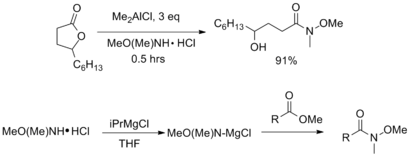
El tratamiento de un éster o lactona con AlMe3 o AlMe2Cl proporciona la correspondiente amida de Weinreb con buenos rendimientos. Alternativamente, se pueden usar reactivos de Grignard no nucleófilos tales como cloruro de isopropil magnesio para activar la amina antes de la adición del éster.
También se pueden utilizar diversos reactivos de acoplamiento de péptidos para preparar amidas de Weinreb-Nahm a partir de ácidos carboxílicos. Se han informado específicamente para este propósito varios acoplamientos basados en carbodiimida, hidroxibenzotriazol y trifenilfosfina.

Finalmente, una reacción de aminocarbonilación informada por Stephen Buchwald permite la conversión de haluros de arilo directamente en aril Weinreb-Nahm amidas.

Alcance
Se sabe que las condiciones estándar para la síntesis de cetonas de Weinreb-Nahm toleran una amplia variedad de grupos funcionales en otras partes de la molécula, incluida la sustitución alfa-halógeno, aminoácidos N-protegidos, insaturación α-β, éteres sililo y varias lactamas. y lactonas, sulfonatos, sulfinatos y ésteres de fosfonato. Se puede utilizar una amplia variedad de nucleófilos junto con la amida. Los más comúnmente empleados son los reactivos de Lithiatos y Grignard; Se han informado ejemplos que involucran nucleófilos de carbonos alifáticos, vinílicos, arilo y alquinilo. Sin embargo, con nucleófilos altamente básicos o estéricamente impedidos, la eliminación del resto metóxido para liberar formaldehído puede ocurrir como una reacción secundaria significativa.

No obstante, la amida de Weinreb-Nahm ocupa un lugar destacado en muchas síntesis y sirve como un importante compañero de acoplamiento para varios fragmentos. A continuación se muestran los pasos clave que involucran a las amidas de Weinreb en la síntesis de varios productos naturales, incluidos miembros de la familia inmunosupresora de macrosfelides y la familia de antibióticos de espirofunginas.

Variaciones
La reacción de las amidas de Weinreb-Nahm con reactivos de Wittig se ha realizado para evitar las condiciones, a veces duras, necesarias para la adición de reactivos de hidruro o compuestos organometálicos. Esto produce una N-metil-N-metoxienamina que se convierte en la cetona o aldehído correspondiente tras el tratamiento hidrolítico.

Además, se ha desarrollado un intercambio de magnesio-halógeno en un solo recipiente con arilación posterior, lo que demuestra la estabilidad de la amida de Weinreb-Nahm y proporciona un método operativamente simple para la síntesis de arilcetonas.
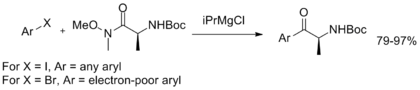
Se han sintetizado reactivos más inusuales con múltiples grupos funcionales amida de Weinreb-Nahm, que sirven como sintones de CO2 y α-dicetona.
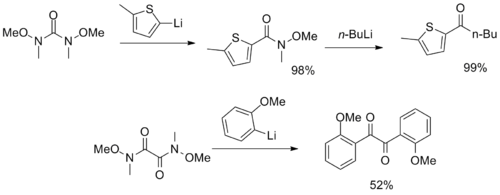
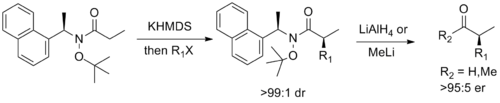
Finalmente, Stephen G. Davies de Oxford ha diseñado un auxiliar quiral que combina la funcionalidad de la amida de Weinreb con la de la amida de Myers. auxiliar de pseudoefedrina, que permite la alquilación diastereoselectiva del enolato seguida de una fácil escisión al correspondiente aldehído o cetona enantioenriquecido.