Síndrome de insensibilidad a los andrógenos
síndrome de insensibilidad a los andrógenos (AIS) es una diferencia en el desarrollo sexual que implica resistencia hormonal debido a la disfunción del receptor de andrógenos.
Afecta a 1 de cada 20 000 a 64 000 nacimientos XY (cariotípicamente masculino). La condición da como resultado la incapacidad parcial o completa de las células para responder a los andrógenos. Esta falta de respuesta puede perjudicar o impedir el desarrollo de los genitales masculinos, así como perjudicar o impedir el desarrollo de las características sexuales secundarias masculinas en la pubertad. No afecta significativamente el desarrollo sexual o genital femenino. Por lo tanto, la insensibilidad a los andrógenos es clínicamente significativa solo cuando ocurre en varones genéticos (es decir, individuos con un cromosoma Y, o más específicamente, un gen SRY). Los fenotipos clínicos en estos individuos van desde un hábito masculino típico con un defecto espermatogénico leve o cabello terminal secundario reducido, hasta un hábito femenino completo, a pesar de la presencia de un cromosoma Y.
El AIS se divide en tres categorías que se diferencian por el grado de masculinización genital: el síndrome de insensibilidad androgénica completa (CAIS) está indicado cuando los genitales externos son los de una mujer típica; el síndrome de insensibilidad a los andrógenos leve (MAIS) está indicado cuando los genitales externos son los de un varón típico, y el síndrome de insensibilidad a los andrógenos parcial (PAIS) está indicado cuando los genitales externos están parcialmente, pero no completamente, masculinizados. El síndrome de insensibilidad a los andrógenos es la entidad individual más grande que conduce a genitales submasculinizados 46,XY.
Actualmente, el manejo de AIS se limita al manejo sintomático; actualmente no hay ningún método disponible para corregir el mal funcionamiento de las proteínas receptoras de andrógenos producidas por mutaciones del gen AR. Las áreas de manejo incluyen asignación de sexo, genitoplastia, gonadectomía para reducir el riesgo de tumores, terapia de reemplazo hormonal, asesoramiento genético y asesoramiento psicológico.
Genética

El receptor de andrógenos (AR) humano es una proteína codificada por un gen ubicado en el brazo largo proximal del cromosoma X (locus Xq11-Xq12). La región codificante de la proteína consta de aproximadamente 2757 nucleótidos (919 codones) que abarcan ocho exones, denominados 1-8 o A-H. Los intrones varían en tamaño entre 0,7 y 26 kb. Al igual que otros receptores nucleares, la proteína AR consta de varios dominios funcionales: el dominio de transactivación (también llamado dominio de regulación de la transcripción o dominio amino/NH2-terminal), el dominio de unión al ADN, la región bisagra y el dominio de unión a esteroides. (también llamado dominio de unión al ligando carboxilo-terminal). El dominio de transactivación está codificado por el exón 1 y constituye más de la mitad de la proteína AR. Los exones 2 y 3 codifican el dominio de unión al ADN, mientras que el 5' parte del exón 4 codifica la región bisagra. El resto de los exones 4 a 8 codifica el dominio de unión al ligando.
Longitudes de satélites de trinucleótidos y actividad transcripcional AR
El gen AR contiene dos microsatélites de trinucleótidos polimórficos en el exón 1. El primer microsatélite (más cercano al extremo 5') contiene de 8 a 60 repeticiones del codón de glutamina 'CAG'; y por lo tanto se conoce como el tracto de poliglutamina. El segundo microsatélite contiene de 4 a 31 repeticiones del codón de glicina "GGC" y se conoce como tracto de poliglicina. El número promedio de repeticiones varía según el origen étnico, los caucásicos muestran un promedio de 21 repeticiones CAG y los negros 18. En los hombres, los estados de enfermedad se asocian con extremos en la longitud del tracto de poliglutamina; el cáncer de próstata, el carcinoma hepatocelular y la discapacidad intelectual se asocian con muy pocas repeticiones, mientras que la atrofia muscular espinal y bulbar (SBMA) se asocia con una duración de repetición CAG de 40 o más. Algunos estudios indican que la longitud del tracto de poliglutamina está inversamente correlacionado con la actividad transcripcional en la proteína AR, y que los tractos de poliglutamina más largos pueden estar asociados con la infertilidad masculina y los genitales poco masculinos en los hombres. Sin embargo, otros estudios han indicado que no existe tal correlación. Un metanálisis completo del tema publicado en 2007 respalda la existencia de la correlación y concluyó que estas discrepancias podrían resolverse cuando se tienen en cuenta el tamaño de la muestra y el diseño del estudio. Algunos estudios sugieren que las longitudes más largas de los tractos de poliglicina también están asociadas con defectos de masculinización genital en los hombres. Otros estudios no encuentran tal asociación.
Mutaciones de RA
Hasta 2010, se han informado más de 400 mutaciones de AR en la base de datos de mutaciones de AR, y el número continúa creciendo. La herencia suele ser materna y sigue un patrón recesivo ligado al cromosoma X; los individuos con un cariotipo 46,XY siempre expresan el gen mutante ya que solo tienen un cromosoma X, mientras que los portadores de 46,XX se ven mínimamente afectados. Alrededor del 30 % de las veces, la mutación AR es un resultado espontáneo y no se hereda. Tales mutaciones de novo son el resultado de una mutación de células germinales o un mosaicismo de células germinales en las gónadas de uno de los padres, o una mutación en el propio óvulo fertilizado. En un estudio, tres de ocho mutaciones de novo ocurrieron en la etapa poscigótica, lo que llevó a estimar que hasta un tercio de las mutaciones de novo resultan en mosaicismo somático. No todas las mutaciones del gen AR resultan en insensibilidad a los andrógenos; una mutación particular ocurre en 8 a 14% de los varones genéticos y se cree que afecta negativamente solo a un pequeño número de individuos cuando están presentes otros factores genéticos.
Otras causas
Algunas personas con CAIS o PAIS no tienen ninguna mutación AR a pesar de las características clínicas, hormonales e histológicas suficientes para justificar un diagnóstico de AIS; hasta el 5% de las mujeres con CAIS no tienen mutación AR, así como entre el 27 y el 72% de las personas con PAIS.
En un paciente, la causa subyacente del presunto PAIS fue una proteína mutante del factor esteroidogénico 1 (SF-1). En otro paciente, el CAIS fue el resultado de un déficit en la transmisión de una señal de transactivación desde la región N-terminal del receptor de andrógenos a la maquinaria de transcripción basal de la célula. Una proteína coactivadora que interactúa con el dominio de transactivación de la función de activación 1 (AF-1) del receptor de andrógenos puede haber sido deficiente en este paciente. La interrupción de la señal no pudo corregirse mediante la suplementación con ningún coactivador conocido en ese momento, ni se caracterizó la proteína coactivadora ausente, lo que dejó a algunos en el campo sin estar convencidos de que un coactivador mutante explicaría el mecanismo de resistencia a los andrógenos en pacientes con CAIS o PAIS con una gen AR típico.
Cariotipo XY
Dependiendo de la mutación, una persona con un cariotipo 46,XY y AIS puede tener un fenotipo masculino (MAIS) o femenino (CAIS), o puede tener genitales parcialmente masculinizados (PAIS). Las gónadas son testículos independientemente del fenotipo debido a la influencia del cromosoma Y. Una hembra 46,XY, por lo tanto, no tiene ovarios y no puede aportar un óvulo para la concepción. En algunos casos, las mujeres 46, XY forman un útero vestigial y han podido gestar niños. Tales ejemplos son raros y han requerido el uso de una donante de óvulos, terapia hormonal y FIV.
Se han publicado varios estudios de casos de hombres fértiles 46,XY con AIS, aunque se cree que este grupo es una minoría. En algunos casos, los hombres infértiles con MAIS han podido concebir hijos después de aumentar su conteo de espermatozoides mediante el uso de testosterona suplementaria.
Un varón genético concebido por un hombre con AIS no recibiría el cromosoma X de su padre, por lo que no heredaría ni portaría el gen del síndrome. Una hembra genética concebida de esa manera recibiría el cromosoma X de su padre, por lo que se convertiría en portadora.
XX cariotipo
Las hembras genéticas (cariotipo 46,XX) tienen dos cromosomas X, por lo que tienen dos genes AR. Una mutación en uno (pero no en ambos) da como resultado una mujer portadora fértil y mínimamente afectada. Se ha observado que algunos portadores tienen vello corporal ligeramente reducido, pubertad retrasada y/o estatura alta, presumiblemente debido a la inactivación sesgada de X. Una mujer portadora transmitirá el gen AR afectado a sus hijos el 50 % de las veces. Si el niño afectado es una mujer genética, ella también será portadora. Un niño 46,XY afectado tendrá AIS.
Una genética femenina con mutaciones en ambos genes AR teóricamente podría resultar de la unión de un hombre fértil con AIS y una mujer portadora del gen, o de de novo mutación. Sin embargo, dada la escasez de hombres fértiles con AIS y la baja incidencia de la mutación AR, las posibilidades de que esto ocurra son pequeñas. El fenotipo de tal individuo es materia de especulación; a partir de 2010, no se ha publicado ningún caso documentado.
Correlación de genotipo y fenotipo
Las personas con AIS parcial, a diferencia de las formas completas o leves, presentan genitales ambiguos al nacer, y la decisión de criar al niño como hombre o mujer a menudo no es obvia. Desafortunadamente, se puede obtener poca información sobre el fenotipo a partir del conocimiento preciso de la mutación AR en sí misma; la misma mutación AR puede causar una variación significativa en el grado de masculinización en diferentes individuos, incluso entre miembros de la misma familia. Exactamente qué causa esta variación no se comprende del todo, aunque los factores que contribuyen a ella podrían incluir la longitud de los tractos de poliglutamina y poliglicina, la sensibilidad y las variaciones en el medio endocrino intrauterino, el efecto de las proteínas correguladoras activas en las células de Sertoli, el mosaicismo somático, la expresión del gen 5RD2 en los fibroblastos de la piel genital, reducción de la transcripción y traducción de AR de factores distintos a las mutaciones en la región codificante de AR, una proteína coactivadora no identificada, deficiencias enzimáticas como la deficiencia de 21-hidroxilasa u otras variaciones genéticas como una proteína del factor 1 esteroidogénico mutante. Sin embargo, el grado de variación no parece ser constante en todas las mutaciones de AR y es mucho más extremo en algunas. Se sabe que las mutaciones sin sentido que dan como resultado una sustitución de un solo aminoácido producen la mayor diversidad fenotípica.
Fisiopatología

Andrógenos y el receptor de andrógenos
Los efectos que los andrógenos tienen en el cuerpo humano (virilización, masculinización, anabolismo, etc.) no son provocados por los andrógenos en sí mismos, sino que son el resultado de andrógenos unidos a los receptores de andrógenos; el receptor de andrógenos media los efectos de los andrógenos en el cuerpo humano. Asimismo, el propio receptor de andrógenos generalmente está inactivo en la célula hasta que se produce la unión de andrógenos.
La siguiente serie de pasos ilustra cómo los andrógenos y el receptor de andrógenos trabajan juntos para producir efectos androgénicos:
- Andrógeno entra en la celda.
- Sólo ciertos órganos del cuerpo, como los gónadas y las glándulas suprarrenales, producen la testosterona andrógeno.
- La testosterona se convierte en dihidrotestosterona, un andrógeno químicamente similar, en células que contienen la enzima 5-alfa reductasa.
- Ambos andrógenos ejercen su influencia mediante la unión con el receptor de andrógeno.
- El andrógeno se une con el receptor de andrógeno.
- El receptor de andrógeno se expresa ubicuamente a través de los tejidos del cuerpo humano.
- Antes de unirse con un andrógeno, el receptor de andrógeno está obligado a calentar proteínas de choque.
- Estas proteínas de choque térmico se liberan sobre la unión de andrógeno.
- La unión con el andrógeno induce un cambio estabilizador y conformacional en el receptor del andrógeno.
- Los dos dedos de zinc del dominio de unión de ADN están expuestos como resultado de esta nueva conformación.
- Se cree que la estabilidad de AR es ayudada por los Coregulators tipo II, que modulan el plegamiento de proteínas y la unión de andrógenos, o facilitan la interacción NH2/carboxyl-terminal.
- El receptor de andrógeno activado por hormonas es fosforilado.
- La fosforilación del receptor puede ocurrir antes de la unión del andrógeno, aunque la presencia del andrógeno promueve la hiperfosforilación.
- Se desconocen las ramificaciones biológicas de la fosforilación receptora.
- El receptor de andrógeno activado por hormonas se transloca al núcleo.
- El transporte nucleocitoplasmático es en parte facilitado por una secuencia de aminoácidos en el AR llamada señal de localización nuclear.
- La señal de localización nuclear de AR está principalmente codificada en la región de bisagra del gen AR.
- La homodimerización ocurre.
- La dimerización está mediada por el segundo dedo de zinc (contiene el extremo 3').
- El ADN se une a los elementos reguladores de respuesta andrógeno.
- Los genes de destino contienen (o están flanqueados por) secuencias de nucleótido de potenciador transcripcional que interactúan con el primer dedo de zinc.
- Estas áreas se denominan elementos de respuesta andrógeno.
- Los coactivadores son reclutados por el AR.
- Los coactivadores tipo I (es decir, los Coregulators) se consideran influenciar la actividad transcripcional AR facilitando la ocupación del ADN, remodelación de cromatina, o el reclutamiento de factores de transcripción generales asociados con el holocomplex de la polimerasa RNA II.
- La transcripción de los genes apuntan.
De esta manera, los andrógenos unidos a los receptores de andrógenos regulan la expresión de los genes diana, produciendo así efectos androgénicos.
Teóricamente, ciertos receptores de andrógenos mutantes pueden funcionar sin andrógenos; Los estudios in vitro han demostrado que una proteína receptora de andrógenos mutante puede inducir la transcripción en ausencia de andrógenos si se elimina su dominio de unión a esteroides. Por el contrario, el dominio de unión a esteroides puede actuar para reprimir el dominio de transactivación de AR, quizás debido a la conformación sin ligando de AR.
Andrógenos en el desarrollo fetal
Los embriones humanos se desarrollan de manera similar durante las primeras seis semanas, independientemente del sexo genético (cariotipo 46,XX o 46,XY); la única forma de saber la diferencia entre embriones 46,XX o 46,XY durante este período de tiempo es buscar cuerpos de Barr o un cromosoma Y. Las gónadas comienzan como protuberancias de tejido llamadas crestas genitales en la parte posterior de la cavidad abdominal, cerca de la línea media. Hacia la quinta semana, las crestas genitales se diferencian en una corteza externa y una médula interna, y se denominan gónadas indiferentes. Hacia la sexta semana, las gónadas indiferentes comienzan a diferenciarse según el sexo genético. Si el cariotipo es 46,XY, los testículos se desarrollan debido a la influencia del gen SRY del cromosoma Y. Este proceso no requiere la presencia de andrógenos, ni un receptor de andrógenos funcional.
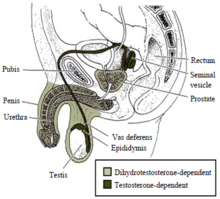
Hasta alrededor de la séptima semana de desarrollo, el embrión tiene conductos accesorios sexuales indiferentes, que constan de dos pares de conductos: los conductos de Müller y los conductos de Wolff. Las células de Sertoli dentro de los testículos secretan la hormona antimülleriana en este momento para suprimir el desarrollo de los conductos müllerianos y provocar su degeneración. Sin esta hormona antimülleriana, los conductos müllerianos se convierten en los genitales internos femeninos (útero, cuello uterino, trompas de Falopio y barril vaginal superior). A diferencia de los conductos de Müller, los conductos de Wolff no seguirán desarrollándose por defecto. En presencia de testosterona y receptores de andrógenos funcionales, los conductos de Wolff se convierten en epidídimos, conductos deferentes y vesículas seminales. Si los testículos no secretan testosterona o los receptores de andrógenos no funcionan correctamente, los conductos de Wolff se degeneran.
La masculinización de los genitales externos masculinos (el pene, la uretra del pene y el escroto), así como la próstata, dependen del andrógeno dihidrotestosterona. La testosterona se convierte en dihidrotestosterona por la enzima 5-alfa reductasa. Si esta enzima está ausente o es deficiente, entonces no se crea dihidrotestosterona y los genitales masculinos externos no se desarrollan adecuadamente. Como es el caso de los genitales masculinos internos, se necesita un receptor de andrógenos funcional para que la dihidrotestosterona regule la transcripción de los genes diana implicados en el desarrollo.
Patogenia del SIA
Las mutaciones en el gen del receptor de andrógenos pueden causar problemas con cualquiera de los pasos involucrados en la androgenización, desde la síntesis de la proteína del receptor de andrógenos hasta la capacidad transcripcional del complejo andrógeno-AR dimerizado. AIS puede resultar si incluso uno de estos pasos se interrumpe significativamente, ya que cada paso es necesario para que los andrógenos activen el AR con éxito y regulen la expresión génica. Se puede predecir exactamente qué pasos afectará una mutación en particular, hasta cierto punto, identificando el área del AR en la que reside la mutación. Esta capacidad de predicción es principalmente de origen retrospectivo; los diferentes dominios funcionales del gen AR se han dilucidado analizando los efectos de mutaciones específicas en diferentes regiones del AR. Por ejemplo, se sabe que las mutaciones en el dominio de unión de esteroides afectan la afinidad o retención de unión de andrógenos, se sabe que las mutaciones en la región bisagra afectan la translocación nuclear, se sabe que las mutaciones en el dominio de unión de ADN afectan la dimerización y la unión al objetivo Se sabe que el ADN y las mutaciones en el dominio de transactivación afectan la regulación de la transcripción del gen objetivo. Desafortunadamente, incluso cuando se conoce el dominio funcional afectado, es difícil predecir las consecuencias fenotípicas de una mutación particular (ver Correlación de genotipo y fenotipo).
Algunas mutaciones pueden afectar negativamente a más de un dominio funcional. Por ejemplo, una mutación en un dominio funcional puede tener efectos nocivos en otro al alterar la forma en que interactúan los dominios. Una única mutación puede afectar a todos los dominios funcionales aguas abajo si se produce un codón de parada prematuro o un error de estructura; tal mutación puede resultar en una proteína receptora de andrógenos completamente inutilizable (o no sintetizable). El dominio de unión de esteroides es particularmente vulnerable a los efectos de un codón de terminación prematuro o un error de estructura, ya que ocurre al final del gen y, por lo tanto, es más probable que su información se trunque o malinterprete que otros dominios funcionales.
Se han observado otras relaciones más complejas como consecuencia de AR mutado; algunas mutaciones asociadas con los fenotipos masculinos se han relacionado con el cáncer de mama masculino, el cáncer de próstata o, en el caso de la atrofia muscular espinal y bulbar, la enfermedad del sistema nervioso central. La forma de cáncer de mama que se observa en algunos hombres con PAIS es causada por una mutación en el dominio de unión al ADN del AR. Se cree que esta mutación causa una alteración de la interacción del gen objetivo del AR que le permite actuar en ciertos objetivos adicionales, posiblemente junto con la proteína receptora de estrógeno, para causar el crecimiento canceroso. La patogenia de la atrofia muscular espinal y bulbar (SBMA) demuestra que incluso la proteína AR mutante en sí misma puede provocar patología. La expansión repetida de trinucleótidos del tramo de poliglutamina del gen AR que está asociado con SBMA da como resultado la síntesis de una proteína AR mal plegada que la célula no logra proteolizar y dispersar adecuadamente. Estas proteínas AR mal plegadas forman agregados en el citoplasma y el núcleo celular. En el transcurso de 30 a 50 años, estos agregados se acumulan y tienen un efecto citotóxico, lo que finalmente da como resultado los síntomas neurodegenerativos asociados con SBMA.
Diagnóstico
Los fenotipos que resultan de la insensibilidad a los andrógenos no son exclusivos de AIS, por lo que el diagnóstico de AIS requiere la exclusión completa de otras causas. Los hallazgos clínicos indicativos de AIS incluyen la presencia de una vagina corta o genitales poco masculinizados, regresión parcial o completa de las estructuras müllerianas, testículos bilaterales no displásicos y alteración de la espermatogénesis y/o virilización. Los hallazgos de laboratorio incluyen un cariotipo 46,XY y niveles típicos o elevados de testosterona pospuberal, hormona luteinizante y estradiol. La actividad de unión de andrógenos de los fibroblastos de la piel genital suele estar disminuida, aunque se han informado excepciones. La conversión de testosterona a dihidrotestosterona puede verse afectada. El diagnóstico de AIS se confirma si la secuenciación del gen del receptor de andrógenos revela una mutación, aunque no todas las personas con AIS (particularmente PAIS) tendrán una mutación AR (consulte Otras causas).
Cada uno de los tres tipos de AIS (completo, parcial y leve) tiene una lista diferente de diagnósticos diferenciales a considerar. Dependiendo de la forma de AIS sospechada, la lista de diferenciales puede incluir:
- anomalías cromosómicas:
- Síndrome de Klinefelter (47, XXY karyotype)
- Síndrome de Turner (45, XO karyotype)
- Disgénesis mixta de gonadal (45,XO/46, XY karyotype)
- Chimerismo tetragametico (46,XX/46, XY karyotype)
- Disfunción biosintética andrógeno en 46,XY individuos:
- mutaciones de receptores de hormona luteinizante (LH)
- Síndrome Smith-Lemli-Opitz (asociado con discapacidad intelectual)
- Hiperplasia suprarrenal congénita lipoidea
- 3β-hidroxisteroide dehidrogenasa 2 deficiencia
- 17α-hidroxilasa deficiencia
- 17,20 deficiencia de lisa
- 17β-hidroxisteroide deficiencia dehidrogenasa
- 5α-reductasa deficiencia
- El exceso de andrógeno en 46,XX individuos:
- Deficiencia de 21 hidroxilasa
- 3β-hidroxisteroide dehidrogenasa 2 deficiencia
- Citocromo P450 deficiencia de óxidoreductasa (desorden en la madre causa 46,XX fetal virilización)
- Deficiencia de 11β-hidroxilase
- Deficiencia de aromatasa
- mutaciones del receptor de glucocorticoides
- Tumor virilizante materno (por ejemplo, luteoma)
- Aumento de la exposición al andrógeno en utero, no especificada de otra manera (por ejemplo, medicamentos androgénicos)
- Developmental
- Síndrome Mayer-Rokitansky-Küster-Hauser (46, XX karyotype)
- Síndrome de Swyer (46, XY karyotype)
- XX disgénesis gonadal (46, XX karyotype)
- Edad de células Leydig o hipoplasia, no especificada de otra manera (46, karyotipo XY)
- Síndrome de abstinencia (vanishing)
- DSD ovotesticular
- DSD testicular (es decir, 46,XX reversión sexual)
- Causas teratógenas (por ejemplo estrógenos, antiestrógenos)
- Otras causas:
- Síndrome de Frasier (asociado con glomerulopatía progresiva)
- Deniega el síndrome de Drash (asociado con nefropatía y tumor de Wilms)
- Síndrome de WAGR (asociado con tumor de Wilms y aniridia)
- Síndrome McKusick-Kaufman (asociado con polidactilidad postaxial)
- Síndrome de Robinow (asociado con el enanismo)
- Síndrome de Aarskog–Scott (asociado con anomalías faciales)
- Síndrome de mano-pie-genital (asociado con malformaciones de miembros)
- Síndrome de pterigio popliteal (asociado con un extenso agarre detrás de las rodillas)
- Síndrome de Kallmann (a menudo asociado con anosmia)
- Hipospadias no especificadas de otra manera
- Cryptorchidism not otherwise specified
- atresia vaginal no especificada de otra manera
Clasificación
El AIS se divide en tres clases según el fenotipo: síndrome de insensibilidad a los andrógenos completo (CAIS), síndrome de insensibilidad a los andrógenos parcial (PAIS) y síndrome de insensibilidad a los andrógenos leve (MAIS). El endocrinólogo pediátrico Charmian A. Quigley et al. propusieron un sistema complementario de clasificación fenotípica que utiliza siete clases en lugar de las tres tradicionales. en 1995. Los primeros seis grados de la escala, del 1 al 6, se diferencian por el grado de masculinización genital; el grado 1 se indica cuando los genitales externos están completamente masculinizados, el grado 6 se indica cuando los genitales externos están completamente feminizados y los grados 2 a 5 cuantifican cuatro grados de genitales cada vez más masculinizados que se encuentran en el ínterin. El grado 7 es indistinguible del grado 6 hasta la pubertad y, a partir de entonces, se diferencia por la presencia de vello terminal secundario; el grado 6 está indicado cuando está presente el cabello terminal secundario, mientras que el grado 7 está indicado cuando está ausente. La escala de Quigley se puede utilizar junto con las tres clases tradicionales de AIS para proporcionar información adicional sobre el grado de masculinización genital y es particularmente útil cuando el diagnóstico es PAIS.
SIA completo
AIS parcial
SIA leve
Administración
Actualmente, el manejo de AIS se limita al manejo sintomático; actualmente no hay ningún método disponible para corregir el mal funcionamiento de las proteínas receptoras de andrógenos producidas por mutaciones del gen AR. Las áreas de manejo incluyen asignación de sexo, genitoplastia, gonadectomía en relación con el riesgo de tumores, terapia de reemplazo hormonal, asesoramiento genético y asesoramiento psicológico.
CAIS
PAÍS
MAÍZ
Epidemiología
AIS representa alrededor del 15 % al 20 % de los DSD y afecta a 1 de cada 20 000 a 1 de cada 64 000 hombres.
Las estimaciones de la incidencia del síndrome de insensibilidad a los andrógenos se basan en un tamaño de población relativamente pequeño, por lo que se sabe que son imprecisas. Se estima que CAIS ocurre en uno de cada 20,400 nacimientos 46,XY. Una encuesta nacional en los Países Bajos basada en pacientes con confirmación genética del diagnóstico estima que la incidencia mínima de CAIS es de uno en 99.000. La incidencia de PAIS se estima en uno en 130.000. Debido a su presentación sutil, MAIS no suele investigarse excepto en el caso de la infertilidad masculina, por lo que se desconoce su verdadera prevalencia.
Controversia
Diagnóstico genético preimplantacional
El diagnóstico genético preimplantacional (PGD o PIGD) se refiere al perfil genético de los embriones antes de la implantación (como una forma de perfil del embrión) y, a veces, incluso de los ovocitos antes de la fertilización. Cuando se utiliza para detectar una secuencia genética específica, su principal ventaja es que evita la interrupción selectiva del embarazo, ya que el método hace que sea muy probable que un embrión seleccionado esté libre de la afección en cuestión.
En el Reino Unido, AIS aparece en una lista de enfermedades genéticas graves que pueden detectarse a través de PGD. Algunos especialistas en ética, médicos y defensores de la intersexualidad han argumentado que la detección de embriones para excluir específicamente los rasgos intersexuales se basa en normas sociales y culturales en oposición a la necesidad médica.
Historia
Las descripciones registradas de los efectos de AIS se remontan a cientos de años, aunque no se logró una comprensión significativa de su histopatología subyacente hasta la década de 1950. La taxonomía y la nomenclatura asociadas con la insensibilidad a los andrógenos pasaron por una evolución significativa paralela a esta comprensión.
Cronología de los principales hitos
- 1950: Lawson Wilkins administra metiltestosterona diaria a una paciente embarazada karyotype46, XY femenina, que no muestra signos de virilización. Su experimento es la primera demostración documentada de la fisiopatología de la AIS.
- 1970: Mary F. Lyon y Susan Hawkes informaron que un gen en el cromosoma X causó insensibilidad completa a los andrógenos en ratones.
- 1981: Barbara Migeon et al. Se redujo el locus del gen del receptor de andrógeno humano (o un factor que controla el gen del receptor de andrógeno) a algún lugar entre Xq11 y Xq13.
- 1988: El gen del receptor de andrógeno humano es primero clonado y analizado parcialmente por múltiples partes. Terry Brown et al. reportó las primeras mutaciones probadas para causar AIS.
- 1989: Terry Brown et al. reportó el locus exacto del gen AR (Xq11-Xq12), y Dennis Lubahn et al. publicó sus límites intron-exon.
- 1994: Se creó la base de datos de mutaciones de genes de los receptores andrógenos para proporcionar una lista completa de mutaciones publicadas en revistas médicas y procedimientos de conferencias.
Terminología temprana
Las primeras descripciones de los efectos de AIS aparecieron en la literatura médica como informes de casos individuales o como parte de una descripción integral de las fisicalidades intersexuales. En 1839, el obstetra escocés Sir James Young Simpson publicó una descripción de este tipo en un estudio exhaustivo de la intersexualidad al que se le atribuye el avance de la comprensión de la comunidad médica sobre el tema. El sistema de taxonomía de Simpson, sin embargo, estaba lejos de ser el primero; Las taxonomías o descripciones para la clasificación de la intersexualidad fueron desarrolladas por el médico y físico italiano Fortuné Affaitati en 1549, el cirujano francés Ambroise Paré en 1573, el médico francés y pionero de la sexología Nicolas Venette en 1687 (bajo el seudónimo de Vénitien Salocini) y el zoólogo francés Isidore Geoffroy Saint -Hilaire en 1832. Estos cinco autores utilizaron el término coloquial "hermafrodita" como base de sus taxonomías, aunque el propio Simpson cuestionó la propiedad de la palabra en su publicación. Uso de la palabra "hermafrodita" en la literatura médica ha persistido hasta el día de hoy, aunque su propiedad todavía está en duda. Recientemente se ha sugerido un sistema alternativo de nomenclatura, pero el tema de qué palabra o palabras exactamente deben usarse en su lugar sigue siendo objeto de mucho debate.
Pseudohermafroditismo
"Pseudohermafroditismo" ha sido, hasta hace muy poco, el término utilizado en la literatura médica para describir la condición de un individuo cuyas gónadas y cariotipo no coinciden con los genitales externos en el sentido binario de género. Por ejemplo, las personas 46,XY que tienen un fenotipo femenino, pero también tienen testículos en lugar de ovarios (un grupo que incluye a todas las personas con CAIS, así como a algunas personas con PAIS) se clasifican como "pseudohermafroditismo masculino", mientras que las personas con un ovario y un testículo (o al menos un ovotestículo) se clasifican como "hermafroditismo verdadero". El uso de la palabra en la literatura médica es anterior al descubrimiento del cromosoma, por lo que su definición no siempre ha tenido en cuenta el cariotipo al determinar el sexo de un individuo. Las definiciones anteriores de "pseudohermafroditismo" se basó en inconsistencias percibidas entre los órganos internos y externos; el "verdadero" el sexo de un individuo estaba determinado por los órganos internos, y los órganos externos determinaban el "percibido" sexo de un individuo.
El patólogo germano-suizo Edwin Klebs se destaca a veces por usar la palabra "pseudohermafroditismo" en su taxonomía de la intersexualidad en 1876, aunque la palabra claramente no es su invención como se informa a veces; la historia de la palabra "pseudohermafrodita" y el correspondiente deseo de separar "verdadero" hermafroditas de "falso", "espurio" o "pseudo" hermafroditas, se remonta al menos a 1709, cuando el anatomista holandés Frederik Ruysch lo utilizó en una publicación que describía a un sujeto con testículos y un fenotipo mayoritariamente femenino. "Pseudohermafrodita" también apareció en el Acta Eruditorum más tarde ese mismo año, en una revisión del trabajo de Ruysch. Además, alguna evidencia indica que la palabra ya estaba siendo utilizada por la comunidad médica alemana y francesa mucho antes de que Klebs la usara; El fisiólogo alemán Johannes Peter Müller equiparó el "pseudohermafroditismo" con una subclase de hermafroditismo de la taxonomía de Saint-Hilaire en una publicación de 1834, y en la década de 1840 "pseudohermafroditismo" aparecía en varias publicaciones francesas y alemanas, incluidos diccionarios.
Feminizacion testicular
En 1953, el ginecólogo estadounidense John Morris proporcionó la primera descripción completa de lo que llamó "síndrome de feminización testicular" basado en 82 casos recopilados de la literatura médica, incluidos dos de sus propios pacientes. El término "feminización testicular" fue acuñado para reflejar Morris' observación de que los testículos de estos pacientes producían una hormona que tenía un efecto feminizante en el cuerpo, un fenómeno que ahora se entiende que se debe a la inacción de los andrógenos y la subsiguiente aromatización de la testosterona en estrógeno. Unos años antes de que Morris publicara su artículo histórico, Lawson Wilkins había demostrado a través de experimentos que la falta de respuesta de la célula diana a la acción de las hormonas androgénicas era una causa del "pseudohermafroditismo masculino". Wilkins' El trabajo, que demostró claramente la falta de un efecto terapéutico cuando los pacientes 46,XY fueron tratados con andrógenos, provocó un cambio gradual en la nomenclatura de "feminización testicular" a la "resistencia a los andrógenos".
Otros nombres
Se ha dado un nombre distinto a muchas de las diversas presentaciones de AIS, como síndrome de Reifenstein (1947), síndrome de Goldberg-Maxwell (1948), síndrome de Morris' síndrome de Gilbert-Dreyfus (1953), síndrome de Gilbert-Dreyfus (1957), síndrome de Lub (1959), "feminización testicular incompleta" (1963), síndrome de Rosewater (1965) y síndrome de Aiman (1979). Dado que no se entendió que todas estas presentaciones diferentes eran causadas por el mismo conjunto de mutaciones en el gen del receptor de andrógenos, se le dio un nombre único a cada nueva combinación de síntomas, lo que resultó en una estratificación complicada de trastornos aparentemente dispares.
Durante los últimos 60 años, a medida que se informaron informes de fenotipos sorprendentemente diferentes incluso entre miembros de la misma familia, y a medida que se avanzó constantemente hacia la comprensión de la patogenia molecular subyacente de AIS, se descubrió que estos trastornos eran diferentes expresiones fenotípicas de un síndrome causado por defectos moleculares en el gen del receptor de andrógenos.
AIS es ahora la terminología aceptada para los síndromes que resultan de la falta de respuesta de la célula diana a la acción de las hormonas androgénicas. CAIS abarca los fenotipos descritos previamente por "feminización testicular", Morris' síndrome y síndrome de Goldberg-Maxwell; PAIS incluye el síndrome de Reifenstein, el síndrome de Gilbert-Dreyfus, el síndrome de Lub's, la 'feminización testicular incompleta' y el síndrome de Rosewater; y MAIS incluye el síndrome de Aiman.
Los fenotipos más virilizados de AIS a veces se han descrito como "síndrome del hombre poco virilizado", "síndrome del hombre infértil", "síndrome del hombre fértil poco virilizado", etc., antes de que se reportara evidencia de que estas condiciones eran causadas por mutaciones en el gen AR. Estos diagnósticos se utilizaron para describir una variedad de defectos leves en la virilización; como resultado, los fenotipos de algunos hombres que han sido diagnosticados como tales están mejor descritos por PAIS (por ejemplo, micropene, hipospadias y testículos no descendidos), mientras que otros están mejor descritos por MAIS (por ejemplo, infertilidad masculina aislada o ginecomastia).
Sociedad y cultura
En la película Orchids, My Intersex Adventure, Phoebe Hart y su hermana Bonnie Hart, ambas mujeres con CAIS, documentaron su exploración de AIS y otros temas intersexuales.
La artista de grabación Dalea es una activista hispanoamericana que habla públicamente sobre su CAIS. Ha dado entrevistas sobre su condición y fundó Girl Comet, una iniciativa de inspiración y concientización sobre la diversidad sin fines de lucro.
En 2017, la modelo Hanne Gaby Odiele reveló que nació con el síndrome de insensibilidad a los andrógenos como rasgo intersexual. Cuando eran niños, se sometieron a procedimientos médicos relacionados con la afección, que dijeron que se llevaron a cabo sin que sus padres o ellos mismos lo hicieran. consentimiento informado. Se les informó sobre su condición intersexual semanas antes de comenzar su carrera como modelo.
En la novela de terror japonesa de 1991 Ring y sus secuelas, de Koji Suzuki (más tarde adaptada a películas japonesas, coreanas y estadounidenses), el antagonista central Sadako tiene este síndrome, como lo reveló el Dr. Nagao cuando se enfrentó a Ryuji y Asakawa. La condición de Sadako se conoce con el nombre anterior de "síndrome de feminización testicular".
En la temporada 2, episodio 13 ('Skin Deep') de la serie de televisión House, el testículo canceroso de la paciente principal se confunde con un ovario debido a la CAIS sin descubrir.
En la temporada 2 de la serie de MTV Faking It, un personaje tiene CAIS. El personaje, Lauren Cooper, interpretado por Bailey De Young, fue la primera serie regular intersexual en la televisión estadounidense.
En la temporada 8, episodio 11 ("Delko for the Defense") de la serie de televisión CSI: Miami, el principal sospechoso tiene AIS que lo libera de un cargo de violación.
En la temporada 8, episodio 5 de Llama a la comadrona, una mujer descubre que tiene SIA. Asiste a un frotis cervical y menciona que nunca ha tenido el período y le preocupa tener hijos ya que está a punto de casarse. Luego se le diagnostica "síndrome de feminización testicular", el antiguo término para AIS.
Personas con SIA
- Kitty Anderson (activista)
- Eden Atwood
- Bonnie Hart
- Phoebe Hart
- Maria José Martínez-Patiño
- Hanne Gaby Odiele
- Santhi Soundarajan
- Miriam van der Have
- Kimberly Zieselman
Personas con síndrome de insensibilidad completa a los andrógenos
- Georgiann Davis
- Seven Graham
Personas con síndrome de insensibilidad parcial a los andrógenos
- Tony Briffa
- Se ha descrito que Favorinus of Arelate tiene síndrome de insensibilidad de andrógeno parcial.
- Pequeño Luk
- Eliana Rubashkyn
- Sean Saifa Wall
- Sogto Ochirov
Contenido relacionado
Estuardo Kauffman
Konrad Emil Bloch
Hemofilia