Secreción
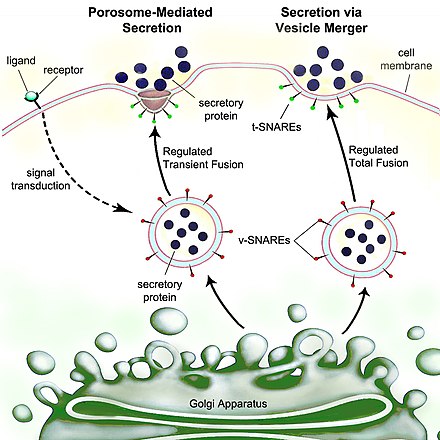
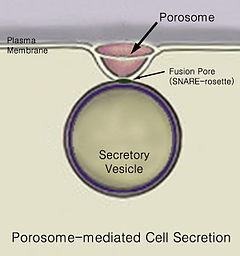
Secreción es el movimiento de material de un punto a otro, como una sustancia química secretada por una célula o glándula. Por el contrario, la excreción es la eliminación de determinadas sustancias o productos de desecho de una célula u organismo. El mecanismo clásico de secreción celular es a través de portales secretores en la membrana plasmática llamados porosomas. Los porosomas son estructuras lipoproteicas permanentes en forma de copa incrustadas en la membrana celular, donde las vesículas secretoras se acoplan y fusionan transitoriamente para liberar contenidos intravesiculares de la célula.
Secreción en especies bacterianas significa el transporte o translocación de moléculas efectoras, por ejemplo: proteínas, enzimas o toxinas (como la toxina del cólera en bacterias patógenas, por ejemplo Vibrio cholerae) desde todo el interior (citoplasma o citosol).) de una célula bacteriana a su exterior. La secreción es un mecanismo muy importante en el funcionamiento bacteriano y en su entorno natural para su adaptación y supervivencia.
En células eucariotas
Mecanismo
Las células eucariotas, incluidas las células humanas, tienen un proceso de secreción muy evolucionado. Las proteínas destinadas al exterior son sintetizadas por ribosomas acoplados al retículo endoplásmico rugoso (RE). A medida que se sintetizan, estas proteínas se trasladan a la luz del RE, donde se glicosilan y donde las chaperonas moleculares ayudan al plegamiento de las proteínas. Las proteínas mal plegadas generalmente se identifican aquí y se retrotranslocan mediante degradación asociada al RE al citosol, donde son degradadas por un proteosoma. Las vesículas que contienen las proteínas correctamente plegadas ingresan al aparato de Golgi.
En el aparato de Golgi, la glicosilación de las proteínas se modifica y pueden ocurrir modificaciones postraduccionales adicionales, incluida la escisión y la funcionalización. Luego, las proteínas se trasladan a vesículas secretoras que viajan a lo largo del citoesqueleto hasta el borde de la célula. Pueden producirse más modificaciones en las vesículas secretoras (por ejemplo, la insulina se escinde de la proinsulina en las vesículas secretoras).
Con el tiempo, se produce una fusión de vesículas con la membrana celular en los porosomas, mediante un proceso llamado exocitosis, que elimina su contenido del entorno celular.
Se mantiene un estricto control bioquímico sobre esta secuencia mediante el uso de un gradiente de pH: el pH del citosol es 7,4, el pH del RE es 7,0 y el cis-golgi tiene un pH de 6,5. Las vesículas secretoras tienen pH que oscilan entre 5,0 y 6,0; algunas vesículas secretoras evolucionan hacia lisosomas, que tienen un pH de 4,8.
Secreción no clásica
Hay muchas proteínas como FGF1 (aFGF), FGF2 (bFGF), interleucina-1 (IL1), etc., que no tienen una secuencia señal. No utilizan la vía clásica ER-Golgi. Estos se secretan a través de diversas vías no clásicas.
Se han descrito al menos cuatro vías de secreción de proteínas no clásicas (no convencionales). Incluyen:
- translocación directa de proteínas en la membrana plasmática probablemente a través de proteínas de transporte de membrana
- blebbing
- secreción lisosomal
- liberación mediante exosomas derivados de cuerpos multivesiculares
Además, las proteínas pueden liberarse de las células mediante heridas mecánicas o fisiológicas y a través de poros oncóticos transitorios y no letales en la membrana plasmática inducidos por el lavado de células con medios o tampones sin suero.
En tejidos humanos
Muchos tipos de células humanas tienen la capacidad de ser células secretoras. Tienen un retículo endoplasmático bien desarrollado y un aparato de Golgi para cumplir esta función. Los tejidos que producen secreciones incluyen el tracto gastrointestinal que secreta enzimas digestivas y ácido gástrico, los pulmones que secretan surfactantes y las glándulas sebáceas que secretan sebo para lubricar la piel y el cabello. Las glándulas de Meibomio en el párpado secretan meibum para lubricar y proteger el ojo.
En bacterias gramnegativas
La secreción no es exclusiva de los eucariotas: también está presente en bacterias y arqueas. Los transportadores tipo casete de unión de ATP (ABC) son comunes a los tres dominios de la vida. Algunas proteínas secretadas se translocan a través de la membrana citoplasmática mediante el translocón SecYEG, uno de los dos sistemas de translocación, que requiere la presencia de un péptido señal N-terminal en la proteína secretada. Otros se translocan a través de la membrana citoplasmática mediante la vía de translocación de arginina gemela (Tat). Las bacterias gramnegativas tienen dos membranas, lo que hace que la secreción sea topológicamente más compleja. Existen al menos seis sistemas de secreción especializados en las bacterias gramnegativas. Muchas proteínas secretadas son particularmente importantes en la patogénesis bacteriana.
Sistema de secreción tipo I (T1SS o TOSS)
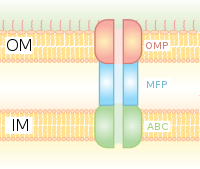
La secreción de tipo I es un sistema de secreción dependiente de chaperonas que emplea los grupos de genes Hly y Tol. El proceso comienza cuando HlyA reconoce una secuencia líder de la proteína que se va a secretar y se une a HlyB en la membrana. Esta secuencia de señales es extremadamente específica del transportador ABC. El complejo HlyAB estimula a HlyD, que comienza a desenrollarse y alcanza la membrana externa donde TolC reconoce una molécula o señal terminal en HlyD. HlyD recluta TolC en la membrana interna y HlyA se excreta fuera de la membrana externa a través de un canal proteico de túnel largo.
El sistema de secreción tipo I transporta diversas moléculas, desde iones, fármacos hasta proteínas de varios tamaños (20 – 900 kDa). Las moléculas secretadas varían en tamaño desde el pequeño péptido colicina V de Escherichia coli (10 kDa) hasta la proteína de adhesión celular LapA de Pseudomonas fluorescens de 520 kDa. Las mejor caracterizadas son las toxinas RTX y las lipasas. La secreción de tipo I también participa en la exportación de sustratos no proteicos como los β-glucanos y polisacáridos cíclicos.

Sistema de secreción tipo II (T2SS)
Las proteínas secretadas a través del sistema tipo II, o rama terminal principal de la vía secretora general, dependen del sistema Sec o Tat para su transporte inicial al periplasma. Una vez allí, pasan a través de la membrana externa a través de un complejo multimérico (12 a 14 subunidades) de proteínas secretinas que forman poros. Además de la proteína secretina, otras 10 a 15 proteínas de la membrana interna y externa componen el aparato de secreción completo, muchas de ellas con función aún desconocida. Los pili gramnegativos de tipo IV utilizan una versión modificada del sistema de tipo II para su biogénesis y, en algunos casos, ciertas proteínas se comparten entre un complejo de pilus y un sistema de tipo II dentro de una sola especie bacteriana.
Sistema de secreción tipo III (T3SS o TSS)
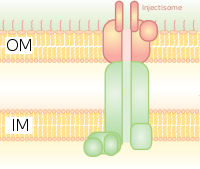
Es homólogo al cuerpo basal de los flagelos bacterianos. Es como una jeringa molecular a través de la cual una bacteria (por ejemplo, ciertos tipos de Salmonella, Shigella, Yersinia, Vibrio) puede inyectar proteínas en células eucariotas. La baja concentración de Ca2+ en el citosol abre la puerta que regula el T3SS. Uno de esos mecanismos para detectar concentraciones bajas de calcio ha sido ilustrado por el antígeno lcrV (respuesta baja de calcio) utilizado por Yersinia pestis, que se utiliza para detectar concentraciones bajas de calcio y provoca la unión de T3SS. El sistema Hrp en patógenos vegetales inyecta arpas y proteínas efectoras de patógenos a través de mecanismos similares en las plantas. Este sistema de secreción se descubrió por primera vez en Yersinia pestis y demostró que las toxinas podían inyectarse directamente desde el citoplasma bacteriano al citoplasma de las células huésped en lugar de simplemente secretarse al medio extracelular.
Sistema de secreción tipo IV (T4SS o TFSS)
Es homólogo a la maquinaria de conjugación de las bacterias, los pili conjugativos. Es capaz de transportar tanto ADN como proteínas. Fue descubierto en Agrobacterium tumefaciens, que utiliza este sistema para introducir la porción de ADN-T del plásmido Ti en la planta huésped, lo que a su vez hace que el área afectada se convierta en una agalla (tumor) de la corona.. Helicobacter pylori utiliza un sistema de secreción de tipo IV para administrar CagA a las células epiteliales gástricas, lo que se asocia con la carcinogénesis gástrica. Bordetella pertussis, el agente causante de la tos ferina, secreta la toxina pertussis en parte a través del sistema tipo IV. Legionella pneumophila, el agente causante de la legionelosis (enfermedad del legionario) utiliza un sistema de secreción de tipo IVB, conocido como icm/dot (intracmultiplicación celular / defecto en el sistema de genes otráfico de organelos), para translocar numerosos genes efectores. proteínas en su huésped eucariota. El sistema de secreción tipo IVA prototípico es el complejo VirB de Agrobacterium tumefaciens.
Los miembros de proteínas de esta familia son componentes del sistema de secreción tipo IV. Median la transferencia intracelular de macromoléculas mediante un mecanismo ancestralmente relacionado con el de las maquinarias de conjugación bacteriana.
Función
El sistema de secreción tipo IV (T4SS) es el mecanismo general por el cual las células bacterianas secretan o absorben macromoléculas. Su mecanismo preciso sigue siendo desconocido. T4SS está codificado en elementos conjugativos Gram-negativos en bacterias. Los T4SS son complejos que abarcan la envoltura celular o, en otras palabras, 11 a 13 proteínas centrales que forman un canal a través del cual el ADN y las proteínas pueden viajar desde el citoplasma de la célula donante al citoplasma de la célula receptora. T4SS también secreta proteínas del factor de virulencia directamente en las células huésped, además de absorber ADN del medio durante la transformación natural.
Estructura
Como se muestra en la figura anterior, TraC, en particular, consta de un haz de tres hélices y un apéndice globular suelto.
Interacciones
T4SS tiene dos proteínas efectoras: en primer lugar, ATS-1, que significa sustrato 1 translocado de Anaplasma, y en segundo lugar, AnkA, que significa proteína A que contiene el dominio repetido de anquirina. Además, las proteínas de acoplamiento de T4SS son VirD4, que se unen a VirE2..
Sistema de secreción tipo V (T5SS)
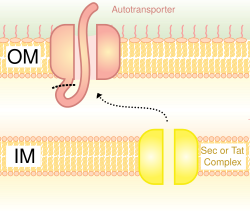
También llamado sistema autotransportador, la secreción tipo V implica el uso del sistema Sec para cruzar la membrana interna. Las proteínas que utilizan esta vía tienen la capacidad de formar un barril beta con su extremo C que se inserta en la membrana externa, permitiendo que el resto del péptido (el dominio pasajero) llegue al exterior de la célula. A menudo, los autotransportadores se escinden, dejando el dominio del barril beta en la membrana externa y liberando el dominio del pasajero. Algunos investigadores creen que los restos de los autotransportadores dieron origen a las porinas que forman estructuras de barril beta similares. Un ejemplo común de un autotransportador que utiliza este sistema de secreción son las adhesinas de autotransportador trimérico.
Sistema de secreción tipo VI (T6SS)
Los sistemas de secreción tipo VI fueron identificados originalmente en 2006 por el grupo de John Mekalanos de la Escuela de Medicina de Harvard (Boston, EE. UU.) en dos bacterias patógenas, Vibrio cholerae y Pseudomonas aeruginosa. Estos se identificaron cuando mutaciones en los genes Hcp y VrgG en Vibrio Cholerae condujeron a una disminución de la virulencia y la patogenicidad. Desde entonces, se han encontrado sistemas de secreción de tipo VI en una cuarta parte de todos los genomas proteobacterianos, incluidos patógenos animales, vegetales y humanos, así como en bacterias del suelo, ambientales o marinas. Si bien la mayoría de los primeros estudios sobre la secreción de tipo VI se centraron en su papel en la patogénesis de organismos superiores, estudios más recientes sugirieron un papel fisiológico más amplio en la defensa contra depredadores eucariotas simples y su papel en las interacciones entre bacterias. Los grupos de genes del sistema de secreción Tipo VI contienen de 15 a más de 20 genes, dos de los cuales, Hcp y VgrG, han demostrado ser sustratos del sistema secretados casi universalmente. El análisis estructural de estas y otras proteínas en este sistema tiene un parecido sorprendente con la punta de la cola del fago T4, y se cree que la actividad del sistema se parece funcionalmente a la infección por fagos.
Liberación de vesículas de la membrana externa
Además del uso de los complejos multiproteicos enumerados anteriormente, las bacterias Gram-negativas poseen otro método para liberar material: la formación de vesículas bacterianas en la membrana externa. Porciones de la membrana externa se desprenden, formando estructuras esféricas a nanoescala hechas de una bicapa lipídica rica en lipopolisacáridos que encierra materiales periplásmicos, y se despliegan para el tráfico de vesículas de membrana para manipular el entorno o invadir la interfaz huésped-patógeno. Se ha descubierto que las vesículas de varias especies bacterianas contienen factores de virulencia, algunas tienen efectos inmunomoduladores y otras pueden adherirse directamente a las células huésped e intoxicarlas. Se ha demostrado que la liberación de vesículas es una respuesta general a condiciones de estrés, pero el proceso de carga de proteínas parece ser selectivo.
En bacterias grampositivas
En algunas especies de Staphylococcus y Streptococcus, el sistema secretor accesorio maneja la exportación de glicoproteínas de adhesión altamente repetitivas.