Gasto cardíaco
En fisiología cardíaca, gasto cardíaco, débito cardíaco o bombeo cardíaco, a menudo denotado por los símbolos , , y , es la velocidad de flujo volumétrico de la salida de bombeo del corazón: es decir, el volumen de sangre siendo bombeado por un solo ventrículo del corazón, por tiempo unitario (generalmente medido por minuto). La salida cardiaca (CO) es el producto de la frecuencia cardíaca (HR), es decir, el número de latidos cardíacos por minuto (bpm), y el volumen de trazo (SV), que es el volumen de sangre bombeado del ventrículo izquierdo por latido; dando así la fórmula:
Los valores del gasto cardíaco generalmente se indican como L/min. Para una persona sana que pesa 70 kg, el gasto cardíaco en reposo promedia alrededor de 5 l/min; suponiendo una frecuencia cardíaca de 70 latidos/min, el volumen sistólico sería de aproximadamente 70 ml.
Debido a que el gasto cardíaco está relacionado con la cantidad de sangre administrada a varias partes del cuerpo, es un componente importante de la eficiencia con la que el corazón puede satisfacer las demandas del cuerpo para el mantenimiento de una perfusión tisular adecuada. Los tejidos corporales requieren un suministro continuo de oxígeno que requiere el transporte sostenido de oxígeno a los tejidos mediante la circulación sistémica de sangre oxigenada a una presión adecuada desde el ventrículo izquierdo del corazón a través de la aorta y las arterias. El suministro de oxígeno (DO2 mL/min) es el resultado del flujo sanguíneo (gasto cardíaco CO) multiplicado por el contenido de oxígeno en la sangre (CaO2). Matemáticamente, esto se calcula de la siguiente manera: suministro de oxígeno = gasto cardíaco × contenido de oxígeno arterial, dando la fórmula:
Con un gasto cardíaco en reposo de 5 l/min, un resultado 'normal' el suministro de oxígeno es de alrededor de 1 L/min. La cantidad/porcentaje del oxígeno circulante consumido (VO2) por minuto a través del metabolismo varía según el nivel de actividad, pero en reposo es alrededor del 25 % del DO2. El ejercicio físico requiere un nivel de consumo de oxígeno superior al de reposo para apoyar una mayor actividad muscular. En el caso de insuficiencia cardíaca, el CO real puede ser insuficiente para soportar incluso las actividades más sencillas de la vida diaria; ni puede aumentar lo suficiente para satisfacer las demandas metabólicas más altas derivadas incluso del ejercicio moderado.
El gasto cardíaco es un parámetro de flujo sanguíneo global de interés en hemodinámica, el estudio del flujo de sangre. Los factores que afectan el volumen sistólico y la frecuencia cardíaca también afectan el gasto cardíaco. La figura del margen derecho ilustra esta dependencia y enumera algunos de estos factores. En una figura posterior se proporciona una ilustración jerárquica detallada.
Existen muchos métodos para medir el CO, tanto de forma invasiva como no invasiva; cada uno tiene ventajas y desventajas como se describe a continuación.
Definición
La función del corazón es impulsar la sangre a través del sistema circulatorio en un ciclo que entrega oxígeno, nutrientes y químicos a las células del cuerpo y elimina los desechos celulares. Debido a que bombea toda la sangre que regresa del sistema venoso, la cantidad de sangre que regresa al corazón determina efectivamente la cantidad de sangre que el corazón bombea: su gasto cardíaco, Q. El gasto cardíaco se define clásicamente junto con el volumen sistólico (SV) y la frecuencia cardíaca (FC) como:
-
CO[L/min]=SV[L/beat]× × HR[Beats/min]{displaystyle CO_{text{[L/min]}=SV_{text{[L/beat]}times ¿Qué?
()1)
Al estandarizar qué valores de CO se consideran dentro del rango normal independientemente del tamaño del cuerpo del sujeto, la convención aceptada es indexar aún más la ecuación (1) usando el área de superficie corporal (BSA), dando lugar al índice cardíaco (IC). Esto se detalla en la ecuación (2) a continuación.
Medición
Existen varios métodos clínicos para medir el gasto cardíaco, que van desde el cateterismo intracardíaco directo hasta la medición no invasiva del pulso arterial. Cada método tiene ventajas y desventajas. La comparación relativa está limitada por la ausencia de un "estándar de oro" ampliamente aceptado. medición. El gasto cardíaco también puede verse afectado significativamente por la fase de la respiración: los cambios de presión intratorácica influyen en el llenado diastólico y, por lo tanto, en el gasto cardíaco. Esto es especialmente importante durante la ventilación mecánica, en la que el gasto cardíaco puede variar hasta en un 50 % en un solo ciclo respiratorio. Por lo tanto, el gasto cardíaco debe medirse en puntos espaciados uniformemente durante un solo ciclo o promediarse durante varios ciclos.
Los métodos invasivos están bien aceptados, pero cada vez hay más evidencia de que estos métodos no son precisos ni efectivos para guiar la terapia. En consecuencia, el enfoque en el desarrollo de métodos no invasivos está creciendo.
Ultrasonido Doppler
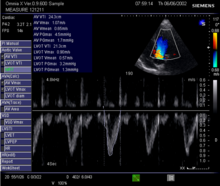
Este método utiliza ultrasonido y el efecto Doppler para medir el gasto cardíaco. La velocidad de la sangre a través del corazón provoca un cambio Doppler en la frecuencia de las ondas de ultrasonido que regresan. Este cambio se puede usar para calcular la velocidad y el volumen del flujo, y efectivamente el gasto cardíaco, usando las siguientes ecuaciones:
- Q=SV× × HR{displaystyle Q=SVtimes ¡Risas!
- SV=VTI× × CSA{displaystyle SV=VTItimes CSA}
- CSA=π π r2{displaystyle CSA=pi r^{2}
donde:
- CSA es el área de sección transversal de válvula orificios,
- r es el radio de la válvula, y,
- VTI es el tiempo de velocidad integral de la traza del perfil de flujo Doppler.
Al ser no invasiva, precisa y económica, la ecografía Doppler es una parte rutinaria de la ecografía clínica; tiene altos niveles de confiabilidad y reproducibilidad, y ha estado en uso clínico desde la década de 1960.
Ecocardiografía
La ecocardiografía es un método no invasivo para cuantificar el gasto cardíaco mediante ultrasonido. Las mediciones de ultrasonido bidimensional (2D) y Doppler se usan juntas para calcular el gasto cardíaco. La medición 2D del diámetro (d) del anillo aórtico permite calcular el área de sección transversal del flujo (CSA), que luego se multiplica por el VTI del perfil de flujo Doppler a través de la válvula aórtica para determinar el volumen de flujo por latido (golpe). volumen, SV). Luego, el resultado se multiplica por la frecuencia cardíaca (FC) para obtener el gasto cardíaco. Aunque se utiliza en medicina clínica, tiene una amplia variabilidad test-retest. Se dice que requiere una amplia formación y habilidad, pero nunca se han revelado los pasos exactos necesarios para lograr una precisión clínicamente adecuada. La medición 2D del diámetro de la válvula aórtica es una fuente de ruido; otros son variaciones latido a latido en el volumen sistólico y diferencias sutiles en la posición de la sonda. Una alternativa que no es necesariamente más reproducible es la medición de la válvula pulmonar para calcular el GC del lado derecho. Aunque es de uso generalizado, la técnica requiere mucho tiempo y está limitada por la reproducibilidad de sus elementos componentes. En la forma utilizada en la práctica clínica, la precisión de SV y CO es del orden de ±20%.
Transcutáneo
El monitor ultrasónico de gasto cardíaco (USCOM) utiliza Doppler de onda continua para medir el perfil de flujo Doppler VTI. Utiliza la antropometría para calcular los diámetros de las válvulas aórtica y pulmonar y los CSA, lo que permite mediciones Q del lado derecho e izquierdo. En comparación con el método ecocardiográfico, USCOM mejora significativamente la reproducibilidad y aumenta la sensibilidad de detección de cambios en el flujo. El seguimiento automático y en tiempo real del perfil de flujo Doppler permite mediciones Q del lado derecho e izquierdo latido a latido, lo que simplifica la operación y reduce el tiempo de adquisición en comparación con la ecocardiografía convencional. USCOM ha sido validado de 0,12 L/min a 18,7 L/min en recién nacidos, niños y adultos. El método se puede aplicar con igual precisión a pacientes de todas las edades para el desarrollo de protocolos hemodinámicos fisiológicamente racionales. USCOM es el único método de medición del gasto cardíaco que ha logrado una precisión equivalente a la sonda de flujo implantable. Esta precisión ha asegurado altos niveles de uso clínico en condiciones que incluyen sepsis, insuficiencia cardíaca e hipertensión.
Transesofágico
El Doppler transesofágico incluye dos tecnologías principales; ecocardiograma transesofágico, que se usa principalmente con fines de diagnóstico, y monitoreo Doppler esofágico, que se usa principalmente para el monitoreo clínico del gasto cardíaco. Este último utiliza Doppler de onda continua para medir la velocidad de la sangre en la aorta torácica descendente. Se inserta una sonda de ultrasonido por vía oral o nasal en el esófago hasta el nivel torácico medio, en cuyo punto el esófago se encuentra junto a la aorta torácica descendente. Debido a que el transductor está cerca del flujo de sangre, la señal es clara. Es posible que sea necesario volver a enfocar la sonda para garantizar una señal óptima. Este método tiene una buena validación, se usa ampliamente para el manejo de fluidos durante la cirugía con evidencia de mejores resultados para los pacientes y ha sido recomendado por el Instituto Nacional para la Salud y la Excelencia Clínica (NICE) del Reino Unido. La monitorización Doppler esofágica mide la velocidad de la sangre y no el verdadero Q, por lo que se basa en un nomograma basado en la edad, la altura y el peso del paciente para convertir la velocidad medida en volumen sistólico y gasto cardíaco. Este método generalmente requiere sedación del paciente y se acepta su uso tanto en adultos como en niños.
Métodos de presión de pulso
Los métodos de presión de pulso (PP) miden la presión en una arteria a lo largo del tiempo para derivar una forma de onda y usar esta información para calcular el rendimiento cardíaco. Sin embargo, cualquier medida de la arteria incluye cambios en la presión asociados con cambios en la función arterial, por ejemplo, distensibilidad e impedancia. Se supone que los cambios fisiológicos o terapéuticos en el diámetro del vaso reflejan cambios en Q. Los métodos de PP miden el rendimiento combinado del corazón y los vasos sanguíneos, lo que limita su aplicación para la medición de Q. Esto se puede compensar parcialmente con la calibración intermitente de la forma de onda a otro método de medición de Q y luego monitoreando la forma de onda PP. Idealmente, la forma de onda PP debe calibrarse latido a latido. Existen métodos invasivos y no invasivos para medir la PP.
Metodología Finapres
En 1967, el fisiólogo checo Jan Peňáz inventó y patentó el método de abrazadera de volumen para medir la presión arterial continua. El principio del método de abrazadera de volumen es proporcionar dinámicamente presiones iguales, a ambos lados de la pared de una arteria. Al sujetar la arteria a un cierto volumen, la presión interna (presión intraarterial) equilibra la presión externa (presión del manguito del dedo). Peñáz decidió que el dedo era el sitio óptimo para aplicar este método de fijación de volumen. El uso de manguitos para los dedos excluye la aplicación del dispositivo en pacientes sin vasoconstricción, como en sepsis o en pacientes con vasopresores.
En 1978, los científicos de BMI-TNO, la unidad de investigación de la Organización Holandesa para la Investigación Científica Aplicada de la Universidad de Amsterdam, inventaron y patentaron una serie de elementos clave adicionales que hacen que la abrazadera de volumen funcione en la práctica clínica. Estos métodos incluyen el uso de luz infrarroja modulada en el sistema óptico dentro del sensor, el manguito para el dedo liviano y fácil de envolver con fijación de velcro, un nuevo principio de válvula de control proporcional neumático y una estrategia de punto fijo para determinar y rastrear la volumen correcto al que sujetar las arterias de los dedos: el sistema Physiocal. Un acrónimo de calibración fisiológica de las arterias de los dedos, este rastreador Physiocal resultó ser preciso, robusto y confiable.
La metodología Finapres se desarrolló para utilizar esta información para calcular la presión arterial a partir de los datos de presión del manguito del dedo. Se desarrolló un algoritmo generalizado para corregir la diferencia de nivel de presión entre el dedo y los sitios braquiales en los pacientes. Esta corrección funcionó en todas las circunstancias en las que se probó, incluso cuando no fue diseñada para ello, porque aplicó principios fisiológicos generales. Este innovador método de reconstrucción de la forma de onda de la presión braquial se implementó por primera vez en Finometer, el sucesor de Finapres que BMI-TNO introdujo en el mercado en el año 2000.
La disponibilidad de una forma de onda de presión arterial calibrada, de alta fidelidad y continua abrió la perspectiva del cálculo latido a latido de la hemodinámica integrada, basada en dos nociones: la presión y el flujo están interrelacionados en cada sitio de la sangre arterial. sistema por su llamada impedancia característica. En el sitio aórtico proximal, el modelo Windkessel de 3 elementos de esta impedancia se puede modelar con suficiente precisión en un paciente individual con edad, sexo, altura y peso conocidos. Según las comparaciones de monitores vasculares periféricos no invasivos, la modesta utilidad clínica está restringida a pacientes con circulación normal e invariable.
Invasivo
La monitorización invasiva de la PP implica la inserción de un sensor de presión manómetro en una arteria, generalmente la arteria radial o femoral, y la medición continua de la forma de onda de la PP. Esto generalmente se hace conectando el catéter a un dispositivo de procesamiento de señales con una pantalla. A continuación, la forma de onda de PP se puede analizar para proporcionar mediciones del rendimiento cardiovascular. Los cambios en la función vascular, la posición de la punta del catéter o la amortiguación de la señal de forma de onda de presión afectarán la precisión de las lecturas. Las mediciones invasivas de PP se pueden calibrar o descalibrar.
PP calibrado: PiCCO, LiDCO
PiCCO (PULSION Medical Systems AG, Múnich, Alemania) y PulseCO (LiDCO Ltd, Londres, Inglaterra) generan Q continuos mediante analizando la forma de onda de PP arterial. En ambos casos, se requiere una técnica independiente para proporcionar la calibración del análisis Q continuo porque el análisis de PP arterial no puede tener en cuenta las variables no medidas, como la distensibilidad cambiante del lecho vascular. Se recomienda la recalibración después de cambios en la posición, la terapia o el estado del paciente.
En PiCCO, la termodilución transpulmonar, que usa el principio de Stewart-Hamilton pero mide los cambios de temperatura desde la línea venosa central a una línea arterial central, es decir, la línea arterial femoral o axilar, se usa como técnica de calibración. El valor de Q derivado de la termodilución con solución salina fría se utiliza para calibrar el contorno de la PP arterial, que luego puede proporcionar una monitorización continua de Q. El algoritmo PiCCO depende de la morfología de la forma de onda de la presión arterial (análisis matemático de la forma de onda PP) y calcula el Q continuo como lo describen Wesseling y colegas. La termodilución transpulmonar abarca el corazón derecho, la circulación pulmonar y el corazón izquierdo, lo que permite un análisis matemático adicional de la curva de termodilución y proporciona mediciones de los volúmenes de llenado cardíaco (GEDV), el volumen de sangre intratorácica y el agua pulmonar extravascular. La termodilución transpulmonar permite una calibración de Q menos invasiva, pero es menos precisa que la termodilución PA y requiere una vía venosa central y arterial con los riesgos de infección asociados.
En LiDCO, la técnica de calibración independiente es la dilución de cloruro de litio mediante el principio de Stewart-Hamilton. La dilución de cloruro de litio utiliza una vena periférica y una vía arterial periférica. Al igual que PiCCO, se recomienda una calibración frecuente cuando hay un cambio en Q. Los eventos de calibración tienen una frecuencia limitada porque involucran la inyección de cloruro de litio y pueden estar sujetos a errores en presencia de ciertos relajantes musculares. El algoritmo PulseCO utilizado por LiDCO se basa en la derivación de potencia de pulso y no depende de la morfología de la forma de onda.
Análisis estadístico de la presión arterial – FloTrac/Vigileo
FloTrac/Vigileo (Edwards Lifesciences) es un monitor hemodinámico sin calibrar basado en el análisis del contorno de pulso. Estima la salida cardíaca (Q) utilizando un catéter arterial estándar con un manómetro situado en la arteria femoral o radial. El dispositivo consiste en un transductor de presión de alta fidelidad, que, cuando se utiliza con un monitor de soporte (vigileo o monitor EV1000), deriva la salida cardiaca del lado izquierdo (Q) de una muestra de pulsaciones arteriales. El dispositivo utiliza un algoritmo basado en la ley Frank-Starling del corazón, que establece presión de pulso (PP) proporcional al volumen de trazo (SV). El algoritmo calcula el producto de la desviación estándar de la onda de presión arterial (AP) durante un período muestreado de 20 segundos y un factor de tono vascular (Khi, o χ) para generar volumen de trazo. La ecuación en forma simplificada es: SV=std()AP)⋅ ⋅ χ χ {textstyle SV=mathrm {std} (AP)cdot chi }, o BP⋅ ⋅ k()constant){fnMicrosoft Sans Serif}. Khi está diseñado para reflejar la resistencia arterial; el cumplimiento es una ecuación polinomial multivariada que cuantifica continuamente el cumplimiento arterial y la resistencia vascular. Khi lo hace analizando los cambios morfológicos de las ondas de presión arterial sobre una base bit-by-bit, sobre la base del principio de que los cambios en el cumplimiento o la resistencia afectan la forma de la onda de presión arterial. Al analizar la forma de dichas ondas, se evalúa el efecto del tono vascular, permitiendo el cálculo de la VV. Q se deriva entonces utilizando la ecuación (1). Sólo los ritmos perfumados que generan una onda arterial son contados en HR.
Este sistema estima Q utilizando un catéter arterial existente con precisión variable. Estos monitores arteriales no requieren cateterismo intracardíaco desde un catéter de arteria pulmonar. Requieren una línea arterial y por lo tanto son invasivos. Al igual que con otros sistemas de forma de onda arterial, los cortos tiempos de configuración y adquisición de datos son beneficios de esta tecnología. Las desventajas incluyen su incapacidad para proporcionar datos sobre las presiones del corazón derecho o la saturación de oxígeno venoso mixto. La medición de la variación del volumen sistólico (SVV), que predice la capacidad de respuesta del volumen, es intrínseca a todas las tecnologías de forma de onda arterial. Se utiliza para gestionar la optimización de fluidos en pacientes quirúrgicos de alto riesgo o en estado crítico. Se ha publicado un programa de optimización fisiológica basado en principios hemodinámicos que incorpora los pares de datos SV y SVV.
Los sistemas de monitorización arterial no pueden predecir cambios en el tono vascular; estiman los cambios en la distensibilidad vascular. La medición de la presión en la arteria para calcular el flujo en el corazón es fisiológicamente irracional y de precisión cuestionable, y de beneficio no probado. La monitorización de la presión arterial es limitada en pacientes sin ventilación, en fibrilación auricular, en pacientes con vasopresores y en aquellos con un sistema autónomo dinámico, como aquellos con sepsis.
Sin datos demográficos preestimados y sin calibrar: PRAM
Método analítico de registro de presión (PRAM), estima Q a partir del análisis del perfil de onda de presión obtenido de un catéter arterial, acceso radial o femoral. Esta forma de onda PP se puede usar para determinar Q. Como la forma de onda se muestrea a 1000 Hz, la curva de presión detectada se puede medir para calcular el volumen sistólico real latido a latido. A diferencia de FloTrac, no se necesitan valores constantes de impedancia de calibración externa ni datos preestimados in vivo o in vitro.
PRAM ha sido validado frente a los métodos estándar de oro considerados en condiciones estables y en varios estados hemodinámicos. Se puede usar para monitorear pacientes pediátricos y con soporte mecánico.
Los valores hemodinámicos generalmente monitoreados, los parámetros de respuesta a los fluidos y una referencia exclusiva son proporcionados por PRAM: Eficiencia del ciclo cardíaco (CCE). Se expresa mediante un número puro que va de 1 (mejor) a -1 (peor) e indica el acoplamiento global de la respuesta cardiaca-vascular. La relación entre el rendimiento del corazón y la energía consumida, representada como CCE "índice de estrés", puede ser de suma importancia para comprender la evolución presente y futura del paciente.
Cardiografía de impedancia
La cardiografía de impedancia (a menudo abreviada como ICG o bioimpedancia eléctrica torácica [TEB]) mide los cambios en la impedancia eléctrica en la región torácica durante el ciclo cardíaco. Una impedancia más baja indica un mayor volumen de líquido intratorácico y flujo sanguíneo. Al sincronizar los cambios de volumen de líquido con los latidos del corazón, el cambio de impedancia se puede utilizar para calcular el volumen sistólico, el gasto cardíaco y la resistencia vascular sistémica.
Se utilizan enfoques tanto invasivos como no invasivos. La fiabilidad y validez del abordaje no invasivo ha ganado cierta aceptación, aunque no existe un acuerdo total sobre este punto. El uso clínico de este enfoque en el diagnóstico, pronóstico y terapia de una variedad de enfermedades continúa.
El equipo ICG no invasivo incluye los productos Bio-Z Dx, Niccomo y TEBCO de BoMed.
Dilución por ultrasonido
La dilución por ultrasonido (UD) usa solución salina normal (NS) a temperatura corporal como indicador introducido en un circuito extracorpóreo para crear una circulación auriculoventricular (AV) con un sensor de ultrasonido, que se usa para medir la dilución y luego calcular el gasto cardíaco utilizando un algoritmo propietario. Con este método se pueden calcular otras variables hemodinámicas, como el volumen total al final de la diástole (TEDV), el volumen de sangre central (CBV) y el volumen de circulación activa (ACVI).
El método UD se introdujo por primera vez en 1995. Se usó ampliamente para medir el flujo y los volúmenes con condiciones de circuitos extracorpóreos, como ECMO y hemodiálisis, lo que generó más de 150 publicaciones revisadas por pares. UD ahora se ha adaptado a las unidades de cuidados intensivos (UCI) como el dispositivo COstatus.
El método UD se basa en la dilución del indicador de ultrasonido. La velocidad del ultrasonido sanguíneo (1560–1585 m/s) es una función de la concentración total de proteínas en la sangre (sumas de proteínas en el plasma y en los glóbulos rojos) y la temperatura. La inyección de solución salina normal a temperatura corporal (la velocidad de ultrasonido de la solución salina es de 1533 m/s) en un circuito AV único reduce la velocidad de ultrasonido en sangre y produce curvas de dilución.
UD requiere el establecimiento de una circulación extracorpórea a través de su bucle AV único con dos líneas venosas centrales y arteriales preexistentes en pacientes de la UCI. Cuando el indicador de solución salina se inyecta en el bucle AV, el sensor venoso con pinza en el bucle lo detecta antes de que entre en la aurícula derecha del corazón del paciente. Después de que el indicador atraviesa el corazón y el pulmón, la curva de concentración en la línea arterial se registra y se muestra en el monitor COstatus HCM101. El gasto cardíaco se calcula a partir del área de la curva de concentración utilizando la ecuación de Stewart-Hamilton. UD es un procedimiento no invasivo, que requiere solo una conexión al bucle AV y dos líneas de un paciente. El UD se ha especializado para su aplicación en pacientes pediátricos de la UCI y se ha demostrado que es relativamente seguro aunque invasivo y reproducible.
Cardiometría eléctrica
La cardiometría eléctrica es un método no invasivo similar a la cardiografía de impedancia; ambos métodos miden la bioimpedancia eléctrica torácica (TEB). El modelo subyacente difiere entre los dos métodos; La cardiometría eléctrica atribuye el fuerte aumento de TEB latido a latido al cambio en la orientación de los glóbulos rojos. Se requieren cuatro electrodos de ECG estándar para medir el gasto cardíaco. La cardiometría eléctrica es un método registrado por Cardiotronic, Inc. y muestra resultados prometedores en una amplia variedad de pacientes. Actualmente está aprobado en los EE. UU. para su uso en adultos, niños y bebés. Los monitores de cardiometría eléctrica se han mostrado prometedores en pacientes quirúrgicos cardíacos posoperatorios, tanto en casos hemodinámicamente estables como inestables.
Imágenes por resonancia magnética
Contraste de fase con codificación de velocidad La resonancia magnética nuclear (RMN) es la técnica más precisa para medir el flujo en los grandes vasos de los mamíferos. Se ha demostrado que las mediciones de flujo de MRI son muy precisas en comparación con las mediciones realizadas con un vaso de precipitados y un temporizador, y menos variables que el principio de Fick y la termodilución.
La resonancia magnética codificada por velocidad se basa en la detección de cambios en la fase de precesión de protones. Estos cambios son proporcionales a la velocidad de los protones' movimiento a través de un campo magnético con un gradiente conocido. Cuando se usa una resonancia magnética codificada por velocidad, el resultado son dos conjuntos de imágenes, una para cada punto de tiempo en el ciclo cardíaco. Una es una imagen anatómica y la otra es una imagen en la que la intensidad de la señal en cada píxel es directamente proporcional a la velocidad a través del plano. La velocidad promedio en un vaso, es decir, la aorta o la arteria pulmonar, se cuantifica midiendo la intensidad de señal promedio de los píxeles en la sección transversal del vaso y luego multiplicándola por una constante conocida. El flujo se calcula multiplicando la velocidad media por el área de la sección transversal del recipiente. Estos datos de flujo se pueden usar en un gráfico de flujo versus tiempo. El área bajo la curva de flujo versus tiempo para un ciclo cardíaco es el volumen sistólico. La duración del ciclo cardíaco se conoce y determina la frecuencia cardíaca; Q se puede calcular usando la ecuación (1). La resonancia magnética se usa típicamente para cuantificar el flujo durante un ciclo cardíaco como el promedio de varios latidos cardíacos. También es posible cuantificar el volumen sistólico en tiempo real latido por latido.
Si bien la resonancia magnética es una herramienta de investigación importante para medir con precisión Q, actualmente no se usa clínicamente para el monitoreo hemodinámico en entornos de emergencia o cuidados intensivos. A partir de 2015, la medición del gasto cardíaco por resonancia magnética se usa de forma rutinaria en los exámenes clínicos de resonancia magnética cardíaca.
Método de dilución de tinte
El método de dilución del tinte se realiza inyectando rápidamente un tinte, verde indocyanino, en el atrio derecho del corazón. El tinte fluye con la sangre en la aorta. Una sonda se inserta en la aorta para medir la concentración del tinte dejando el corazón a intervalos de tiempo iguales [0, THasta que el tinte se haya despejado. Vamos c()t) ser la concentración del tinte a la vez t. Dividiendo los intervalos de tiempo de [0, T] en subintervalos Δt, la cantidad de tinte que fluye más allá del punto de medición durante el subintervalo desde t=ti− − 1{displaystyle t=t_{i-1} a t=ti{displaystyle t=t_{i} es:
()concentration)()volume)=c()ti)()FΔ Δ t){displaystyle (concentración)=c(t_{i})(FDelta t)}
Donde F{displaystyle F} es la tasa de flujo que se está calculando. La cantidad total de tinte es:
.. i=1nc()ti)()FΔ Δ t)=F.. i=1nc()ti)()Δ Δ t){displaystyle sum _{i=1}{n}c(t_{i})(FDelta t)=Fsum _{i=1}{n}c(t_{i})}(Delta t)}
y, dejando n→ → JUEGO JUEGO {displaystyle nrightarrow infty}, la cantidad de tinte es:
A=F∫ ∫ 0Tc()t)dt{displaystyle A=Fint _{0} {T}c(t)dt}
Así, el gasto cardíaco viene dado por:
F=A∫ ∫ 0Tc()t)dt{displaystyle F={frac}{0} {f} {f} {fnK}}}}
donde se inyecta la cantidad de tinte A{displaystyle A} es conocido, y la integral se puede determinar utilizando las lecturas de concentración.
El método de dilución de tinte es uno de los métodos más precisos para determinar el gasto cardíaco durante el ejercicio. El error de un solo cálculo de los valores de gasto cardíaco en reposo y durante el ejercicio es inferior al 5%. Este método no permite la medición de 'latido a latido' cambia y requiere un gasto cardíaco estable durante aproximadamente 10 s durante el ejercicio y 30 s en reposo.
Factores que influyen en el gasto cardíaco
El gasto cardíaco está controlado principalmente por el requerimiento de oxígeno de los tejidos del cuerpo. A diferencia de otros sistemas de bombeo, el corazón es una bomba de demanda que no regula su propio gasto. Cuando el cuerpo tiene una alta demanda metabólica de oxígeno, el flujo metabólicamente controlado a través de los tejidos aumenta, lo que lleva a un mayor flujo de sangre de regreso al corazón, lo que lleva a un mayor gasto cardíaco.
La capacitancia, también conocida como distensibilidad, de los canales arteriovasculares que transportan la sangre también controla el gasto cardíaco. A medida que los vasos sanguíneos del cuerpo se expanden y contraen activamente, la resistencia al flujo sanguíneo disminuye y aumenta respectivamente. Las venas de paredes delgadas tienen aproximadamente dieciocho veces la capacidad de las arterias de paredes gruesas porque pueden transportar más sangre en virtud de ser más distensibles.
A partir de esta fórmula, queda claro que los factores que afectan el volumen sistólico y la frecuencia cardíaca también afectan el gasto cardíaco. La figura de la derecha ilustra esta dependencia y enumera algunos de estos factores. En una figura posterior se proporciona una ilustración jerárquica más detallada.
La ecuación (1) revela que la FC y el SV son los principales determinantes del gasto cardíaco Q. En la figura de la derecha se ilustra una representación detallada de estos factores. Los principales factores que influyen en la FC son la inervación autonómica más el control endocrino. No se muestran los factores ambientales, como los electrolitos, los productos metabólicos y la temperatura. Los determinantes de la VS durante el ciclo cardíaco son la contractilidad del músculo cardíaco, el grado de precarga de la distensión miocárdica antes del acortamiento y la poscarga durante la eyección. Otros factores, como los electrolitos, pueden clasificarse como agentes inotrópicos positivos o negativos.
Respuesta cardíaca
| |||||||||||||||
|
Importancia clínica
Cuando Q aumenta en una persona sana pero no entrenada, la mayor parte del aumento se puede atribuir a un aumento en la frecuencia cardíaca (FC). El cambio de postura, el aumento de la actividad del sistema nervioso simpático y la disminución de la actividad del sistema nervioso parasimpático también pueden aumentar el gasto cardíaco. La FC puede variar en un factor de aproximadamente 3, entre 60 y 180 latidos por minuto, mientras que el volumen sistólico (SV) puede variar entre 70 y 120 ml (2,5 y 4,2 imp fl oz; 2,4 y 4,1 US fl oz), un factor de solo 1.7.
Las enfermedades del sistema cardiovascular a menudo se asocian con cambios en Q, particularmente las enfermedades pandémicas hipertensión e insuficiencia cardíaca. El aumento de Q puede estar asociado con enfermedades cardiovasculares que pueden ocurrir durante infecciones y sepsis. La disminución del Q puede estar asociada con cardiomiopatía e insuficiencia cardíaca. En ocasiones, en presencia de enfermedad ventricular asociada a dilatación, la EDV puede variar. Un aumento de la EDV podría contrarrestar la dilatación del VI y el deterioro de la contracción. A partir de la ecuación (3), el gasto cardíaco Q resultante puede permanecer constante. La capacidad de medir con precisión Q es importante en la medicina clínica porque proporciona un mejor diagnóstico de anomalías y puede usarse para guiar el manejo adecuado.
Valores de ejemplo
| Volumen ventricular | ||
|---|---|---|
| Medida | Ventrículo derecho | Ventrículo izquierdo |
| Volumen diastólico final | 144 mL (± 23 mL) | 142 mL (± 21 mL) |
| Volumen diastólico final / superficie corporal (mL/m2) | 78 mL/m2 (± 11 mL/m2) | 78 mL/m2 (± 8,8 mL/m2) |
| Volumen sistólico final | 50 mL (± 14 mL) | 47 mL (± 10 mL) |
| Volumen sistólico final / superficie corporal (mL/m2) | 27 mL/m2 (± 7 mL/m2) | 26 mL/m2 (± 5,1 mL/m2) |
| Volumen de troque | 94 mL (± 15 mL) | 95 mL (± 14 mL) |
| Volumen de descarga / superficie del cuerpo (mL/m2) | 51 mL/m2 (± 7 mL/m2) | 52 mL/m2 (± 6,2 mL/m2) |
| Fracción de eyección | 66% (± 6%) | 67% (± 4,6%) |
| Tasa cardíaca | 60 a 100 horas | 60 a 100 horas |
| Salida cardiaca | 4.0–8.0 L/minuto | 4.0–8.0 L/minuto |
Medidas relacionadas
Fracción de eyección
La fracción de eyección (EF) es un parámetro relacionado con SV. FE es la fracción de sangre expulsada por el ventrículo izquierdo (VI) durante la fase de contracción o eyección del ciclo cardíaco o sístole. Antes del inicio de la sístole, durante la fase de llenado (diástole), el VI se llena de sangre hasta la capacidad conocida como volumen diastólico final (EDV). Durante la sístole, el VI se contrae y expulsa sangre hasta que alcanza su capacidad mínima conocida como volumen sistólico final (ESV). No se vacía por completo. Las siguientes ecuaciones ayudan a traducir el efecto de EF y EDV en el gasto cardíaco Q, a través de SV.
-
-
SV=EDV− − ESVEF=SVEDV× × 100% % Q=SV× × HR=EF× × EDV× × HR100% % {displaystyle {begin{aligned}SV círculo=EDV-ESV\\fnMicroc Horas 100%\QUÉ=SVtimes HR\ {EFtimes EDVtimes ¿Qué?
()3)
-
Ingreso cardíaco
El gasto cardíaco (IC) es la operación inversa del gasto cardíaco. Así como el gasto cardíaco implica la expresión volumétrica de la fracción de eyección, el gasto cardíaco implica la fracción de inyección volumétrica (FI).
IF = volumen diastólico final (EDV) / volumen sistólico final (ESV)
La entrada cardíaca es un modelo matemático con imágenes de la diástole.
Índice cardíaco
En todos los mamíferos en reposo de masa normal, el valor de CO es una función lineal de la masa corporal con una pendiente de 0,1 L/(min kg). La grasa tiene alrededor del 65% de la demanda de oxígeno por masa en comparación con otros tejidos corporales magros. Como resultado, el cálculo del valor normal de CO en un sujeto obeso es más complejo; un único y común "normal" valor de SV y CO para adultos no puede existir. Todos los parámetros de flujo sanguíneo deben indexarse. Es una convención aceptada indexarlos por el área de superficie corporal, BSA [m2], por DuBois & Fórmula DuBois, una función de la altura y el peso:
Los parámetros indexados resultantes son el índice de accidente cerebrovascular (SI) y el índice cardíaco (IC). El índice de carrera, medido en ml/latido/m2, se define como
El índice cardíaco, medido en L/(min m2), se define como
La ecuación de CO (1) para los parámetros indexados cambia a lo siguiente.
-
CI[L/min/m2]=()SI[mL/beat/m2]× × HR[bpm])/1000{displaystyle CI_{mathrm [L/min/{m} {2}} }=(SI_{mathrm {[mL/beat/{m}{2}} }times HR_{mathrm {[bpm]})/1000}
()2)
El rango normal para estos parámetros de flujo sanguíneo indexados está entre 35 y 65 ml/latido/m2 para SI y entre 2,5 y 4 L/(min m2) para IC.
Gasto cardíaco combinado
El gasto cardíaco combinado es la suma de los gastos de los lados derecho e izquierdo del corazón. Es una medida útil en la circulación fetal, donde los gastos cardíacos de ambos lados del corazón funcionan en parte en paralelo por el foramen oval y el conducto arterioso, que irrigan directamente la circulación sistémica.
Métodos históricos
Principio de Fick
El principio de Fick, descrito por primera vez por Adolf Eugen Fick en 1870, asume que la tasa de consumo de oxígeno es una función de la tasa de flujo sanguíneo y la tasa de oxígeno captado por los glóbulos rojos. La aplicación del principio de Fick implica calcular el oxígeno consumido a lo largo del tiempo midiendo la concentración de oxígeno de la sangre venosa y la sangre arterial. Q se calcula a partir de estas medidas de la siguiente manera:
- VO2 consumo por minuto utilizando un espirómetro (con el aire de retranspiración del sujeto) y un absorbente de CO2
- el contenido de oxígeno de la sangre extraída de la arteria pulmonar (representando la sangre venosa mixta)
- el contenido de oxígeno de la sangre de una cánula en una arteria periférica (representando la sangre arterial)
De estos valores, sabemos que:
- VO2=()Q× × CA)− − ()Q× × CV){displaystyle V. {O2}=(Qtimes C_{A})-(Qtimes C_{V})}
dónde
- CA es el contenido de oxígeno de la sangre arterial, y,
- CV es el contenido de oxígeno de la sangre venosa.
Esto nos permite decir
- Q=VO2CA− − CV{displaystyle Q ={frac {fnMicrosoft Sans Serif} {}} {}} {C} {C}} {C}}} {C}}} {C}}} {c}} {c}}} {}}}}}} {}}}}}}} {c}}}}}} {c}}}}} {}}} {}}}}} {}}}}}}} {}}}}}} {}} {}}}}}}}} {}}}}}} {}}}} {}}} {}}}}}}}} {}}}}}} {} {}}}}} {} {} {}}}}}}}}}}}}}} {} {}}}}}} {} {}} {} {}}} {}}}}}}}}}}}}} {} {}}}}}}}}}} {}}}}}} {}}}}}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}
y por tanto calcular Q. (CA – CV) también se conoce como diferencia arteriovenosa de oxígeno.
Aunque se considera el método más preciso para medir Q, el método Fick es invasivo y requiere tiempo para el análisis de muestras, y es difícil obtener muestras precisas de consumo de oxígeno. Ha habido modificaciones al método Fick donde el contenido de oxígeno respiratorio se mide como parte de un sistema cerrado y el oxígeno consumido se calcula utilizando un índice de consumo de oxígeno supuesto, que luego se usa para calcular Q. Otras variaciones usan gases inertes como marcadores y miden el cambio en las concentraciones de gas inspirado y espirado para calcular Q (Innocor, Innovision A/S, Dinamarca).
El cálculo del contenido de oxígeno arterial y venoso de la sangre es un proceso sencillo. Casi todo el oxígeno de la sangre está unido a las moléculas de hemoglobina de los glóbulos rojos. Medir el contenido de hemoglobina en la sangre y el porcentaje de saturación de hemoglobina (la saturación de oxígeno de la sangre) es un proceso simple y está fácilmente disponible para los médicos. Cada gramo de hemoglobina puede transportar 1,34 ml de O2; el contenido de oxígeno de la sangre, ya sea arterial o venosa, se puede estimar utilizando la siguiente fórmula:
- Contenido de oxígeno de la sangre=[haemoglobina]()g/dL)× × 1.34()mLO2/g de haemoglobina)× × saturación de sangre()porcentaje)+0,0032× × presión parcial de oxígeno()tor)################################################################################################################################################################################################################################################################
Termodilución de la arteria pulmonar (termodilución trans-corazón derecho)
El método del indicador se desarrolló aún más reemplazando el tinte indicador con fluido calentado o enfriado. Los cambios de temperatura en lugar de la concentración de tinte se miden en los sitios de la circulación; este método se conoce como termodilución. El catéter de arteria pulmonar (PAC) introducido en la práctica clínica en 1970, también conocido como catéter de Swan-Ganz, proporciona acceso directo al corazón derecho para mediciones de termodilución. La monitorización cardíaca continua e invasiva en las unidades de cuidados intensivos se ha eliminado en su mayoría. El PAC sigue siendo útil en el estudio del corazón derecho realizado en laboratorios de cateterismo cardíaco.
El PAC tiene una punta de globo y está inflado, lo que ayuda a "navegar" el globo del catéter a través del ventrículo derecho para ocluir una pequeña rama del sistema de la arteria pulmonar. Luego se desinfla el globo. El método de termodilución del PAC consiste en inyectar una pequeña cantidad (10 ml) de glucosa fría a una temperatura conocida en la arteria pulmonar y medir la temperatura a una distancia conocida de 6 a 10 cm (2,4 a 3,9 pulgadas) usando el mismo catéter con temperatura sensores separados a una distancia conocida.
El catéter multilumen de Swan-Ganz, históricamente significativo, permite el cálculo reproducible del gasto cardíaco a partir de una curva medida de tiempo y temperatura, también conocida como curva de termodilución. La tecnología de termistor permitió las observaciones de que el CO bajo registra el cambio de temperatura lentamente y el CO alto registra el cambio de temperatura rápidamente. El grado de cambio de temperatura es directamente proporcional al gasto cardíaco. En este método único, generalmente se promedian tres o cuatro mediciones o pases repetidos para mejorar la precisión. Los catéteres modernos están equipados con filamentos calefactores que se calientan de forma intermitente y miden la curva de termodilución, proporcionando mediciones Q en serie. Estos instrumentos promedian las mediciones durante 2 a 9 minutos dependiendo de la estabilidad de la circulación y, por lo tanto, no brindan un monitoreo continuo.
El uso de PAC puede complicarse con arritmias, infecciones, ruptura de la arteria pulmonar y daño a la válvula cardíaca derecha. Estudios recientes en pacientes con enfermedades críticas, sepsis, insuficiencia respiratoria aguda e insuficiencia cardíaca sugieren que el uso de la PAC no mejora los resultados de los pacientes. Esta ineficacia clínica puede estar relacionada con su escasa precisión y sensibilidad, que se han demostrado mediante la comparación con sondas de flujo en un rango de valores de Q de seis veces. El uso de PAC está en declive a medida que los médicos pasan a tecnologías menos invasivas y más precisas para monitorear la hemodinámica.
Contenido relacionado
EDE
Muerte clínica
NIH (desambiguación)






![{displaystyle CO_{text{[L/min]}}=SV_{text{[L/beat]}}times HR_{text{[beats/min]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d9758ba05f9500a4ee209f0fb42f00e150e25a75)



















![{displaystyle BSA_{mathrm {[m^{2}]} }=W_{mathrm {[kg]} }^{0.425}times H_{mathrm {[cm]} }^{0725}times 0.007184}](https://wikimedia.org/api/rest_v1/media/math/render/svg/00d2f209796a88f1509cc7ea78041537d6edfbaf)
![{displaystyle SI_{mathrm {[mL/beat/{m}^{2}]} }={frac {SV_{mathrm {[mL]} }}{BSA_{mathrm {[m^{2}]} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f7cbbb7a00e3e925bef08d46843626f3bd3a39d)
![{displaystyle CI_{mathrm {[L/min/{m}^{2}]} }={frac {CO_{mathrm {[L/min]} }}{BSA_{mathrm {[{m}^{2}]} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c0d5eea41bc4141c9a58bc2585202e3ddd2fcd36)
![{displaystyle CI_{mathrm {[L/min/{m}^{2}]} }=(SI_{mathrm {[mL/beat/{m}^{2}]} }times HR_{mathrm {[bpm]} })/1000}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82248dda9fd3023f4ebe0e5d95ef9b99d0b71612)



![{displaystyle {begin{aligned}{text{Oxygen content of blood}}&=left[{text{haemoglobin}}right]left({text{g/dL}}right) times 1.34left({text{mL}} {ce {O2}}/{text{g of haemoglobin}}right)\× {text{saturation of blood}} left({text{percent}}right) + 0.0032 times {text{partial pressure of oxygen}}left({text{torr}}right)end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eba72e33526aeb0276cf5881842334b8ad841a3d)
