Sal ácida
Las sales ácidas son una clase de sales que producen una solución ácida después de disolverse en un disolvente. Su formación como sustancia tiene una conductividad eléctrica mayor que la del disolvente puro. Durante la neutralización parcial de ácidos dipróticos o polipróticos se prepara una solución ácida formada por una sal ácida. Se produce una media-neutralización debido al resto de átomos de hidrógeno reemplazables provenientes de la disociación parcial de ácidos débiles que no han reaccionado con iones de hidróxido (OH- ) para crear moléculas de agua.
Solución ácida y ejemplos de sales ácidas
La propiedad ácido-base de la solución resultante de una reacción de neutralización depende de los productos salinos restantes. Una sal que contiene cationes reactivos sufre una hidrólisis mediante la cual reacciona con las moléculas de agua, provocando la desprotonación de los ácidos conjugados.
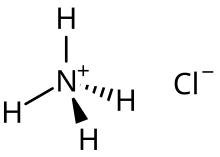
Por ejemplo, la sal ácida cloruro de amonio es la principal especie formada tras la media neutralización del amoníaco en una solución acuosa de cloruro de hidrógeno:
- NH3(aq) + HCl(aq) → [NH4]+Cl−aq)
Uso en alimentos
Las sales acidicas se utilizan a menudo en los alimentos como parte de los agentes de licencias. En este contexto, las sales ácidas se denominan "ácidos salientes". Los ácidos salientes comunes incluyen crema de tartar y fosfato monocalcio.
Una sal ácida puede mezclarse con una sal alcalí (como bicarbonato de sodio o sodio) para crear polvos de horneado que liberan dióxido de carbono. Los agentes que abandonan pueden ser de acción lenta (por ejemplo, el fosfato de aluminio sodio) que reaccionan cuando se calientan o actúan rápidamente (por ejemplo, crema de tartar) que reaccionan inmediatamente a bajas temperaturas. Los polvos de horneado de doble acción contienen agentes de licencias de acción lenta y rápida y reaccionan a bajas y altas temperaturas para proporcionar el aumento de las licencias a lo largo del proceso de horneado.
Fosfato disódico, Na2HPO4, se utiliza en alimentos y fosfato monosódico, NaH2PO4, se utiliza en pienso animal, pasta de dientes y leche evaporada.
Intensidad del ácido
Un ácido con un valor Ka más alto domina la reacción química. Sirve como un mejor contribuyente de protones (H+). Una comparación entre Ka y Kb indica la propiedad ácido-base de la solución resultante por la cual :
- La solución es ácida si Ka ■ Kb. Contiene una mayor concentración de H+ iones que concentración Oh.− iones debido a una mayor extensión de la hidrolisis de cación en comparación con la de la hidrolisis de anión.
- La solución es alkali si Ka c) Kb. Anions hydrolyze more than cations, causing an exceeding concentration of Oh.− iones.
- Se espera que la solución sea neutral sólo cuando Ka = Kb.
Otros factores posibles que pueden variar el nivel de pH de una solución son las constantes de equilibrio relevantes y las cantidades adicionales de cualquier base o ácido.
Por ejemplo, en solución de cloruro de amonio, NH+4 es la principal influencia de la solución ácida. Tiene un mayor valor Ka en comparación con el de las moléculas de agua; Ka de NH+4 es 5,6×10−10 y Kw de H2O es 1.0×10−14. Esto asegura su desprotonación al reaccionar con el agua y es responsable del pH inferior a 7 a temperatura ambiente. Cl− no tendrá afinidad por H+ ni tendencia a hidrolizarse, ya que su valor Kb es muy bajo (Kb de Cl− es 7.7×10-21).
La hidrólisis del amonio a temperatura ambiente produce:
- <math alttext="{displaystyle {ce {NH4+_{(aq)} + H2O_{(aq)} NH3_{(aq)} + H3O+_{(aq)}}}}" xmlns="http://www.w3.org/1998/Math/MathML">NH4()aq)+ +H2O()aq)↽ ↽ − − − − ⇀ ⇀ NH3()aq) +H3O()aq)+{displaystyle {ce {NH4+_{(aq)} + H2O_{(aq)} NH3_{(aq)} + H3O+_{(aq)}}}<img alt="{displaystyle {ce {NH4+_{(aq)} + H2O_{(aq)} NH3_{(aq)} + H3O+_{(aq)}}}}" aria-hidden="true" class="mwe-math-fallback-image-inline mw-invert" src="https://wikimedia.org/api/rest_v1/media/math/render/svg/9fe799bdda77eba943bdd34537df0ca81ac5c0f7" style="vertical-align: -1.505ex; width:42.124ex; height:3.843ex;"/>
- Ka=[NH3][H3O+][NH4+]=KwKb{displaystyle K_{mathrm}={frac {mathrm {[NH_{3}] [H_{3}O^{+}} }{mathrm {[NH_{4}{+}} }={frac {K_{mathrm {} {fn} {fn}}} {fn}}} {fn}}} {fn}}}}} {}}}}}} {}}}}}}} {}}}} {}}}}}}} {}}}} {}}}}} {}}} {}}}}} {}}}}}} {}}}}} {}}}}}}}}} {}}}}}}}}}} {}}}}}}}}}}}} {}}}}}}} {}}}}}}}}}}}}}}}}}}}}}} {}}}}}}}}}}} {} {}}} {}}}} {}}}}}}}}}}}}}} {}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}}} {
- Ka=[1.0× × 10− − 14][1.8× × 10− − 5]=5.6× × 10− − 10{displaystyle K_{mathrm}={frac {0times 10^{-14}}{[1.8times 10^{-5}}={5.6}times 10^{-10}



![{displaystyle K_{mathrm {a} }={frac {mathrm {[NH_{3}][H_{3}O^{+}]} }{mathrm {[NH_{4}^{+}]} }}={frac {K_{mathrm {w} }}{K_{mathrm {b} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5eac34ff25fa376268b6f116d33bf3d00ca7dfab)
![{displaystyle K_{mathrm {a} }={frac {[1.0times 10^{-14}]}{[1.8times 10^{-5}]}}={5.6}times 10^{-10}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43f0025153c13e4b649bc0ef2c4ea94caefc4c28)