RuBisCO
Ribulosa-1,5-bisfosfato carboxilasa/oxigenasa, comúnmente conocida por las siglas RuBisCo, rubisco, RuBPCase, o RuBPco, es una enzima (EC 4.1.1.39) involucrada en la parte independiente de la luz (u "oscura") de la fotosíntesis, incluida la fijación de carbono mediante la cual el carbono atmosférico El dióxido es convertido por las plantas y otros organismos fotosintéticos en moléculas ricas en energía como la glucosa. Surgió hace aproximadamente cuatro mil millones de años en el metabolismo primordial antes de la presencia de oxígeno en la tierra. Es probablemente la enzima más abundante en la Tierra. En términos químicos, cataliza la carboxilación de ribulosa-1,5-bisfosfato (también conocida como RuBP).
Vías alternativas de fijación de carbono
RuBisCO es importante desde el punto de vista biológico porque cataliza la reacción química principal por la que el carbono inorgánico entra en la biosfera. Si bien muchas bacterias autótrofas y arqueas fijan el carbono a través de la vía reductora del acetil CoA, el ciclo del 3-hidroxipropionato o el ciclo de Krebs inverso, estas vías contribuyen relativamente poco a la fijación global del carbono en comparación con la catalizada por RuBisCO. La fosfoenolpiruvato carboxilasa, a diferencia de RuBisCO, solo fija carbono temporalmente. Reflejando su importancia, RuBisCO es la proteína más abundante en las hojas, representando el 50 % de la proteína soluble de la hoja en plantas C3 (20–30 % del nitrógeno total de la hoja) y el 30 % de la proteína soluble de la hoja en plantas C4 (5–9 % de nitrógeno foliar total). Dado su importante papel en la biosfera, la ingeniería genética de RuBisCO en cultivos sigue siendo de interés (ver más abajo).
Estructura


En plantas, algas, cianobacterias y Pseudomonadota fototróficas y quimioautotróficas (anteriormente proteobacterias), la enzima suele constar de dos tipos de subunidades proteicas, denominadas cadena larga (L, unos 55 000 Da) y la cadena pequeña (S, unos 13.000 Da). El gen de cadena larga (rbcL) está codificado por el ADN del cloroplasto en las plantas. Por lo general, hay varios genes de cadena pequeña relacionados en el núcleo de las células vegetales, y las cadenas pequeñas se importan al compartimiento del estroma de los cloroplastos desde el citosol al cruzar la membrana externa del cloroplasto. Los sitios de unión del sustrato enzimáticamente activo (ribulosa 1,5-bisfosfato) están ubicados en las cadenas grandes que forman dímeros en los que los aminoácidos de cada cadena grande contribuyen a los sitios de unión. Un total de ocho cadenas grandes (= cuatro dímeros) y ocho cadenas pequeñas se ensamblan en un complejo más grande de aproximadamente 540 000 Da. En algunos Pseudomonadota y dinoflagelados, se han encontrado enzimas que consisten solo en subunidades grandes.
Los iones de magnesio (Mg2+) son necesarios para la actividad enzimática. El posicionamiento correcto de Mg2+ en el sitio activo de la enzima implica la adición de un "activador" molécula de dióxido de carbono (CO2) a una lisina en el sitio activo (formando un carbamato). Mg2+ funciona impulsando la desprotonación del residuo de Lys210, lo que hace que el residuo de Lys gire 120 grados hacia el trans confórmero, disminuyendo la distancia entre el nitrógeno de Lys y el carbono de CO2. La estrecha proximidad permite la formación de un enlace covalente, lo que da como resultado el carbamato. Mg2+ se habilita primero para unirse al sitio activo mediante la rotación de His335 a una conformación alternativa. Mg2+ es entonces coordinado por los residuos de His del sitio activo (His300, His302, His335), y es parcialmente neutralizado por la coordinación de tres moléculas de agua y su conversión a −OH. Esta coordinación da como resultado un complejo inestable, pero produce un entorno favorable para la unión de Mg2+. La formación del carbamato se ve favorecida por un pH alcalino. El pH y la concentración de iones de magnesio en el compartimento fluido (en las plantas, el estroma del cloroplasto) aumenta con la luz. El papel de cambiar el pH y los niveles de iones de magnesio en la regulación de la actividad de la enzima RuBisCO se analiza a continuación. Una vez que se forma el carbamato, His335 finaliza la activación volviendo a su posición inicial a través de la fluctuación térmica.
Actividad enzimática

RuBisCO es una de las muchas enzimas del ciclo de Calvin. Cuando Rubisco facilita el ataque de CO2 en el carbono C2 de RuBP y la ruptura del enlace posterior entre el carbono C3 y C2, Se forman 2 moléculas de glicerato-3-fosfato. La conversión implica estos pasos: enolización, carboxilación, hidratación, escisión del enlace C-C y protonación.
Sustratos
Los sustratos para RuBisCO son ribulosa-1,5-bifosfato y dióxido de carbono (diferentes del dióxido de carbono "activador"). RuBisCO también cataliza una reacción de ribulosa-1,5-bisfosfato y oxígeno molecular (O2) en lugar de dióxido de carbono (CO2). La discriminación entre los sustratos CO2 y O2 se atribuye a las diferentes interacciones del sustrato& #39;s momentos cuadripolares y un alto gradiente de campo electrostático. Este gradiente lo establece la forma de dímero de la RuBisCO mínimamente activa, que con sus dos componentes proporciona una combinación de dominios de carga opuesta necesarios para la interacción de la enzima con el estilo O2 y CO2. Estas condiciones ayudan a explicar la baja tasa de rotación que se encuentra en RuBisCO: para aumentar la fuerza del campo eléctrico necesario para una interacción suficiente con los momentos cuadrupolares de los sustratos, los segmentos C- y N-terminales de la enzima deben cerrarse, lo que permite el sitio activo a ser aislado del solvente y bajando la constante dieléctrica. Este aislamiento tiene un costo entrópico significativo y da como resultado una baja tasa de rotación.
Enlace RuBP
La carbamilación del grupo ε-amino de Lys210 se estabiliza mediante la coordinación con el Mg2+. Esta reacción implica la unión de los carboxilatos terminales de Asp203 y Glu204 al ion Mg2+. El sustrato RuBP se une a Mg2+ desplazando dos de los tres ligandos acuosos.
Enolización
La enolización de RuBP es la conversión del cetotautómero de RuBP en un enediol(ato). La enolización se inicia por desprotonación en C3. Se ha debatido la base de la enzima en este paso, pero las limitaciones estéricas observadas en las estructuras cristalinas han convertido a Lys210 en el candidato más probable. Específicamente, el carbamato de oxígeno en Lys210 que no está coordinado con el ion Mg desprotona el carbono C3 de RuBP para formar un 2,3-enodiolato.
Carboxilación

La carboxilación del 2,3-enodiolato da como resultado el intermedio 3-ceto-2-carboxiarabinitol-1,5-bisfosfato y Lys334 se posiciona para facilitar la adición del CO2 sustrato, ya que reemplaza la tercera molécula de agua coordinada con Mg2+ y agrega directamente al enodiol. En este proceso no se forma ningún complejo de Michaelis. La hidratación de esta cetona da como resultado un grupo hidroxi adicional en C3, formando un intermediario gem-diol. La carboxilación y la hidratación se han propuesto como un solo paso concertado o como dos pasos secuenciales. El mecanismo concertado está respaldado por la proximidad de la molécula de agua al C3 de RuBP en múltiples estructuras cristalinas. Dentro de la estructura de la espinaca, otros residuos están bien ubicados para ayudar en el paso de hidratación, ya que se encuentran dentro de la distancia de enlace de hidrógeno de la molécula de agua.
Escisión del enlace C-C
El intermediario gem-diol se escinde en el enlace C2-C3 para formar una molécula de glicerato-3-fosfato y un carboxilato cargado negativamente. La protonación estereoespecífica de C2 de este carbanión da como resultado otra molécula de glicerato-3-fosfato. Se cree que este paso es facilitado por Lys175 o potencialmente por Lys210 carbamilado.
Productos
Cuando el dióxido de carbono es el sustrato, el producto de la reacción de la carboxilasa es un intermediario inestable fosforilado de seis carbonos conocido como 3-ceto-2-carboxiarabinitol-1,5-bisfosfato, que se descompone rápidamente en dos moléculas de glicerato-3 -fosfato. Este producto, también conocido como 3-fosfoglicerato, se puede utilizar para producir moléculas más grandes como la glucosa.
Cuando el oxígeno molecular es el sustrato, los productos de la reacción de la oxigenasa son fosfoglicolato y 3-fosfoglicerato. El fosfoglicolato se recicla a través de una secuencia de reacciones denominada fotorrespiración, que involucra enzimas y citocromos ubicados en las mitocondrias y los peroxisomas (este es un caso de reparación de metabolitos). En este proceso, dos moléculas de fosfoglicolato se convierten en una molécula de dióxido de carbono y una molécula de 3-fosfoglicerato, que pueden volver a entrar en el ciclo de Calvin. Parte del fosfoglicolato que entra en esta vía puede ser retenido por las plantas para producir otras moléculas como la glicina. A niveles ambientales de dióxido de carbono y oxígeno, la relación de las reacciones es de aproximadamente 4 a 1, lo que da como resultado una fijación neta de dióxido de carbono de solo 3,5. Así, la incapacidad de la enzima para evitar la reacción con el oxígeno reduce en gran medida la capacidad fotosintética de muchas plantas. Algunas plantas, muchas algas y bacterias fotosintéticas han superado esta limitación al idear medios para aumentar la concentración de dióxido de carbono alrededor de la enzima, incluida la fijación de carbono C4, el metabolismo del ácido crasuláceo y el uso de pirenoide.
Las actividades secundarias de Rubisco pueden generar subproductos inútiles o inhibidores. Los subproductos inhibidores importantes incluyen xilulosa 1,5-bifosfato y glicero-2,3-pentodiulosa 1,5-bisfosfato, ambos causados por "fallos de encendido" a mitad de camino en la reacción de enolización-carboxilación. En plantas superiores, este proceso provoca la autoinhibición de RuBisCO, que puede desencadenarse al saturar las concentraciones de CO2 y RuBP y resolverse por rubisco activasa (ver más abajo).
Tasa de actividad enzimática
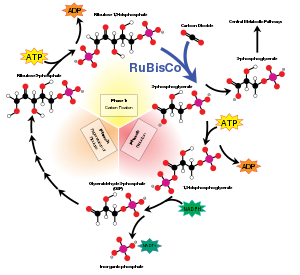
Algunas enzimas pueden llevar a cabo miles de reacciones químicas cada segundo. Sin embargo, RuBisCO es lento, ya que fija solo de 3 a 10 moléculas de dióxido de carbono por segundo por molécula de enzima. La reacción catalizada por RuBisCO es, por lo tanto, el principal factor limitante de la velocidad del ciclo de Calvin durante el día. Sin embargo, en la mayoría de las condiciones, y cuando la luz no limita la fotosíntesis, la velocidad de RuBisCO responde positivamente al aumento de la concentración de dióxido de carbono.
RuBisCO normalmente solo está activo durante el día, ya que la ribulosa 1,5-bisfosfato no se regenera en la oscuridad. Esto se debe a la regulación de varias otras enzimas en el ciclo de Calvin. Además, la actividad de RuBisCO se coordina con la de otras enzimas del ciclo de Calvin de varias otras formas:
Por iones
Al iluminar los cloroplastos, el pH del estroma aumenta de 7,0 a 8,0 debido al protón (ion de hidrógeno, H+ ) creado a través de la membrana tilacoide. El movimiento de protones hacia los tilacoides es impulsado por la luz y es fundamental para la síntesis de ATP en los cloroplastos (Lecturas adicionales: centro de reacción fotosintético; reacciones dependientes de la luz). Para equilibrar el potencial iónico a través de la membrana, los iones de magnesio (Mg2+) salen de los tilacoides en respuesta, aumentando la concentración de magnesio en el estroma de los cloroplastos. RuBisCO tiene un pH óptimo alto (puede ser >9,0, dependiendo de la concentración de iones de magnesio) y, por lo tanto, se vuelve "activado" por la introducción de dióxido de carbono y magnesio a los sitios activos como se describe anteriormente.
Por RuBisCO activasa
En plantas y algunas algas, se requiere otra enzima, RuBisCO activasa (Rca, GO:0046863, P10896), para permitir la rápida formación del carbamato crítico en el sitio activo de RuBisCO. Esto es necesario porque la ribulosa 1,5-bisfosfato (RuBP) se une con más fuerza a los sitios activos de RuBisCO cuando hay un exceso de carbamato, lo que impide que los procesos avancen. A la luz, la activasa RuBisCO promueve la liberación de RuBP inhibidora (o, en algunos puntos de vista, almacenamiento) de los sitios catalíticos de RuBisCO. La activasa también se requiere en algunas plantas (p. ej., tabaco y muchos frijoles) porque, en la oscuridad, RuBisCO es inhibida (o protegida de la hidrólisis) por un inhibidor competitivo sintetizado por estas plantas, un análogo de sustrato 2-carboxi-D-arabitinol 1- fosfato (CA1P). CA1P se une fuertemente al sitio activo de RuBisCO carbamilado e inhibe la actividad catalítica en un grado aún mayor. También se ha demostrado que CA1P mantiene a RuBisCO en una conformación que está protegida de la proteólisis. A la luz, la activasa RuBisCO también promueve la liberación de CA1P de los sitios catalíticos. Una vez que el CA1P se libera de RuBisCO, se convierte rápidamente en una forma no inhibidora mediante una fosfatasa CA1P activada por la luz. Incluso sin estos fuertes inhibidores, una vez cada varios cientos de reacciones, las reacciones normales con dióxido de carbono u oxígeno no se completan; todavía se forman otros análogos de sustrato inhibidores en el sitio activo. Una vez más, la activasa RuBisCO puede promover la liberación de estos análogos de los sitios catalíticos y mantener la enzima en una forma catalíticamente activa. Sin embargo, a altas temperaturas, la activasa RuBisCO se agrega y ya no puede activar RuBisCO. Esto contribuye a la disminución de la capacidad de carboxilación observada durante el estrés por calor.
Por activasa
La eliminación de la inhibidora RuBP, CA1P y otros análogos de sustrato inhibidores mediante la activasa requiere el consumo de ATP. Esta reacción es inhibida por la presencia de ADP y, por lo tanto, la actividad de la activasa depende de la proporción de estos compuestos en el estroma del cloroplasto. Además, en la mayoría de las plantas, la sensibilidad de la activasa a la relación ATP/ADP se modifica por el estado de reducción/oxidación del estroma (redox) a través de otra pequeña proteína reguladora, la tiorredoxina. De esta manera, la actividad de la activasa y el estado de activación de RuBisCO pueden modularse en respuesta a la intensidad de la luz y, por tanto, la tasa de formación del sustrato ribulosa 1,5-bisfosfato.
Por fosfato
En las cianobacterias, el fosfato inorgánico (Pi) también participa en la regulación coordinada de la fotosíntesis: Pi se une al sitio activo RuBisCO y a otro sitio en la cadena grande donde puede influir en las transiciones entre conformaciones activadas y menos activas de la enzima. De esta manera, la activación de la RuBisCO bacteriana podría ser particularmente sensible a los niveles de Pi, lo que podría hacer que actúe de manera similar a cómo funciona la activasa RuBisCO en las plantas superiores.
Por dióxido de carbono
Dado que el dióxido de carbono y el oxígeno compiten en el sitio activo de RuBisCO, la fijación de carbono por parte de RuBisCO puede mejorarse aumentando el nivel de dióxido de carbono en el compartimento que contiene RuBisCO (estroma de cloroplasto). Varias veces durante la evolución de las plantas, se han desarrollado mecanismos para aumentar el nivel de dióxido de carbono en el estroma (ver fijación de carbono C4). El uso de oxígeno como sustrato parece ser un proceso desconcertante, ya que parece desechar la energía capturada. Sin embargo, puede ser un mecanismo para prevenir la sobrecarga de carbohidratos durante los períodos de alto flujo de luz. Esta debilidad en la enzima es la causa de la fotorrespiración, de modo que las hojas saludables en luz brillante pueden tener una fijación neta de carbono cero cuando la proporción de O2 a CO2 disponible para que RuBisCO se desplace demasiado hacia el oxígeno. Este fenómeno depende principalmente de la temperatura: las altas temperaturas pueden disminuir la concentración de CO2 disuelto en la humedad de los tejidos de las hojas. Este fenómeno también está relacionado con el estrés hídrico: dado que las hojas de las plantas se enfrían por evaporación, la escasez de agua provoca temperaturas altas en las hojas. Las plantas C4 utilizan inicialmente la enzima PEP carboxilasa, que tiene una mayor afinidad por el CO2. El proceso primero produce un compuesto intermedio de 4 carbonos, de ahí el nombre de plantas C4, que se transporta a un sitio de fotosíntesis C3 y luego se descarboxila, liberando CO2 para aumentar la concentración de CO2.
Las plantas de metabolismo ácido de las crasuláceas (CAM) mantienen sus estomas cerrados durante el día, lo que conserva el agua pero evita que se produzcan las reacciones independientes de la luz (también conocidas como el Ciclo de Calvin), ya que estas reacciones requieren CO2 para pasar el intercambio de gases a través de estas aberturas. La evaporación a través de la parte superior de una hoja se evita mediante una capa de cera.
Ingeniería genética
Dado que RuBisCO suele limitar la velocidad de la fotosíntesis en las plantas, es posible mejorar la eficiencia fotosintética modificando los genes RuBisCO en las plantas para aumentar la actividad catalítica y/o disminuir las tasas de oxigenación. Esto podría mejorar el secuestro de CO2 y ser una estrategia para aumentar los rendimientos de los cultivos. Los enfoques bajo investigación incluyen la transferencia de genes RuBisCO de un organismo a otro organismo, la ingeniería de Rubisco activasa de cianobacterias termófilas en plantas sensibles a la temperatura, el aumento del nivel de expresión de las subunidades RuBisCO, la expresión de cadenas pequeñas RuBisCO del ADN del cloroplasto y la alteración de los genes RuBisCO para aumentar la especificidad. para el dióxido de carbono o aumentar de otro modo la tasa de fijación de carbono.
Mutagénesis en plantas
En general, la mutagénesis dirigida al sitio de RuBisCO no ha tenido éxito, aunque se han logrado formas mutadas de la proteína en plantas de tabaco con especies de subunidad C4, y una RuBisCO con más C4en el arroz a través de la transformación nuclear. Se demostró que era posible una ingeniería robusta y confiable para el rendimiento de RuBisCO y otras enzimas en el ciclo C3, y se logró por primera vez en 2019 a través de un enfoque de biología sintética.
Una vía es introducir variantes de RuBisCO con valores naturalmente altos de especificidad, como los del alga roja Galdieria partita en las plantas. Esto puede mejorar la eficiencia fotosintética de las plantas de cultivo, aunque aún no se han estudiado los posibles impactos negativos. Los avances en esta área incluyen la sustitución de la enzima del tabaco por la de la bacteria fotosintética morada Rhodospirillum rubrum. En 2014, se crearon dos líneas transplastómicas de tabaco con RuBisCO funcional de la cianobacteria Synechococcus elongatus PCC7942 (Se7942) reemplazando la RuBisCO con los genes de las subunidades grande y pequeña de la enzima Se7942, en combinación con el correspondiente La chaperona de ensamblaje Se7942, RbcX, o una proteína carboxisómica interna, CcmM35. Ambos mutantes habían aumentado las tasas de fijación de CO2 cuando se midieron como moléculas de carbono por RuBisCO. Sin embargo, las plantas mutantes crecieron más lentamente que las de tipo salvaje.
Una teoría reciente explora la compensación entre la especificidad relativa (es decir, la capacidad de favorecer la fijación de CO2 sobre incorporación de O2, que conduce al proceso de despilfarro de energía de la fotorrespiración) y la velocidad a la que se forma el producto. Los autores concluyen que RuBisCO en realidad puede haber evolucionado hasta alcanzar un punto de 'casi perfección'. en muchas plantas (con disponibilidades de sustrato y condiciones ambientales muy variables), alcanzando un compromiso entre especificidad y velocidad de reacción. También se ha sugerido que la reacción de oxigenasa de RuBisCO previene el agotamiento de CO2 cerca de sus sitios activos y proporciona el mantenimiento de la estado redox del cloroplasto.
Dado que la fotosíntesis es el regulador natural más eficaz del dióxido de carbono en la atmósfera terrestre, se utiliza un modelo bioquímico de la reacción RuBisCO como módulo central de los modelos de cambio climático. Por lo tanto, un modelo correcto de esta reacción es esencial para la comprensión básica de las relaciones e interacciones de los modelos ambientales.
Expresión en huéspedes bacterianos
Actualmente existen muy pocos métodos efectivos para expresar Rubisco vegetal funcional en huéspedes bacterianos para estudios de manipulación genética. Esto se debe en gran parte al requisito de Rubisco de maquinaria celular compleja para su biogénesis y mantenimiento metabólico, incluidas las subunidades RbcS codificadas en el núcleo, que normalmente se importan a los cloroplastos como proteínas desplegadas. Además, la expresión e interacción suficientes con la rubisco activasa también son desafíos importantes. Un método exitoso para la expresión de Rubisco en E. coli implica la coexpresión de múltiples chaperonas del cloroplasto, aunque esto solo se ha demostrado para Arabidopsis thaliana Rubisco.
Agotamiento en estudios proteómicos
Debido a su gran abundancia en las plantas (generalmente el 40 % del contenido total de proteínas), RuBisCO a menudo impide el análisis de importantes proteínas de señalización, como factores de transcripción, quinasas y proteínas reguladoras que se encuentran en menor abundancia (10-100 moléculas por célula) dentro de las plantas. Por ejemplo, el uso de espectrometría de masas en mezclas de proteínas vegetales daría como resultado múltiples picos de subunidades RuBisCO intensos que interfieren y ocultan los de otras proteínas.
Recientemente, un método eficiente para precipitar RuBisCO implica el uso de una solución de sulfato de protamina. Otros métodos existentes para agotar RuBisCO y estudiar proteínas de menor abundancia incluyen técnicas de fraccionamiento con calcio y fitato, electroforesis en gel con polietilenglicol, cromatografía de afinidad y agregación mediante DTT, aunque estos métodos consumen más tiempo y son menos eficientes en comparación con la precipitación con sulfato de protamina..
Evolución de RuBisCO
Estudios filogenéticos
Did you mean:The chloroplast gene rbc, which codes for the large subunit of RuBisCO has been widely used as an appropriate locus for analysis of phylogenetics in plant taxonomy.
Origen
Proteínas que no fijan carbono similares a RuBisCO, denominadas proteínas similares a RuBisCO (RLP), también se encuentran en la naturaleza en organismos tan comunes como Bacillus subtilis. Esta bacteria tiene una proteína similar a rbcL con una función de enolasa de 2,3-diceto-5-metiltiopentil-1-fosfato, parte de la vía de recuperación de la metionina. Identificaciones posteriores encontraron ejemplos funcionalmente divergentes dispersos por todas las bacterias y arqueas, así como enzimas de transición que realizan funciones de enolasa de tipo RLP y RuBisCO. Ahora se cree que el RuBisCO actual evolucionó a partir de un ancestro RLP dimérico, adquiriendo su función carboxilasa primero antes de seguir oligomerizando y luego reclutando la subunidad pequeña para formar la enzima moderna familiar. La subunidad pequeña probablemente evolucionó por primera vez en organismos anaeróbicos y termofílicos, donde permitió que RuBisCO catalizara su reacción a temperaturas más altas. Además de su efecto sobre la estabilización de la catálisis, permitió la evolución de especificidades más altas para CO2 sobre O2 al modular el efecto que las sustituciones dentro de RuBisCO tienen sobre la función enzimática. Las sustituciones que no tienen efecto sin la subunidad pequeña de repente se vuelven beneficiosas cuando se une. Además, la subunidad pequeña permitió la acumulación de sustituciones que solo se toleran en su presencia. La acumulación de tales sustituciones conduce a una dependencia estricta de la subunidad pequeña, que se observa en los rubiscos existentes que se unen a una subunidad pequeña.
C4
Con la evolución masiva convergente de la vía de fijación de C4 en una diversidad de linajes de plantas, el RuBisCO de tipo C3 ancestral evolucionó para tener una rotación más rápida de CO2 a cambio de menor especificidad por la mayor localización de CO2 de las células del mesófilo a las células de la vaina del haz. Esto se logró mediante la mejora de la flexibilidad conformacional de la transición "abierto-cerrado" en el ciclo de Calvin. Los estudios filogenéticos de laboratorio han demostrado que esta evolución estuvo limitada por el compromiso entre estabilidad y actividad provocado por la serie de mutaciones necesarias para C4 RuBisCO. Además, para sostener las mutaciones desestabilizadoras, la evolución a C4 RuBisCO estuvo precedida por un período en el que las mutaciones otorgaron a la enzima una mayor estabilidad, estableciendo un amortiguador para sostener y mantener las mutaciones requeridas para C4RuBisCO. Para ayudar con este proceso de amortiguación, se descubrió que la enzima recién evolucionada había desarrollado una serie de mutaciones estabilizadoras. Si bien RuBisCO siempre ha estado acumulando nuevas mutaciones, la mayoría de estas mutaciones que han sobrevivido no han tenido efectos significativos en la estabilidad de la proteína. Las mutaciones desestabilizadoras C4 en RuBisCO han sido sostenidas por presiones ambientales como el bajo CO2 concentraciones, lo que requiere un sacrificio de la estabilidad de las nuevas funciones de adaptación.
Historia del término
El término "RuBisCO" fue acuñado con humor en 1979 por David Eisenberg en un seminario en honor a la jubilación del destacado investigador de RuBisCO, Sam Wildman, y también aludió al nombre comercial de bocadillos "Nabisco" en referencia a los intentos de Wildman de crear un suplemento de proteína comestible a partir de hojas de tabaco.
La capitalización del nombre se ha debatido durante mucho tiempo. Puede escribirse en mayúscula para cada letra del nombre completo (Ribulose-1,5 bisfosfato carboxilasa/ooxigenasa), pero también se ha argumentado que todo debería estar en minúsculas (rubisco), similar a otros términos como buceo o láser.
Contenido relacionado
Donald grifo
Leptocéfalo
Bacterias verdes del azufre