Rotavirus
Rotavirus es un género de virus de ARN de doble cadena de la familia Reoviridae. Los rotavirus son la causa más común de enfermedad diarreica entre los bebés y niños pequeños. Casi todos los niños del mundo están infectados con un rotavirus al menos una vez antes de los cinco años. La inmunidad se desarrolla con cada infección, por lo que las infecciones posteriores son menos graves. Los adultos rara vez se ven afectados. Hay nueve especies del género, denominadas A, B, C, D, F, G, H, I y J. Rotavirus A, la especie más común, causa más del 90% de Infecciones por rotavirus en humanos.
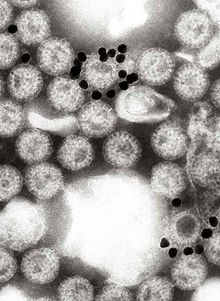
El virus se transmite por vía fecal-oral. Infecta y daña las células que recubren el intestino delgado y causa gastroenteritis (que a menudo se denomina "gripe estomacal" a pesar de no tener relación con la influenza). Aunque el rotavirus fue descubierto en 1973 por Ruth Bishop y sus colegas mediante imágenes de micrografía electrónica y representa aproximadamente un tercio de las hospitalizaciones por diarrea grave en bebés y niños, históricamente se ha subestimado su importancia dentro de la comunidad de salud pública, particularmente en los países en desarrollo. Además de su impacto en la salud humana, el rotavirus también infecta a otros animales y es un patógeno del ganado.
La enteritis por rotavirus suele ser una enfermedad infantil de fácil manejo, pero entre los niños menores de 5 años, el rotavirus causó unas 151 714 muertes por diarrea en 2019. En los Estados Unidos, antes del inicio del programa de vacunación contra el rotavirus en la década de 2000, el rotavirus causó alrededor de 2,7 millones de casos de gastroenteritis grave en niños, casi 60 000 hospitalizaciones y alrededor de 37 muertes cada año. Después de la introducción de la vacuna contra el rotavirus en los Estados Unidos, las tasas de hospitalización han disminuido significativamente. Las campañas de salud pública para combatir el rotavirus se enfocan en proporcionar terapia de rehidratación oral para niños infectados y vacunación para prevenir la enfermedad. La incidencia y la gravedad de las infecciones por rotavirus han disminuido significativamente en los países que han agregado la vacuna contra el rotavirus a sus políticas de inmunización infantil de rutina.
Virología
Tipos de rotavirus
Hay nueve especies de rotavirus, denominadas A, B, C, D, F, G, H, I y J. Los humanos están infectados principalmente por la especie Rotavirus A. Las especies A–I causan enfermedades en otros animales, las especies H en cerdos, D, F y G en aves, I en gatos y J en murciélagos.
Dentro de la especie Rotavirus A existen diferentes cepas, denominadas serotipos. Al igual que con el virus de la influenza, se utiliza un sistema de clasificación dual basado en dos proteínas en la superficie del virus. La glicoproteína VP7 define los serotipos G y la proteína VP4 sensible a la proteasa define los serotipos P. Debido a que los dos genes que determinan los tipos G y los tipos P pueden transmitirse por separado a los virus de la progenie, se encuentran diferentes combinaciones. Se ha establecido un sistema de genotipado del genoma completo para Rotavirus A, que se ha utilizado para determinar el origen de cepas atípicas. La prevalencia de los tipos G y P individuales varía entre países y años y dentro de ellos. Hay al menos 36 tipos G y 51 tipos P, pero en las infecciones de seres humanos predominan solo unas pocas combinaciones de tipos G y P. Son G1P[8], G2P[4], G3P[8], G4P[8], G9P[8] y G12P[8].
Estructura
El genoma de los rotavirus consta de 11 moléculas únicas de doble hélice de ARN (dsRNA) que son 18.555 nucleótidos en total. Cada hélice, o segmento, es un gen, numerado del 1 al 11 por tamaño decreciente. Cada gen codifica una proteína, excepto el gen 9, que codifica dos. El ARN está rodeado por una cápside proteica icosaédrica de tres capas. Las partículas virales tienen un diámetro de hasta 76,5 nm y no están envueltas.
Proteínas
Hay seis proteínas virales (VP) que forman la partícula viral (virión). Estas proteínas estructurales se denominan VP1, VP2, VP3, VP4, VP6 y VP7. Además de las VP, existen seis proteínas no estructurales (NSP), que solo se producen en células infectadas por rotavirus. Estos se denominan NSP1, NSP2, NSP3, NSP4, NSP5 y NSP6.
Al menos seis de las doce proteínas codificadas por el genoma del rotavirus se unen al ARN. El papel de estas proteínas en la replicación del rotavirus no se comprende por completo; se cree que sus funciones están relacionadas con la síntesis y el empaquetamiento del ARN en el virión, el transporte del ARNm al sitio de replicación del genoma y la traducción y regulación de la expresión génica del ARNm.
Proteínas estructurales
VP1 se encuentra en el núcleo de la partícula del virus y es una enzima ARN polimerasa dependiente de ARN. En una célula infectada, esta enzima produce transcripciones de ARNm para la síntesis de proteínas virales y produce copias de los segmentos de ARN del genoma del rotavirus para partículas de virus recién producidas.
VP2 forma la capa central del virión y se une al genoma de ARN.
VP3 es parte del núcleo interno del virión y es una enzima llamada guanilil transferasa. Esta es una enzima de protección que cataliza la formación del 5' tapa en la modificación postranscripcional del ARNm. La tapa estabiliza el ARNm viral al protegerlo de las enzimas que degradan el ácido nucleico llamadas nucleasas.
VP4 está en la superficie del virión que sobresale como una espiga. Se une a moléculas en la superficie de las células llamadas receptores e impulsa la entrada del virus en la célula. VP4 tiene que ser modificado por la enzima proteasa tripsina, que se encuentra en el intestino, en VP5* y VP8* antes de que el virus sea infeccioso. VP4 determina qué tan virulento es el virus y determina el tipo P del virus. En humanos existe una asociación entre el grupo sanguíneo (sistema de antígenos de Lewis, sistema de grupos sanguíneos ABO y estado secretor) y susceptibilidad a la infección. Los no secretores parecen resistentes a la infección por los tipos P[4] y P[8], lo que indica que los antígenos del grupo sanguíneo son los receptores de estos genotipos. Esta resistencia depende del genotipo del rotavirus.
VP6 forma la mayor parte de la cápside. Es altamente antigénico y puede usarse para identificar especies de rotavirus. Esta proteína se utiliza en pruebas de laboratorio para infecciones por rotavirus.
VP7 es una glicoproteína que forma la superficie exterior del virión. Además de sus funciones estructurales, determina el tipo G de la cepa y, junto con VP4, participa en la inmunidad a la infección.
Proteínas virales no estructurales
NSP1, el producto del gen 5, es una proteína de unión a ARN no estructural. NSP1 también bloquea la respuesta del interferón, la parte del sistema inmunitario innato que protege a las células de la infección viral. NSP1 hace que el proteosoma degrade los componentes de señalización clave necesarios para estimular la producción de interferón en una célula infectada y responder al interferón secretado por las células adyacentes.
Los objetivos para la degradación incluyen varios factores de transcripción IRF necesarios para la transcripción del gen del interferón.
NSP2 es una proteína de unión a ARN que se acumula en las inclusiones citoplasmáticas (viroplasmas) y es necesaria para la replicación del genoma.
NSP3 se une a los ARNm virales en las células infectadas y es responsable de detener la síntesis de proteínas celulares. NSP3 inactiva dos factores de iniciación de la traducción esenciales para la síntesis de proteínas a partir del ARNm del huésped.
Primero, NSP3 expulsa la proteína de unión a poli(A) (PABP) del factor de iniciación de la traducción eIF4F. Se requiere PABP para la traducción eficiente de transcripciones con un formato de 3' cola poli(A), que se encuentra en la mayoría de las transcripciones de células huésped. En segundo lugar, NSP3 inactiva eIF2 estimulando su fosforilación. Traducción eficiente del ARNm de rotavirus, que carece del 3' cola de poli(A), no requiere ninguno de estos factores.
NSP4 es una enterotoxina viral que induce diarrea y fue la primera enterotoxina viral descubierta. Es una viroporina que eleva el Ca2+ citosólico en células de mamíferos.
NSP5 está codificado por el segmento 11 del genoma del rotavirus A. En las células infectadas por virus, NSP5 se acumula en el viroplasma.
NSP6 es una proteína de unión a ácido nucleico y está codificada por el gen 11 a partir de un marco de lectura abierto fuera de fase.
| RNA Segment (Gene) | Tamaño (pantallas) | Proteína | UniProt | Peso molecular kDa | Ubicación | Copias por partícula | Función |
|---|---|---|---|---|---|---|---|
| 1 | 3302 | VP1 | P22678 | 125 | En los vértices del núcleo | 12 | Polimerasa RNA dependiente |
| 2 | 2690 | VP2 | A2T3R5 | 102 | Forma cáscara interior del núcleo | 120 | ARN vinculante |
| 3 | 2591 | VP3 | A2T3S5 | 88 | En los vértices del núcleo | 12 | enzima de capping mRNA |
| 4 | 2362 | VP4 | A2T3T2 | 87 | Surface spike | 180 | Apego celular, virulencia |
| 5 | 1611 | NSP1 | Q99FX5 | 59 | No estructural | 0 | 5'RNA vinculante, interferón antagonista |
| 6 | 1356 | VP6 | Q6LE89 | 45 | Inner Capsid | 780 | Antígeno estructural y específico de especies |
| 7 | 1104 | NSP3 | P03536 | 37 | No estructural | 0 | Mejora la actividad del MRNA viral y desactiva la síntesis de proteína celular |
| 8 | 1059 | NSP2 | A2T3P0 | 35 | No estructural | 0 | NTPase involucrado en embalaje RNA |
| 9 | 1062 | VP71 VP72 | P03533 | 38 y 34 | Superficie | 780 | Antigeno estructural y neutralizador |
| 10 | 751 | NSP4 | P04512 | 20 | No estructural | 0 | Viroporina (enterooxina) |
| 11 | 667 | NSP5 NSP6 | A2T3Q9 P11203 | 22 | No estructural | 0 | ssRNA y dsRNA modulador vinculante de NSP2, fosfoproteína |
Esta tabla se basa en la cepa SA11 del rotavirus de los simios. Las asignaciones de codificación de proteínas de ARN difieren en algunas cepas.
Replicación

- Adjunción del virus a las células anfitrionas, mediada por VP4 y VP7
- Penetración de la célula por el virus y descomposición de la capsida viral
- Más la síntesis de ssRNA (esto actúa como la síntesis de mRNA), mediada por VP1, VP3 y VP2
- Formación de la viroplasma, embalaje de ARN viral y síntesis de ARN minus y formación de las partículas de virus de doble capa
- maduración y liberación de viriones progenie
La unión del virus a la célula huésped la inicia la VP4, que se une a moléculas, llamadas glicanos, en la superficie de la célula. El virus ingresa a las células por endocitosis mediada por receptores y forma una vesícula conocida como endosoma. Las proteínas en la tercera capa (VP7 y el pico VP4) rompen la membrana del endosoma, creando una diferencia en la concentración de calcio. Esto provoca la descomposición de los trímeros de VP7 en subunidades de proteínas individuales, dejando las cubiertas de proteínas VP2 y VP6 alrededor del dsRNA viral, formando una partícula de doble capa (DLP).
Las once cadenas de dsRNA permanecen dentro de la protección de las dos cubiertas de proteínas y la ARN polimerasa dependiente de ARN viral crea transcripciones de ARNm del genoma viral de doble cadena. Al permanecer en el núcleo, el ARN viral evade las respuestas inmunitarias innatas del huésped, incluida la interferencia de ARN que se desencadena por la presencia de ARN de doble cadena.
Durante la infección, los rotavirus producen ARNm tanto para la biosíntesis de proteínas como para la replicación de genes. La mayoría de las proteínas del rotavirus se acumulan en el viroplasma, donde se replica el ARN y se ensamblan las DLP. En el viroplasma, los ARN virales de sentido positivo que se utilizan como moldes para la síntesis de ARNbc genómico viral están protegidos de la degradación de la ARNasa inducida por ARNsi. El viroplasma se forma alrededor del núcleo de la célula tan pronto como dos horas después de la infección por el virus y consiste en fábricas virales que se cree que están hechas por dos proteínas virales no estructurales: NSP5 y NSP2. La inhibición de NSP5 por interferencia de ARN in vitro da como resultado una fuerte disminución en la replicación del rotavirus. Las DLP migran al retículo endoplásmico donde obtienen su tercera capa externa (formada por VP7 y VP4). Los virus de la progenie se liberan de la célula por lisis.
Transmisión
Los rotavirus se transmiten por vía fecal-oral, a través del contacto con manos, superficies y objetos contaminados, y posiblemente por vía respiratoria. La diarrea viral es altamente contagiosa. Las heces de una persona infectada pueden contener más de 10 billones de partículas infecciosas por gramo; se requieren menos de 100 de estos para transmitir la infección a otra persona.
Los rotavirus son estables en el medio ambiente y se han encontrado en muestras de estuarios en niveles de hasta 1 a 5 partículas infecciosas por galón de EE. UU. Los virus sobreviven entre 9 y 19 días. Las medidas sanitarias adecuadas para eliminar bacterias y parásitos parecen ser ineficaces en el control del rotavirus, ya que la incidencia de la infección por rotavirus en países con altos y bajos estándares de salud es similar.
Signos y síntomas
La enteritis por rotavirus es una enfermedad de leve a grave caracterizada por náuseas, vómitos, diarrea acuosa y febrícula. Una vez que un niño se infecta con el virus, hay un período de incubación de unos dos días antes de que aparezcan los síntomas. El período de enfermedad es agudo. Los síntomas a menudo comienzan con vómitos seguidos de cuatro a ocho días de diarrea profusa. La deshidratación es más común en la infección por rotavirus que en la mayoría de las causadas por patógenos bacterianos, y es la causa más común de muerte relacionada con la infección por rotavirus.
Las infecciones por rotavirus pueden ocurrir a lo largo de la vida: la primera suele producir síntomas, pero las infecciones posteriores suelen ser leves o asintomáticas, ya que el sistema inmunitario proporciona cierta protección. En consecuencia, las tasas de infección sintomática son más altas en niños menores de dos años y disminuyen progresivamente hacia los 45 años. Los síntomas más severos tienden a ocurrir en niños de seis meses a dos años de edad, ancianos y personas con inmunodeficiencia. Debido a la inmunidad adquirida en la infancia, la mayoría de los adultos no son susceptibles al rotavirus; la gastroenteritis en adultos generalmente tiene una causa distinta al rotavirus, pero las infecciones asintomáticas en adultos pueden mantener la transmisión de la infección en la comunidad. Hay alguna evidencia que sugiere que el grupo sanguíneo puede afectar la susceptibilidad a la infección por rotavirus.
Mecanismos de la enfermedad
Los rotavirus se replican principalmente en el intestino e infectan los enterocitos de las vellosidades del intestino delgado, lo que provoca cambios estructurales y funcionales en el epitelio. Hay evidencia en humanos, y particularmente en modelos animales, de diseminación extraintestinal de virus infecciosos a otros órganos y macrófagos.
La diarrea es causada por múltiples actividades del virus. La malabsorción ocurre debido a la destrucción de las células intestinales llamadas enterocitos. La proteína tóxica del rotavirus NSP4 induce la secreción de cloruro dependiente de la edad y del ion calcio, interrumpe la reabsorción de agua mediada por el transportador SGLT1 (cotransportador de sodio/glucosa 2), aparentemente reduce la actividad de las disacaridasas de la membrana del borde en cepillo y activa la secreción secretora dependiente del ion calcio. reflejos del sistema nervioso entérico. Las concentraciones elevadas de iones de calcio en el citosol (que se requieren para el ensamblaje de los virus de la progenie) se logran mediante la acción de NSP4 como viroporina. Este aumento de los iones de calcio conduce a la autofagia (autodestrucción) de los enterocitos infectados.
También se secreta NSP4. Esta forma extracelular, que es modificada por las enzimas proteasas en el intestino, es una enterotoxina que actúa sobre las células no infectadas a través de los receptores de integrinas, que a su vez provocan y aumentan las concentraciones de iones de calcio intracelulares, diarrea secretora y autofagia.
Los vómitos, que son una característica de la enteritis por rotavirus, son causados por el virus que infecta las células enterocromafines en el revestimiento del tracto digestivo. La infección estimula la producción de 5' hidroxitriptamina (serotonina). Esto activa los nervios aferentes vagales, que a su vez activan las células del tronco encefálico que controlan el reflejo del vómito.
Los enterocitos sanos secretan lactasa en el intestino delgado; la intolerancia a la leche debido a la deficiencia de lactasa es un síntoma de infección por rotavirus, que puede persistir durante semanas. Una recurrencia de la diarrea leve a menudo sigue a la reintroducción de la leche en la dieta del niño, debido a la fermentación bacteriana del disacárido lactosa en el intestino.
Respuestas inmunitarias
Respuestas específicas
Los rotavirus provocan respuestas inmunitarias de células B y T. Los anticuerpos contra las proteínas VP4 y VP7 del rotavirus neutralizan la infectividad viral in vitro e in vivo. Se producen anticuerpos específicos de las clases IgM, IgA e IgG, que se ha demostrado que protegen contra la infección por rotavirus mediante la transferencia pasiva de los anticuerpos en otros animales. La IgG transplacentaria materna podría desempeñar un papel en la protección de los recién nacidos contra las infecciones por rotavirus, pero por otro lado podría reducir la eficacia de la vacuna.
Respuestas innatas
Después de la infección por rotavirus, se produce una respuesta inmunitaria innata rápida que implica interferones de tipo I y III y otras citocinas (en particular, Th1 y Th2) que inhiben la replicación del virus y reclutan macrófagos y células asesinas naturales para las células infectadas por rotavirus. El dsRNA del rotavirus activa los receptores de reconocimiento de patrones, como los receptores tipo toll, que estimulan la producción de interferones. La proteína de rotavirus NSP1 contrarresta los efectos de los interferones tipo 1 al suprimir la actividad de las proteínas reguladoras de interferón IRF3, IRF5 e IRF7.
Marcadores de protección
Los niveles de IgG e IgA en la sangre y de IgA en el intestino se correlacionan con la protección contra infecciones. Se ha afirmado que las IgG e IgA séricas específicas de rotavirus a títulos elevados (por ejemplo, >1:200) protegen y existe una correlación significativa entre los títulos de IgA y la eficacia de la vacuna contra el rotavirus.
Diagnóstico y detección
El diagnóstico de infección por rotavirus normalmente sigue al diagnóstico de gastroenteritis como causa de diarrea grave. A la mayoría de los niños ingresados en el hospital con gastroenteritis se les hace una prueba de rotavirus.
El diagnóstico específico de infección por rotavirus se realiza al encontrar el virus en las heces del niño mediante un inmunoensayo enzimático. Hay varios kits de prueba autorizados en el mercado que son sensibles, específicos y detectan todos los serotipos de rotavirus. Otros métodos, como la microscopía electrónica y la PCR (reacción en cadena de la polimerasa), se utilizan en los laboratorios de investigación. La reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) puede detectar e identificar todas las especies y serotipos de rotavirus humanos.
Tratamiento y pronóstico
El tratamiento de la infección aguda por rotavirus no es específico e implica el control de los síntomas y, lo que es más importante, el control de la deshidratación. Si no se tratan, los niños pueden morir a causa de la deshidratación grave resultante. Dependiendo de la gravedad de la diarrea, el tratamiento consiste en una terapia de rehidratación oral, durante la cual se le da al niño agua adicional para beber que contiene cantidades específicas de sal y azúcar. En 2004, la Organización Mundial de la Salud (OMS) y UNICEF recomendaron el uso de una solución de rehidratación oral de baja osmolaridad y suplementos de zinc como un tratamiento doble para la diarrea aguda. Algunas infecciones son lo suficientemente graves como para justificar la hospitalización donde se administran líquidos mediante terapia intravenosa o intubación nasogástrica, y se controlan los electrolitos y el azúcar en la sangre del niño. Las infecciones por rotavirus rara vez causan otras complicaciones y, para un niño bien tratado, el pronóstico es excelente. Se ha demostrado que los probióticos reducen la duración de la diarrea por rotavirus y, según la Sociedad Europea de Gastroenterología Pediátrica, "las intervenciones eficaces incluyen la administración de probióticos específicos como Lactobacillus rhamnosus o Saccharomyces boulardii, diosmectita o racecadotrilo."
Prevención
Los rotavirus son muy contagiosos y no se pueden tratar con antibióticos u otros medicamentos. Debido a que la mejora del saneamiento no disminuye la prevalencia de la enfermedad por rotavirus y la tasa de hospitalizaciones sigue siendo alta a pesar del uso de medicamentos rehidratantes orales, la principal intervención de salud pública es la vacunación. En 1998, se autorizó el uso de una vacuna contra el rotavirus en los Estados Unidos. Los ensayos clínicos en los Estados Unidos, Finlandia y Venezuela demostraron que tiene una eficacia del 80 al 100 % para prevenir la diarrea grave causada por el rotavirus A, y los investigadores no detectaron efectos adversos graves estadísticamente significativos. El fabricante, sin embargo, la retiró del mercado en 1999, luego de que se descubriera que la vacuna podría haber contribuido a un mayor riesgo de intususcepción, un tipo de obstrucción intestinal, en uno de cada 12,000 bebés vacunados. La experiencia provocó un intenso debate sobre los riesgos y beneficios relativos de una vacuna contra el rotavirus.
En 2006, dos nuevas vacunas contra la infección por rotavirus A demostraron ser seguras y eficaces en niños, y en 2009, la OMS recomendó que incluir la vacuna contra el rotavirus en todos los programas nacionales de inmunización.
La incidencia y la gravedad de las infecciones por rotavirus han disminuido significativamente en los países que han seguido esta recomendación. Una revisión de 2014 de los datos de ensayos clínicos disponibles de países que utilizan rutinariamente vacunas contra el rotavirus en sus programas nacionales de inmunización encontró que las vacunas contra el rotavirus han reducido las hospitalizaciones por rotavirus en un 49 a 92 por ciento y las hospitalizaciones por diarrea por todas las causas en un 17 a 55 por ciento. En México, que en 2006 fue uno de los primeros países del mundo en introducir la vacuna contra el rotavirus, las tasas de mortalidad por enfermedades diarreicas se redujeron durante la temporada de rotavirus de 2009 en más del 65 % entre los niños menores de dos años. En Nicaragua, que en 2006 se convirtió en el primer país en desarrollo en introducir una vacuna contra el rotavirus, las infecciones graves por rotavirus se redujeron en un 40 por ciento y las visitas a la sala de emergencias a la mitad. En los Estados Unidos, la vacunación contra el rotavirus desde 2006 ha provocado una disminución de las hospitalizaciones relacionadas con el rotavirus hasta en un 86 por ciento. Las vacunas también pueden haber prevenido enfermedades en niños no vacunados al limitar el número de infecciones circulantes. En los países en desarrollo de África y Asia, donde ocurre la mayoría de las muertes por rotavirus, una gran cantidad de ensayos de seguridad y eficacia, así como estudios recientes de impacto y eficacia posteriores a la introducción de Rotarix y RotaTeq, han encontrado que las vacunas redujeron drásticamente la enfermedad grave entre los bebés. En septiembre de 2013, la vacuna se ofreció a todos los niños del Reino Unido, con edades comprendidas entre los dos y los tres meses, y se espera que reduzca a la mitad los casos de infección grave y reduzca el número de niños hospitalizados a causa de la infección en un 70 por ciento. En Europa, las tasas de hospitalización tras la infección por rotavirus han disminuido entre un 65 % y un 84 % tras la introducción de la vacuna. A nivel mundial, la vacunación ha reducido los ingresos hospitalarios y las visitas a los servicios de urgencias en una media del 67 %.
Las vacunas contra el rotavirus están autorizadas en más de 100 países, y más de 80 países han introducido la vacunación rutinaria contra el rotavirus, casi la mitad con el apoyo de la alianza de vacunas GAVI. Para que las vacunas contra el rotavirus estén disponibles, sean accesibles y asequibles en todos los países, en particular en los países de ingresos bajos y medianos de África y Asia, donde ocurren la mayoría de las muertes por rotavirus, PATH (anteriormente Programa para Tecnología Apropiada en Salud), la OMS, los EE. UU. Los Centros para el Control y la Prevención de Enfermedades y GAVI se han asociado con instituciones de investigación y gobiernos para generar y difundir evidencia, reducir los precios y acelerar la introducción.
La vacuna puede prevenir la diabetes tipo 1.
Epidemiología
El rotavirus A, responsable de más del 90 % de las gastroenteritis por rotavirus en humanos, es endémico en todo el mundo. Cada año, los rotavirus causan millones de casos de diarrea en los países en desarrollo, casi 2 millones de los cuales resultan en hospitalización. En 2019, aproximadamente 151 714 niños menores de cinco años murieron a causa de infecciones por rotavirus, el 90 % de los cuales se encontraban en países en desarrollo. Casi todos los niños han sido infectados con rotavirus a la edad de cinco años. Los rotavirus son la principal causa individual de diarrea grave entre lactantes y niños, son responsables de aproximadamente un tercio de los casos que requieren hospitalización y causan el 37 % de las muertes atribuibles a la diarrea y el 5 % de todas las muertes en niños menores de cinco años. Los niños tienen el doble de probabilidades que las niñas de ser hospitalizados por infecciones por rotavirus. En la era previa a la vacunación, las infecciones por rotavirus ocurrían principalmente durante las estaciones frías y secas. Se desconoce el número atribuible a la contaminación de los alimentos.
Los brotes de diarrea por rotavirus A son comunes entre los bebés hospitalizados, los niños pequeños que asisten a guarderías y las personas mayores en hogares de ancianos. Un brote causado por agua municipal contaminada ocurrió en Colorado en 1981. Durante 2005, la mayor epidemia registrada de diarrea ocurrió en Nicaragua. Este brote inusualmente grande y grave se asoció con mutaciones en el genoma del rotavirus A, lo que posiblemente ayudó al virus a escapar de la inmunidad predominante en la población. Un gran brote similar ocurrió en Brasil en 1977.
El rotavirus B, también llamado rotavirus de la diarrea del adulto o ADRV, ha causado grandes epidemias de diarrea grave que afectan a miles de personas de todas las edades en China. Estas epidemias ocurrieron como resultado de la contaminación del agua potable por aguas residuales. Las infecciones por rotavirus B también ocurrieron en India en 1998; la cepa causante se denominó CAL. A diferencia de ADRV, la cepa CAL es endémica. Hasta la fecha, las epidemias causadas por rotavirus B se han limitado a China continental, y las encuestas indican una falta de inmunidad a esta especie en los Estados Unidos. El rotavirus C se ha asociado con casos raros y esporádicos de diarrea en niños, y se han producido pequeños brotes en familias.
Otros animales
Los rotavirus infectan a las crías de muchas especies de animales y son una de las principales causas de diarrea en animales salvajes y criados en todo el mundo. Como patógeno del ganado, especialmente en terneros jóvenes y lechones, los rotavirus causan pérdidas económicas a los ganaderos debido a los costos del tratamiento asociados con las altas tasas de morbilidad y mortalidad. Estos rotavirus son un reservorio potencial para el intercambio genético con los rotavirus humanos. Existe evidencia de que los rotavirus animales pueden infectar a los humanos, ya sea por transmisión directa del virus o mediante la contribución de uno o varios segmentos de ARN a los reordenamientos con cepas humanas.
Historia
En 1943, Jacob Light y Horace Hodes demostraron que un agente filtrable en las heces de los niños con diarrea infecciosa también causaba diarrea (diarrea del ganado) en el ganado. Tres décadas después, se demostró que las muestras conservadas del agente eran rotavirus. En los años intermedios, se demostró que un virus en ratones estaba relacionado con el virus que causaba la diarrea. En 1973, Ruth Bishop y sus colegas describieron virus relacionados encontrados en niños con gastroenteritis.
En 1974, Thomas Henry Flewett sugirió el nombre rotavirus después de observar que, cuando se observa a través de un microscopio electrónico, una partícula de rotavirus parece una rueda ( rota en latín) el nombre fue reconocido oficialmente por el Comité Internacional de Taxonomía de Virus cuatro años después. En 1976, se describieron virus relacionados en varias otras especies de animales. Estos virus, todos causantes de gastroenteritis aguda, fueron reconocidos como un patógeno colectivo que afecta a humanos y otros animales en todo el mundo. Los serotipos de rotavirus se describieron por primera vez en 1980 y, al año siguiente, los rotavirus humanos se desarrollaron por primera vez en cultivos celulares derivados de riñones de mono, al agregarles tripsina (una enzima que se encuentra en el duodeno de los mamíferos y que ahora se sabe que es esencial para que el rotavirus se replique).) al medio de cultivo. La capacidad de cultivar rotavirus en cultivo aceleró el ritmo de la investigación y, a mediados de la década de 1980, se estaban evaluando las primeras vacunas candidatas.
Contenido relacionado
Bocio endémico
Senil (desambiguación)
Lesión craneal



![The seasonal variation of rotavirus A infections in England: rates of infection peak during the winter months.[143]](https://upload.wikimedia.org/wikipedia/commons/thumb/4/4e/Rotavirus_seasonal_distribution.png/650px-Rotavirus_seasonal_distribution.png)
![Preventable child deaths from rotavirus vaccination, 2016. Annual number of preventable deaths in children under five years old from rotavirus if full coverage of the rotavirus vaccine was achieved.[144]](https://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Avertable-deaths-from-rotavirus-with-full-vaccine-coverage.png/650px-Avertable-deaths-from-rotavirus-with-full-vaccine-coverage.png)
