Respuesta de células B policlonales

La respuesta de las células B policlonales es un modo natural de respuesta inmunitaria que exhibe el sistema inmunitario adaptativo de los mamíferos. Garantiza que un único antígeno sea reconocido y atacado a través de sus partes superpuestas, llamadas epítopos, por múltiples clones de células B.
En el curso de una respuesta inmunitaria normal, el sistema inmunitario reconoce partes de los patógenos (por ejemplo, las bacterias) como extrañas (no propias) y las elimina o neutraliza de manera eficaz para reducir su daño potencial. Esa sustancia reconocible se denomina antígeno. El sistema inmunitario puede responder de múltiples maneras a un antígeno; una característica clave de esta respuesta es la producción de anticuerpos por parte de las células B (o linfocitos B) que involucran una rama del sistema inmunitario conocida como inmunidad humoral. Los anticuerpos son solubles y no requieren contacto directo de célula a célula entre el patógeno y la célula B para funcionar.
Los antígenos pueden ser sustancias grandes y complejas, y cualquier anticuerpo individual sólo puede unirse a una zona pequeña y específica del antígeno. En consecuencia, una respuesta inmunitaria eficaz a menudo implica la producción de muchos anticuerpos diferentes por parte de muchas células B diferentes contra el mismo antígeno. De ahí el término "policlonal", que deriva de las palabras poli, que significa muchos, y clones del griego klōn, que significa brote o ramita; un clon es un grupo de células que surgen de una célula "madre" común. Los anticuerpos así producidos en una respuesta policlonal se conocen como anticuerpos policlonales. Los anticuerpos policlonales heterogéneos son distintos de las moléculas de anticuerpos monoclonales, que son idénticas y reaccionan sólo contra un único epítopo, es decir, son más específicos.
Aunque la respuesta policlonal confiere ventajas al sistema inmune, en particular, mayor probabilidad de reaccionar contra patógenos, también aumenta las posibilidades de desarrollar ciertas enfermedades autoinmunes resultantes de la reacción del sistema inmune contra moléculas nativas producidas dentro del huésped.
Respuesta inmoral a la infección
Las enfermedades que pueden transmitirse de un organismo a otro se conocen como enfermedades infecciosas, y el agente biológico causal involucrado se conoce como patógeno. El proceso por el cual el patógeno se introduce en el cuerpo se conoce como inoculación, y el organismo al que afecta se conoce como huésped biológico. Cuando el patógeno se establece en un paso conocido como colonización, puede dar lugar a una infección, dañando en consecuencia al huésped directamente o a través de las sustancias nocivas llamadas toxinas que puede producir. Esto da lugar a los diversos síntomas y signos característicos de una enfermedad infecciosa como la neumonía o la difteria.
La lucha contra las diversas enfermedades infecciosas es muy importante para la supervivencia del organismo susceptible, en particular, y de la especie, en general. Esto lo consigue el huésped eliminando el patógeno y sus toxinas o dejándolos inoperantes. El conjunto de diversas células, tejidos y órganos que se especializa en proteger al cuerpo contra las infecciones se conoce como sistema inmunitario. El sistema inmunitario logra esto mediante el contacto directo de ciertos glóbulos blancos con el patógeno invasor, lo que implica una rama del sistema inmunitario conocida como inmunidad celular, o mediante la producción de sustancias que se desplazan a sitios distantes de donde se producen, "buscan" las células y toxinas causantes de la enfermedad uniéndose específicamente a ellas y las neutralizan en el proceso (conocido como el brazo humoral del sistema inmunitario). Estas sustancias se conocen como anticuerpos solubles y desempeñan funciones importantes para contrarrestar las infecciones.
- Tipos de glóbulos blancos (WBCs)
- Neutrophil
- Eosinophil
- Basófilo
- Linfocito
- Monocyte
- Macrophage
B cell response

Los anticuerpos cumplen diversas funciones para proteger al huésped contra el patógeno. Las formas solubles que llevan a cabo estas funciones son producidas por las células B plasmáticas, un tipo de glóbulo blanco. Esta producción está estrictamente regulada y requiere la activación de las células B por parte de las células T activadas (otro tipo de glóbulo blanco), lo que es un procedimiento secuencial. Los principales pasos implicados son:
- Reconocimiento específico o no específico del patógeno (por sus antígenos) con su posterior engullido por células B o macrófagos. Esto sólo activa la célula B parcialmente.
- Procesamiento de antígeno.
- Presentación del antígeno.
- Activación de las células de ayuda T por células que representan el antígeno.
- Co-estimulación de la célula B por activado T cell resulting in its completo activación.
- Proliferación de células B con producción resultante de anticuerpos solubles.

Reconocimiento de patógenos
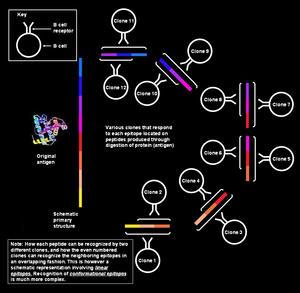
Reconocimiento específico de epitope por células B

En la figura de la izquierda, se ha demostrado que los distintos segmentos que forman el epítopo son continuamente colineales, lo que significa que se han mostrado como secuenciales; sin embargo, para la situación que se analiza aquí (es decir, el reconocimiento del antígeno por parte de la célula B), esta explicación es demasiado simplista. Dichos epítopos se conocen como secuenciales o lineales, ya que todos los aminoácidos que los componen están en la misma secuencia (línea). Este modo de reconocimiento es posible solo cuando el péptido es pequeño (de unos seis a ocho aminoácidos de longitud) y lo emplean las células T (linfocitos T).
Sin embargo, las células B de memoria/naive reconocen las proteínas intactas presentes en la superficie del patógeno. En esta situación, la proteína en su estructura terciaria está tan plegada que algunos bucles de aminoácidos llegan a estar en el interior de la proteína, y los segmentos que los flanquean pueden estar en la superficie. El paratopo en el receptor de la célula B entra en contacto sólo con aquellos aminoácidos que se encuentran en la superficie de la proteína. Los aminoácidos de la superficie pueden ser en realidad discontinuos en la estructura primaria de la proteína, pero se yuxtaponen debido a los complejos patrones de plegamiento de la proteína (como en la figura adjunta). Estos epítopos se conocen como epítopos conformacionales y tienden a ser más largos (15–22 residuos de aminoácidos) que los epítopos lineales. Del mismo modo, los anticuerpos producidos por las células plasmáticas que pertenecen al mismo clon se unirían a los mismos epítopos conformacionales en las proteínas del patógeno.
La unión de un antígeno específico con las moléculas BCR correspondientes da como resultado una mayor producción de moléculas MHC-II. Esto adquiere importancia, ya que no sucede lo mismo cuando el mismo antígeno se internaliza mediante un proceso relativamente inespecífico llamado pinocitosis, en el que el antígeno con el líquido circundante es "bebido" en forma de una pequeña vesícula por la célula B. Por lo tanto, un antígeno de este tipo se conoce como un antígeno inespecífico y no conduce a la activación de la célula B ni a la posterior producción de anticuerpos contra ella.
Reconocimiento no específico por macrófagos
Los macrófagos y las células relacionadas emplean un mecanismo diferente para reconocer al patógeno. Sus receptores reconocen ciertos motivos presentes en el patógeno invasor que es muy poco probable que estén presentes en una célula huésped. Estos motivos repetitivos son reconocidos por los receptores de reconocimiento de patrones (PRR), como los receptores tipo Toll (TLR) expresados por los macrófagos. Dado que el mismo receptor podría unirse a un motivo determinado presente en superficies de microorganismos muy dispares, este modo de reconocimiento es relativamente inespecífico y constituye una respuesta inmunitaria innata.
Procesamiento de antígenos

Después de reconocer un antígeno, una célula presentadora de antígenos, como el macrófago o el linfocito B, lo engulle por completo mediante un proceso llamado fagocitosis. La partícula engullida, junto con algún material que la rodea, forma la vesícula endocítica (el fagosoma), que se fusiona con los lisosomas. Dentro del lisosoma, el antígeno se descompone en fragmentos más pequeños llamados péptidos por acción de las proteasas (enzimas que degradan proteínas más grandes). Luego, los péptidos individuales forman complejos con moléculas del complejo mayor de histocompatibilidad de clase II (CMH de clase II) ubicadas en el lisosoma; este método de "manipulación" del antígeno se conoce como la vía exógena o endocítica del procesamiento de antígenos, en contraste con la vía endógena o citosólica, que forma complejos con las proteínas anormales producidas dentro de la célula (por ejemplo, bajo la influencia de una infección viral o en una célula tumoral) con moléculas del CMH de clase I.
También se ha demostrado una vía alternativa de procesamiento endocítico en la que ciertas proteínas, como el fibrinógeno y la mioglobina, pueden unirse en conjunto a las moléculas MHC-II después de que se desnaturalizan y sus enlaces disulfuro se reducen (rompiendo el enlace mediante la adición de átomos de hidrógeno a través de él). Las proteasas luego degradan las regiones expuestas del complejo proteína-MHC II.
Presentación del antígeno
Después de que el antígeno procesado (péptido) se une a la molécula MHC, ambos migran juntos a la membrana celular, donde se exhiben (elaboran) como un complejo que puede ser reconocido por el CD4+ (célula T colaboradora), un tipo de glóbulo blanco. Esto se conoce como presentación de antígenos. Sin embargo, los epítopos (epítopos conformacionales) que son reconocidos por la célula B antes de su digestión pueden no ser los mismos que los presentados a la célula T colaboradora. Además, una célula B puede presentar diferentes péptidos combinados con diferentes moléculas MHC-II.
Estimulación de células de ayuda
Las células CD4+ a través de su complejo receptor de células T-CD3 reconocen las moléculas MHC II unidas al epítopo en la superficie de las células presentadoras de antígenos y se "activan". Tras esta activación, estas células T proliferan y se diferencian en células Th1 o Th2. Esto hace que produzcan señales químicas solubles que promueven su propia supervivencia. Sin embargo, otra función importante que llevan a cabo es la estimulación de las células B estableciendo contacto físico directo con ellas.
Co-estimulación de células B por célula de ayuda activada T
La estimulación completa de las células T colaboradoras requiere que la molécula B7 presente en la célula presentadora de antígeno se una a la molécula CD28 presente en la superficie de la célula T (muy cerca del receptor de la célula T). Asimismo, también es necesaria una segunda interacción entre el ligando CD40 o CD154 (CD40L) presente en la superficie de la célula T y el CD40 presente en la superficie de la célula B. Las mismas interacciones que estimulan a la célula T colaboradora también estimulan a la célula B, de ahí el término coestimulación. El mecanismo completo asegura que una célula T activada solo estimule a una célula B que reconozca el antígeno que contiene el mismo epítopo que reconoce el receptor de células T de la célula T colaboradora "coestimulante". La célula B se estimula, además de la coestimulación directa, por ciertos factores de crecimiento, a saber, las interleucinas 2, 4, 5 y 6 de manera paracrina. Estos factores suelen ser producidos por la célula T colaboradora recién activada. Sin embargo, esta activación ocurre sólo después de que el receptor de células B presente en una célula B de memoria o ingenua se hubiera unido al epítopo correspondiente, sin el cual no se habrían producido los pasos iniciales de la fagocitosis y el procesamiento del antígeno.
Proliferación y diferenciación de células B
Una célula B ingenua (o inexperta) es aquella que pertenece a un clon que nunca ha encontrado el epítopo al que es específica. Por el contrario, una célula B de memoria es aquella que deriva de una célula B ingenua o de memoria activada. La activación de una célula B ingenua o de memoria es seguida por una proliferación múltiple de esa célula B en particular, la mayor parte de cuya progenie se diferencia terminalmente en células B plasmáticas; el resto sobrevive como células B de memoria. Por lo tanto, cuando las células ingenuas que pertenecen a un clon particular encuentran su antígeno específico para dar lugar a las células plasmáticas, y también dejan unas pocas células de memoria, esto se conoce como la respuesta inmunitaria primaria. En el curso de la proliferación de este clon, los genes del receptor de células B pueden sufrir mutaciones frecuentes (una de cada dos divisiones celulares) en los genes que codifican paratopos de anticuerpos. Estas mutaciones frecuentes se denominan hipermutación somática. Cada una de estas mutaciones altera ligeramente la capacidad de unión del paratopo a los epítopos, creando nuevos clones de células B en el proceso. Algunos de los paratopos recién creados se unen con más fuerza al mismo epítopo (lo que lleva a la selección de los clones que los poseen), lo que se conoce como maduración de la afinidad. Otros paratopos se unen mejor a epítopos que son ligeramente diferentes del epítopo original que había estimulado la proliferación. Las variaciones en la estructura del epítopo también suelen producirse por mutaciones en los genes del patógeno que codifican su antígeno. La hipermutación somática, por tanto, hace que los receptores de las células B y los anticuerpos solubles en encuentros posteriores con antígenos, sean más inclusivos en su potencial de reconocimiento de antígenos de epítopos alterados, además de otorgar una mayor especificidad para el antígeno que indujo la proliferación en primer lugar. Cuando las células de memoria son estimuladas por el antígeno para producir células plasmáticas (como en la respuesta primaria del clon), y dejan aún más células de memoria en el proceso, esto se conoce como una respuesta inmunitaria secundaria, que se traduce en una mayor cantidad de células plasmáticas y una tasa más rápida de producción de anticuerpos que dura más tiempo. Las células B de memoria producidas como parte de la respuesta secundaria reconocen el antígeno correspondiente más rápido y se unen con más fuerza a él (es decir, mayor afinidad de unión) debido a la maduración de la afinidad. Los anticuerpos solubles producidos por el clon muestran una mejora similar en la unión al antígeno.
Base de policlonalidad
Las respuestas son de naturaleza policlonal, ya que cada clon se especializa de alguna manera en producir anticuerpos contra un epítopo determinado y porque cada antígeno contiene múltiples epítopos, cada uno de los cuales a su vez puede ser reconocido por más de un clon de células B. Para poder reaccionar ante innumerables antígenos, así como ante múltiples epítopos constituyentes, el sistema inmunológico requiere la capacidad de reconocer una gran cantidad de epítopos en total, es decir, debe haber una gran diversidad de clones de células B.
Clonality of B cells
Las células B de memoria y las células B ingenuas normalmente existen en cantidades relativamente pequeñas. Como el cuerpo necesita poder responder a una gran cantidad de patógenos potenciales, mantiene un grupo de células B con una amplia gama de especificidades. En consecuencia, si bien casi siempre hay al menos una célula B (ingenua o de memoria) capaz de responder a cualquier epítopo dado (de todos los que el sistema inmunológico puede combatir), hay muy pocos duplicados exactos. Sin embargo, cuando una sola célula B encuentra un antígeno al que puede unirse, puede proliferar muy rápidamente. Un grupo de células de este tipo con idéntica especificidad hacia el epítopo se conoce como un clon, y deriva de una célula "madre" común. Todas las células B "hijas" coinciden con la célula "madre" original en su especificidad de epítopo, y secretan anticuerpos con parátopos idénticos. Estos anticuerpos son anticuerpos monoclonales, ya que derivan de clones de la misma célula progenitora. Una respuesta policlonal es aquella en la que clones de múltiples células B reaccionan al mismo antígeno.
El antígeno único contiene múltiples epítopos superpuestos

Un único antígeno puede considerarse como una secuencia de múltiples epítopos superpuestos. Muchos clones de células B únicos pueden unirse a los epítopos individuales. Esto imparte una multiplicidad aún mayor a la respuesta general. Todas estas células B pueden activarse y producir grandes colonias de clones de células plasmáticas, cada una de las cuales puede secretar hasta 1000 moléculas de anticuerpos contra cada epítopo por segundo.
Múltiples clones reconocen una sola epitope
Además de que diferentes células B reaccionan a diferentes epítopos en el mismo antígeno, las células B que pertenecen a diferentes clones también pueden reaccionar al mismo epítopo. Se dice que un epítopo que puede ser atacado por muchas células B diferentes es altamente inmunogénico. En estos casos, las afinidades de unión para los respectivos pares epítopo-parátopo varían, ya que algunos clones de células B producen anticuerpos que se unen fuertemente al epítopo y otros producen anticuerpos que se unen débilmente.
Selección clonal
Los clones que se unen a un epítopo particular con mayor fuerza tienen más probabilidades de ser seleccionados para una mayor proliferación en los centros germinales de los folículos en diversos tejidos linfoides como los ganglios linfáticos. Esto no es muy diferente de la selección natural: los clones son seleccionados por su aptitud para atacar los epítopos (fuerza de unión) del patógeno encontrado. Lo que hace que la analogía sea aún más fuerte es que los linfocitos B tienen que competir entre sí por las señales que promueven su supervivencia en los centros germinales.
Diversidad de clones de células B
Aunque existen muchos patógenos diferentes, muchos de los cuales están en constante mutación, es sorprendente que la mayoría de las personas permanezcan libres de infecciones. Por lo tanto, el mantenimiento de la salud requiere que el cuerpo reconozca todos los patógenos (antígenos que presentan o producen) que probablemente existan. Esto se logra manteniendo un grupo inmensamente grande (alrededor de 109) clones de células B, cada uno de los cuales reacciona contra un epítopo específico al reconocerlo y producir anticuerpos contra él. Sin embargo, en un momento dado, muy pocos clones permanecen realmente receptivos a su epítopo específico. Por lo tanto, aproximadamente 107 epítopos diferentes pueden ser reconocidos por todos los clones de células B combinados. Además, a lo largo de la vida, un individuo generalmente requiere la generación de anticuerpos contra muy pocos antígenos en comparación con la cantidad que el cuerpo puede reconocer y contra los que puede responder.
Significado del fenómeno
Mayor probabilidad de reconocer cualquier antígeno
Si un antígeno puede ser reconocido por más de un componente de su estructura, es menos probable que el sistema inmunológico lo "pase por alto". La mutación de organismos patógenos puede provocar la modificación de la estructura del antígeno y, por lo tanto, del epítopo. Si el sistema inmunológico "recuerda" cómo son los otros epítopos, el antígeno y el organismo seguirán siendo reconocidos y sujetos a la respuesta inmunológica del cuerpo. Por lo tanto, la respuesta policlonal amplía la gama de patógenos que pueden reconocerse.
Limitación del sistema inmunitario contra virus que mutan rápidamente
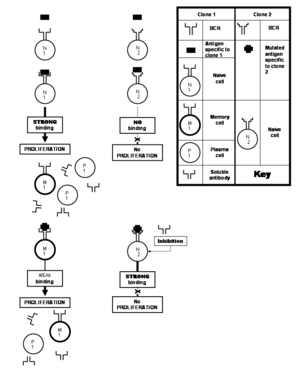
Muchos virus sufren mutaciones frecuentes que dan lugar a cambios en la composición de aminoácidos de sus proteínas importantes. Los epítopos ubicados en la proteína también pueden sufrir alteraciones en el proceso. Un epítopo alterado de este tipo se une con menos fuerza a los anticuerpos específicos del epítopo inalterado que habrían estimulado el sistema inmunológico. Esto es desafortunado porque la hipermutación somática da lugar a clones capaces de producir anticuerpos solubles que se habrían unido al epítopo alterado con suficiente avidez para neutralizarlo. Pero estos clones consistirían en células vírgenes a las que los anticuerpos de unión débil producidos por el clon previamente estimulado no les permiten proliferar. Esta doctrina se conoce como el pecado antigénico original. Este fenómeno entra en juego particularmente en las respuestas inmunológicas contra los virus de la gripe, el dengue y el VIH. Esta limitación, sin embargo, no está impuesta por el fenómeno de la respuesta policlonal, sino más bien, en contra de él, por una respuesta inmune que está sesgada a favor de las células de memoria experimentadas en contra de las células ingenuas "novatas".
Aumento de las posibilidades de reacciones autoinmunes
En la autoinmunidad, el sistema inmunitario reconoce erróneamente ciertas moléculas nativas del cuerpo como extrañas (antígenos propios) y desencadena una respuesta inmunitaria contra ellas. Dado que estas moléculas nativas, como partes normales del cuerpo, siempre existirán naturalmente en el cuerpo, los ataques contra ellas pueden volverse más fuertes con el tiempo (similar a la respuesta inmunitaria secundaria). Además, muchos organismos presentan mimetismo molecular, que implica mostrar en su superficie aquellos antígenos que son antigénicamente similares a las proteínas del huésped. Esto tiene dos posibles consecuencias: en primer lugar, el organismo se mantendrá como antígeno propio; o en segundo lugar, los anticuerpos producidos contra él también se unirán a las proteínas nativas imitadas. Los anticuerpos atacarán a los antígenos propios y a los tejidos que los albergan activando varios mecanismos como la activación del complemento y la citotoxicidad mediada por células dependiente de anticuerpos. Por lo tanto, cuanto más amplia sea la gama de especificidades de los anticuerpos, mayor será la probabilidad de que uno u otro reaccione contra los antígenos propios (moléculas nativas del cuerpo).
Dificultad para producir anticuerpos monoclonales
Los anticuerpos monoclonales son moléculas de inmunoglobulina estructuralmente idénticas con una especificidad epitópica idéntica (todas ellas se unen al mismo epítopo con la misma afinidad) en comparación con sus contrapartes policlonales que tienen afinidades variables por el mismo epítopo. Normalmente no se producen en una respuesta inmune natural, sino solo en estados patológicos como el mieloma múltiple o mediante técnicas de laboratorio especializadas. Debido a su especificidad, los anticuerpos monoclonales se utilizan en ciertas aplicaciones para cuantificar o detectar la presencia de sustancias (que actúan como antígenos para los anticuerpos monoclonales) y para dirigirse a células individuales (por ejemplo, células cancerosas). Los anticuerpos monoclonales se utilizan en diversas modalidades de diagnóstico (ver: transferencia Western e inmunofluorescencia) y terapias, particularmente del cáncer y enfermedades con componentes autoinmunes. Pero, dado que prácticamente todas las respuestas en la naturaleza son policlonales, la producción de anticuerpos monoclonales inmensamente útiles es menos sencilla.
Historia
La primera evidencia de la presencia de una sustancia neutralizante en la sangre que podía contrarrestar las infecciones se produjo cuando Emil von Behring y Kitasato Shibasaburō desarrollaron en 1890 un suero eficaz contra la difteria. Para ello, transfirieron el suero producido a partir de animales inmunizados contra la difteria a animales que la padecían. De esta forma, la transferencia del suero podía curar a los animales infectados. Behring recibió el Premio Nobel por este trabajo en 1901.
En esa época, sin embargo, no se conocía exactamente la naturaleza química de lo que en la sangre confería esta protección. En unas décadas, se demostró que el suero protector podía neutralizar y precipitar toxinas y agrupar bacterias. Todas estas funciones se atribuyeron a diferentes sustancias del suero y se denominaron en consecuencia antitoxina, precipitina y aglutinina. En 1939, Elvin A. Kabat demostró que las tres sustancias eran una sola entidad (gammaglobulinas). El año anterior, Kabat había demostrado la heterogeneidad de los anticuerpos mediante estudios de ultracentrifugación de sueros de caballos.
Hasta ese momento, la inmunidad celular y la inmunidad humoral se consideraban teorías rivales para explicar la respuesta inmunitaria eficaz, pero la primera se quedó atrás debido a la falta de técnicas avanzadas. La inmunidad celular cobró impulso en su reconocimiento y estudio cuando en 1942, Merrill Chase logró transferir inmunidad contra la tuberculosis entre cerdos mediante la transferencia de glóbulos blancos.
Más tarde, en 1948, Astrid Fagraeus demostró en su tesis doctoral que las células B plasmáticas están específicamente implicadas en la producción de anticuerpos. El papel de los linfocitos en la mediación de las respuestas humorales y celulares fue demostrado por James Gowans en 1959.
Para explicar la amplia gama de antígenos que el sistema inmunológico puede reconocer, Paul Ehrlich había planteado en 1900 la hipótesis de que los "receptores de cadena lateral" preexistentes se unen a un patógeno determinado y que esta interacción induce a la célula que exhibe el receptor a multiplicarse y producir más copias del mismo receptor. Esta teoría, llamada teoría selectiva, no se demostró hasta las cinco décadas siguientes y había sido cuestionada por varias teorías instructivas que se basaban en la idea de que un anticuerpo asumiría su estructura efectiva al plegarse alrededor del antígeno. Sin embargo, a fines de la década de 1950, los trabajos de tres científicos -Jerne, Talmage y Burnet (que modificaron en gran medida la teoría)- dieron lugar a la teoría de la selección clonal, que demostró todos los elementos de la hipótesis de Ehrlich, excepto que los receptores específicos que podían neutralizar el agente eran solubles y no estaban unidos a la membrana.
La teoría de la selección clonal resultó correcta cuando Sir Gustav Nossal demostró que cada célula B siempre produce sólo un anticuerpo.
En 1974, Rolf Zinkernagel y Peter C. Doherty demostraron el papel del MHC en la presentación de antígenos.
Véase también
- Anticuerpos policlonales
- Procesamiento de antígenos
- Antisuero, una preparación anticuerpo policlonal utilizada para tratar la envenomización
Notas
- ^ El término "inoculación" generalmente se utiliza en el contexto de la inmunización activa, es decir, introduciendo deliberadamente la sustancia antígena en el cuerpo del huésped. Pero en muchas discusiones sobre enfermedades infecciosas, no es raro utilizar el término para implicar un evento espontáneo (es decir, sin intervención humana) que resulte en la introducción del organismo causante en el cuerpo, dicen ingerir agua contaminada con el tipofi de Salmonella, el organismo causante de fiebre tifoidea. En tales casos el organismo causante se conoce como el inoculum, y el número de organismos introducidos como "la dosis del inoculum".
- ^ Especificación implica que dos patógenos diferentes serán realmente vistos como dos entidades distintas, y contrarrestados por diferentes moléculas anticuerpos.
- ^ Acciones de anticuerpos:
- Coating the pathogen, preventing it from adhereng to the host cell, and thus preventing colonization
- Precipitando (haciendo que las partículas "sink" se adhieren a ellas) los antígenos solubles y promoviendo su limpieza por otras células del sistema inmunitario de los diversos tejidos y sangre
- Coating the microorganisms to attract cells that can engulf the pathogen. Esto se conoce como opsonización. Así el anticuerpo actúa como un opsonin. El proceso de envolvimiento se conoce como fagocitosis (literalmente, celular comiendo)
- Activando el sistema de complementos, que más importantemente hace agujeros en la cubierta exterior del patógeno (su membrana celular), matándolo en el proceso
- Marcar las células anfitrionas infectadas por virus para la destrucción en un proceso conocido como citotoxicidad mediada por células anticuerpos (ADCC)
- ^ La proliferación en este contexto significa multiplicación por división celular y diferenciación
- ^ El mayor complejo de histocompatibilidad es una región de genes en el ADN que codifica para la síntesis de la molécula I de la clase de histocompatibilidad Mayor, molécula de la clase II de histocompatibilidad mayor y otras proteínas implicadas en la función del sistema de complementos (clase III de la MHC). Los dos primeros productos son importantes en la presentación del antígeno. La compatibilidad con MHC es una consideración importante en el trasplante de órganos, y en humanos también se conoce como el antígeno leucocito humano (HLA).
- ^ Aquí, intacto implica que la proteína no digerida es reconocida, y no que el paratope en el receptor de células B entra en contacto con el entero estructura de proteínas al mismo tiempo; el paratopo seguirá contactando sólo una porción restringida del antígeno expuesto en su superficie.
- ^ Hay muchos tipos de glóbulos blancos. La forma común de clasificarlos es según su apariencia bajo el microscopio ligero después de que se manchan por tintes químicos. Pero con el avance de los nuevos métodos tecnológicos de clasificación ha surgido. Uno de los métodos emplea el uso de anticuerpos monoclonales, que pueden atar específicamente a cada tipo de célula. Además, el mismo tipo de glóbulos blancos expresaría moléculas típicas de él en su membrana celular en varias etapas de desarrollo. Los anticuerpos monoclonales que pueden unirse específicamente con una molécula de superficie particular se considerarían como uno cluster of differentiation (CD). Cualquier anticuerpo monoclonal o grupo de anticuerpos monoclonales que no reaccione con moléculas de superficie conocidas de linfocitos, sino más bien a una molécula de superficie aún no reconocida sería emboscada como nuevo cluster of differentiation and numbered accordingly. Cada grupo de diferenciación es abreviado como "CD", y seguido por un número (generalmente indicando el orden de descubrimiento). Así, una célula que posee una molécula superficial (llamado ligand) que se une específicamente al racimo de diferenciación 4 sería conocido como CD4+ celda. Del mismo modo, un Célula CD8+ es uno que poseería el ligand CD8 y se unía a los anticuerpos monoclonales CD8.
- ^ Las células de plasma secretan anticuerpos que se unen a los igual estructura que había estimulado la célula B en primer lugar mediante la unión a su receptor de células B.
- ^ Afinidad se traduce aproximadamente como atracción de latín. Vea también: Definición de afinidad del Diccionario de Etymología Online y definición de afinidad del libreDiccionario por Farlex
- ^ Analógicamente, si en un lugar concurrido, se supone que uno debe reconocer a una persona, es mejor saber tantas características físicas como sea posible. Si conoce a la persona sólo por el peinado, hay una posibilidad de dominar a la persona si eso cambia. Mientras que, si aparte del peinado, si también se sabe las características faciales y lo que la persona se pondrá en un día en particular, se vuelve mucho más improbable que se pierda esa persona.
Referencias
- ^ a b c d e f g h i Goldsby, Richard; Kindt, TJ; Osborne, BA; Janis Kuby (2003). "Antígenos (capítulo 3)". Inmunología (Fifth ed.). Nueva York: W. H. Freeman and Company. pp. 57–75. ISBN 978-0716749479.
- ^ "Definición de Policlonal de MedicineNet.com". Diccionario Médico Nuevo Mundo de Webster. Archivado desde el original el 2012-08-07. Retrieved 2008-05-03.
- ^ a b Frank, Steven A. (2002). "Specificity and Cross-Reactividad (capítulo 4)". Inmunología y evolución de las enfermedades infecciosas. Universidad de Princeton. pp. 33 –56. ISBN 978-0691095950. Retrieved 2008-06-23.
- ^ "Etymology of "clone"". Diccionario de etimología en línea. Retrieved 2008-06-26.
- ^ Bansal, R.K. (2005). "Reproductive Cloning-An Act of Human Rights Violation". Journal of Indian Association of Forensic Medicine. 27 3): 971 –973. Archivado desde el original (PDF) on 2019-12-16. Retrieved 2008-06-23.
- ^ "Definición de la inoculación". TheFreeDictionary.com (citing Dorland's Medical Dictionary for Health Consumers. © 2007 por Saunders, una huella de Elsevier, Inc.). Retrieved 2008-06-10.
- ^ a b c Pier, Gerald B. (2005) [1945]. "Mecanismos moleculares de la patogénesis microbiana (capítulo 105)". En Kasper; Braunwald; Fauci; Hauser; Longo; Jameson (eds.). Principios de Harrison sobre Medicina InternaVol. 1 (Sexta edición). McGraw-Hill. p. 700. ISBN 978-0-07-123983-7.
- ^ a b c d e Goldsby (2007). "Organización y Expresión de Genes de Inmunoglobulina (capítulo 5)". Inmunología (Fifth ed.). Nueva York. pp. 105–136. ISBN 978-0-7167-6764-0.
{{cite book}}: CS1 maint: localización desaparecido editor (link) - ^ Nairn, Roderick (2004) [1954]. "Inmunología (capítulo 8)". En Geo F. Brooks; Janet S. Butel; Stephen A. Morse (eds.). Jawetz, Melnick, Microbiología Médica de Adelberg (Twenty-Third Edition International ed.). Publicaciones Lange/McGraw-Hill. pp. 133 –135, 138 –139. ISBN 978-0-07-123983-7.
- ^ a b c Goldsby (2007). "T-Cell Maturation, Activation and Differentiation (Chapter 10)". Inmunología (Fifth ed.). W.H. Freeman. pp. 221 –246. ISBN 978-0-7167-6764-0.
- ^ Nair, Deepak; Singh Kavita; Siddiqui Zaved; Nayak Bishnu; Rao Kanury; Salunke Dinakar (2002-01-09). "Epitope Recognition by Diverse Antibodies sugiere Convergencia Conformacional en una respuesta anticuerpo" (PDF). The Journal of Immunology. 168 5): 2371 –2382. doi:10.4049/jimmunol.168.5.2371. PMID 11859128. S2CID 14974530. Retrieved 2008-05-03.
- ^ "Aplicaciones inmunoquímicas". Consejos técnicos. Biociencias de EMD. Archivado desde el original el 11 de septiembre de 2008. Retrieved 2008-05-07.
- ^ Davis, Cheryl. "Antígenos". Curso de Biología. Western Kentucky University. Archivado desde el original el 04/03/2008. Retrieved 2008-05-12.
- ^ Ceri, Howard. "Antígenos". Curso de Inmunología. Universidad de Calgary. Archivado desde el original el 2008-10-05. Retrieved 2008-05-12.
- ^ Khudyakov, Yury; Howard A. Fields (2002). ADN artificial: Métodos y Aplicaciones. Florida: CRC Press. p. 227. ISBN 978-0-8493-1426-1.
- ^ a b c Myers, CD (1991). "Role of B cell antigen processing and presentation in the humoral inmuno response" (PDF). The FASEB Journal. 5 (11): 2547–2553. doi:10.1096/fasebj.5.11.1907935. PMID 1907935. S2CID 13324439. Retrieved 2008-06-20.
- ^ a b c d e f g h Goldsby (2007). "Overview of the Immune System (Chapter 1)". Inmunología (Fifth ed.). W.H. Freeman. pp. 1 –23. ISBN 978-0-7167-6764-0.
- ^ Goldsby (2007). "Procesamiento y Presentación de Antigenos (capítulo 8)". Inmunología (Fifth ed.). W.H. Freeman. pp. 188–194. ISBN 978-0-7167-6764-0.
- ^ a b Ojcius, DM; L Gapin; JM Kanellopoulos; P Kourilsky (septiembre de 1994). "¿Es el procesamiento de antígenos guiado por moléculas complejas de histocompatibilidad importantes?" (PDF). The FASEB Journal. 8 5): 974 –978. doi:10.1096/fasebj.8.12.8088463. PMID 8088463. S2CID 36890268. Retrieved 2008-06-20.
- ^ Goldsby (2007). "Células y Órganos del Sistema Inmunitario (capítulo 2)". Inmunología (Fifth ed.). W.H. Freeman. pp. 24 –56. ISBN 978-0-7167-6764-0.
- ^ a b c d e f h i j k Goldsby (2007). "B-Cell Generation, Activation and Differentiation (Chapter 11)". Inmunología (Fifth ed.). Nueva York. pp. 247 –275. ISBN 978-0-7167-6764-0.
{{cite book}}: CS1 maint: localización desaparecido editor (link) - ^ McPhee, Stephen; Ganong, William (2006). Patophysiology of Disease: An Introduction to Clinical Medicine. Lange Medical Books/McGraw-Hill. p. 39. ISBN 978-0-07-144159-9.
- ^ Cziko, Gary (1995). "El Sistema Inmunitario: Selección por el Enemigo". Sin Milagros: Teoría de Selección Universal y la Segunda Revolución Darwiniana (Fifth ed). Massachusetts: MIT Press. pp. 39–48. ISBN 978-0-262-03232-2. Retrieved 2008-05-12.
- ^ Greener, Mark (2005-02-14). "Los anticuerpos monoclonales (MAbs) giran 30". El Científico. 19 (3): 14. Archivado desde el original el 2007-08-31. Retrieved 2008-06-06.
- ^ Deem, Michael. "Michael W. Deem". Página Web oficial. Universidad de Rice. Archivado desde el original el 04/07/2008. Retrieved 2008-05-08.
- ^ Granholm, Norman; Tito Cavallo (1992). "Autoinmunity, Polyclonal B-Cell Activation and Infection (abstract)". Lupus. 1 2): 63–74 doi:10.1177/096120339200100203. PMID 1301966. S2CID 27649995.
- ^ Montes CL, Acosta-Rodríguez EV, Merino MC, Bermejo DA, Gruppi A (2007). "Polyclonal B cell activation in infection: infected agents' demonry or defense mechanism of the host? (abstract)". Journal of Leukocyte Biology. 82 5): 1027 –1032. doi:10.1189/jlb.0407214. PMID 17615380. S2CID 8054401.
- ^ "Emil von Behring: El Fundador de la Terapia del Suero". Premio Nobel de Medicina. Archivado desde el original el 2008-06-12. Retrieved 2008-06-23.
- ^ Mage, Rose G.; Ten Feizi. "Elvin A. Kabat". Memorias biográficas. Retrieved 2008-06-23.
- ^ a b c d Greenberg, Steven. "Una historia concisa de la inmunología" (PDF). Retrieved 2008-06-23.
- ^ "MTC News" (PDF). Karolinska Institutet. Archivado desde el original (PDF) on 2012-02-12. Retrieved 2008-06-23.
- ^ Turner, Stephen (octubre de 2007). "Una Idea POWERFUL" (PDF). Australasian Science. Archivado desde el original (PDF) el período 2008-07-21. Retrieved 2008-06-23.
Más lectura
- Goldsby, Richard; Kindt, TJ; Osborne, BA; Janis Kuby (2003). Inmunología (Fifth ed.). New York: W. H. Freeman and Company. ISBN 978-0-7167-4947-9.
- Kishiyama, Jeffery L. (2006) [1997]. "Disordens of the Immune system (Chapter 3)". En Stephen J. McPhee; William F. Ganong (eds.). Patophysiology of Disease: An Introduction to Clinical Medicine (5 ed.). Lange Medical Books/McGraw-Hill. pp. 32 –ISBN 978-0-07-110523-1.
- Nairn, Roderick (2004) [1954]. "Inmunología (capítulo 8)". En Geo F. Brooks; Janet S. Butel; Stephen A. Morse (eds.). Jawetz, Melnick, Microbiología Médica de Adelberg (Twenty-Third Edition International ed.). Publicaciones Lange/McGraw-Hill. pp. 133 –135, 138 –139. ISBN 978-0-07-123983-7.
Enlaces externos
- Introducción al sistema inmunitario