Resistencia antimicrobiana

La resistencia a los antimicrobianos (AMR) ocurre cuando los microbios desarrollan mecanismos que los protegen de los efectos de los antimicrobianos. Todas las clases de microbios pueden desarrollar resistencia. Los hongos desarrollan resistencia antifúngica. Los virus desarrollan resistencia antiviral. Los protozoos desarrollan resistencia antiprotozoaria y las bacterias desarrollan resistencia a los antibióticos. Las bacterias que se consideran extremadamente resistentes a los medicamentos (XDR) o totalmente resistentes a los medicamentos (TDR) a veces se denominan "superbacterias". Aunque la resistencia a los antimicrobianos es un proceso natural, a menudo es el resultado del uso inadecuado de los medicamentos y el manejo de las infecciones.
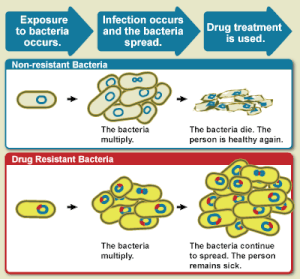
La resistencia a los antibióticos es un subconjunto importante de AMR, que se aplica específicamente a las bacterias que se vuelven resistentes a los antibióticos. La resistencia en bacterias puede surgir naturalmente por mutación genética o por una especie que adquiere resistencia de otra. La resistencia puede aparecer espontáneamente debido a mutaciones aleatorias. Sin embargo, el uso prolongado de antimicrobianos parece fomentar la selección de mutaciones que pueden hacer que los antimicrobianos sean ineficaces.
Las condiciones clínicas debidas a la RAM causan millones de muertes cada año. Las infecciones causadas por microbios resistentes son más difíciles de tratar y requieren dosis más altas de medicamentos antimicrobianos o medicamentos alternativos que pueden resultar más tóxicos. Estos enfoques también pueden ser más costosos. Los microbios resistentes a múltiples antimicrobianos se denominan multirresistentes (MDR).
La prevención del uso indebido de antibióticos, que puede conducir a la resistencia a los antibióticos, incluye tomar antibióticos solo cuando se los recetan. Los antibióticos de espectro reducido son preferibles a los antibióticos de amplio espectro cuando es posible, ya que es menos probable que los organismos específicos dirigidos de manera efectiva y precisa causen resistencia, así como efectos secundarios. Para las personas que toman estos medicamentos en casa, la educación sobre el uso adecuado es esencial. Los proveedores de atención médica pueden minimizar la propagación de infecciones resistentes mediante el uso de saneamiento e higiene adecuados, incluido el lavado de manos y la desinfección entre pacientes, y deben alentar lo mismo con el paciente, los visitantes y los miembros de la familia.
El aumento de la resistencia a los medicamentos se debe principalmente al uso de antimicrobianos en humanos y otros animales, y la propagación de cepas resistentes entre ambos. La creciente resistencia también se ha relacionado con la liberación de efluentes tratados inadecuadamente de la industria farmacéutica, especialmente en países donde se fabrican medicamentos a granel. Los antibióticos aumentan la presión selectiva en las poblaciones bacterianas, provocando la muerte de las bacterias vulnerables; esto aumenta el porcentaje de bacterias resistentes que siguen creciendo. Incluso a niveles muy bajos de antibiótico, las bacterias resistentes pueden tener una ventaja de crecimiento y crecer más rápido que las bacterias vulnerables. A medida que la resistencia a los antibióticos se vuelve más común, existe una mayor necesidad de tratamientos alternativos. Se han emitido llamados para nuevas terapias con antibióticos, pero el desarrollo de nuevos medicamentos es cada vez más raro.
La resistencia a los antimicrobianos está aumentando en todo el mundo debido al aumento de la prescripción y dispensación de antibióticos en los países en desarrollo. Se estima que cada año se producen entre 700 000 y varios millones de muertes y sigue representando una importante amenaza para la salud pública en todo el mundo. Cada año en los Estados Unidos, al menos 2,8 millones de personas se infectan con bacterias resistentes a los antibióticos y al menos 35 000 personas mueren y se incrementan los costos de atención de la salud y se pierden 55 000 millones de dólares estadounidenses. Según estimaciones de la Organización Mundial de la Salud (OMS), la RAM podría causar 350 millones de muertes para 2050. Para entonces, la cifra anual de muertes será de 10 millones, según un informe de las Naciones Unidas.
Existen llamados públicos a la acción colectiva mundial para abordar la amenaza que incluyen propuestas para tratados internacionales sobre la resistencia a los antimicrobianos. La resistencia a los antibióticos en todo el mundo no está completamente identificada, pero los países más pobres con sistemas de salud más débiles se ven más afectados. Durante la pandemia de COVID-19, la acción contra la resistencia a los antimicrobianos se desaceleró debido a que los científicos se centraron más en la investigación del SARS-CoV-2.
Definición
La OMS define la resistencia a los antimicrobianos como la resistencia de un microorganismo a un fármaco antimicrobiano que alguna vez fue capaz de tratar una infección por ese microorganismo. Una persona no puede volverse resistente a los antibióticos. La resistencia es una propiedad del microbio, no de una persona u otro organismo infectado por un microbio. Todos los tipos de microbios pueden desarrollar resistencia a los medicamentos. Así, existen resistencias a antibióticos, antifúngicos, antivirales y antiparasitarios.
La resistencia a los antibióticos es un subconjunto de la resistencia a los antimicrobianos. Esta resistencia más específica está vinculada a las bacterias patógenas y, por lo tanto, se divide en dos subconjuntos adicionales, microbiológicos y clínicos. La resistencia ligada microbiológicamente es la más común y ocurre a partir de genes, mutados o heredados, que permiten a las bacterias resistir el mecanismo asociado con ciertos antibióticos. La resistencia clínica se muestra a través del fracaso de muchas técnicas terapéuticas en las que las bacterias que normalmente son susceptibles a un tratamiento se vuelven resistentes después de sobrevivir al resultado del tratamiento. En ambos casos de resistencia adquirida, la bacteria puede pasar el catalizador genético de resistencia a través de conjugación, transducción o transformación. Esto permite que la resistencia se propague a través del mismo patógeno o incluso patógenos bacterianos similares.
Resumen
El informe de la OMS publicado en abril de 2014 afirma: "esta grave amenaza ya no es una predicción para el futuro, está ocurriendo ahora mismo en todas las regiones del mundo y tiene el potencial de afectar a cualquier persona, de cualquier edad, en cualquier país. La resistencia a los antibióticos, cuando las bacterias cambian y los antibióticos ya no funcionan en las personas que los necesitan para tratar infecciones, es ahora una gran amenaza para la salud pública."
Las muertes a nivel mundial atribuibles a la RAM ascendieron a 1,27 millones en 2019. Ese año, la RAM puede haber contribuido a 5 millones de muertes y una de cada cinco personas que fallecieron a causa de la RAM eran niños menores de cinco años.
En 2018, la OMS consideró que la resistencia a los antibióticos era una de las mayores amenazas para la salud, la seguridad alimentaria y el desarrollo a nivel mundial. Las muertes atribuibles a la RAM varían según el área:
| Lugar | Muertes por cada 100.000 atribuibles a AMR |
|---|---|
| África septentrional y Oriente Medio | 11.2 |
| Asia sudoriental y oriental, y Oceanía | 11.7 |
| América Latina y el Caribe | 14.4 |
| Europa central y oriental y Asia central | 17.6 |
| Asia meridional | 21.5 |
| África subsahariana | 23,7 |
El Centro Europeo para la Prevención y el Control de Enfermedades calculó que en 2015 hubo 671 689 infecciones en la UE y el Espacio Económico Europeo causadas por bacterias resistentes a los antibióticos, lo que resultó en 33 110 muertes. La mayoría se adquirieron en entornos sanitarios.
Causas
La resistencia a los antimicrobianos se debe principalmente al uso excesivo de antimicrobianos. Esto lleva a que los microbios desarrollen una defensa contra los medicamentos utilizados para tratarlos, o que ciertas cepas de microbios que tienen una resistencia natural a los antimicrobianos se vuelvan mucho más frecuentes que las que se vencen fácilmente con medicamentos. Si bien la resistencia a los antimicrobianos ocurre naturalmente con el tiempo, el uso de agentes antimicrobianos en una variedad de entornos, tanto dentro como fuera de la industria de la salud, ha llevado a que la resistencia a los antimicrobianos sea cada vez más frecuente.
Ocurrencia natural
La resistencia a los antimicrobianos puede evolucionar naturalmente debido a la exposición continua a los antimicrobianos. La selección natural significa que los organismos que son capaces de adaptarse a su entorno, sobreviven y continúan produciendo descendencia. Como resultado, los tipos de microorganismos que son capaces de sobrevivir con el tiempo con el ataque continuo de ciertos agentes antimicrobianos se volverán naturalmente más frecuentes en el medio ambiente, y aquellos sin esta resistencia se volverán obsoletos.
Algunas resistencias a los antibióticos contemporáneas también han evolucionado naturalmente antes del uso de antibióticos o el uso clínico en humanos de los antimicrobianos respectivos. Por ejemplo, la resistencia a la meticilina evolucionó en un patógeno de los erizos, posiblemente como una adaptación coevolutiva del patógeno a los erizos que están infectados por un dermatofito que produce antibióticos de forma natural. Además, muchos hongos y bacterias del suelo son competidores naturales y el antibiótico original Penicilina descubierto por Alexander Fleming perdió rápidamente eficacia clínica en el tratamiento de humanos y, además, ninguna de las otras penicilinas naturales (F, K, N, X, O, U1 o U6) están actualmente en uso clínico.
Con el tiempo, la mayoría de las cepas de bacterias e infecciones presentes serán del tipo resistente al agente antimicrobiano que se usa para tratarlas, lo que hace que este agente ahora sea ineficaz para vencer a la mayoría de los microbios. Con el aumento del uso de agentes antimicrobianos, se acelera este proceso natural.
Automedicación
La automedicación por parte de los consumidores se define como "la toma de medicamentos por iniciativa propia o por sugerencia de otra persona, que no sea un profesional médico certificado", y ha sido identificada como una de las principales razones de la evolución de la resistencia a los antimicrobianos. En un esfuerzo por controlar su propia enfermedad, los pacientes toman el consejo de fuentes de los medios de comunicación, amigos y familiares, a veces falsos, lo que les hace tomar antimicrobianos innecesariamente o en exceso. Mucha gente recurre a esto por necesidad, cuando el acceso a un médico está racionado o no está disponible temporalmente debido a confinamientos o cierres de consultorios médicos, o cuando los pacientes tienen una cantidad limitada de tiempo o dinero para ver a un médico que les receta, o, especialmente en muchos países en desarrollo con poblaciones en crecimiento pero con una economía poco desarrollada que carecen de acceso económico y conveniente a profesionales clínicos. En estas situaciones, los gobiernos naturalmente permiten la venta de antimicrobianos como medicamentos de venta libre. Este mayor acceso hace que sea extremadamente fácil obtener antimicrobianos sin ningún objetivo (lo que mejoraría la utilidad) o restricción de tiempo y costo, y como resultado, muchos antimicrobianos se toman incorrectamente, lo que genera cepas microbianas resistentes. Un ejemplo importante de un lugar que enfrenta estos desafíos es la India, donde en el estado de Punjab, el 73 % de la población recurrió al tratamiento de sus problemas de salud menores y enfermedades crónicas a través de la automedicación.
Dos problemas importantes con la automedicación son la falta de conocimiento del público sobre, en primer lugar, los efectos peligrosos de ciertos antimicrobianos (por ejemplo, la ciprofloxacina que causa tendinitis y ruptura del tendón) y, en segundo lugar, la amplia resistencia microbiana. Para determinar el conocimiento del público y las nociones preconcebidas sobre la resistencia a los antibióticos, un tipo importante de resistencia a los antimicrobianos, se realizó una selección de 3537 artículos publicados en Europa, Asia y América del Norte. Del total de 55.225 personas encuestadas, el 70 % había oído hablar de la resistencia a los antibióticos anteriormente, pero el 88 % de esas personas pensaba que se refería a algún tipo de cambio físico en el cuerpo. Con tantas personas en todo el mundo con la capacidad de automedicarse con antibióticos, y una gran mayoría sin saber qué es la resistencia a los antimicrobianos, hace que el aumento de la resistencia a los antimicrobianos sea mucho más probable.
Mal uso clínico
El mal uso clínico por parte de los profesionales de la salud es otra causa que conduce a una mayor resistencia a los antimicrobianos. Los estudios realizados por el CDC muestran que la indicación del tratamiento con antibióticos, la elección del agente utilizado y la duración de la terapia fueron incorrectas hasta en el 50% de los casos estudiados. En otro estudio realizado en una unidad de cuidados intensivos de un importante hospital de Francia, se demostró que entre el 30 % y el 60 % de los antibióticos prescritos eran innecesarios. Estos usos inapropiados de agentes antimicrobianos promueven la evolución de la resistencia a los antimicrobianos al ayudar a las bacterias a desarrollar alteraciones genéticas que conducen a la resistencia.
En un estudio realizado por el American Journal of Infection Control destinado a evaluar a los médicos' actitudes y conocimientos sobre la resistencia a los antimicrobianos en entornos ambulatorios, solo el 63 % de los encuestados informó que la resistencia a los antibióticos es un problema en sus prácticas locales, mientras que el 23 % informó que la prescripción agresiva de antibióticos es necesaria para evitar la falta de atención adecuada. Esto demuestra cómo la mayoría de los médicos subestiman el impacto que sus propios hábitos de prescripción tienen sobre la resistencia a los antimicrobianos en general. También confirma que algunos médicos pueden ser demasiado cautelosos y recetar antibióticos tanto por razones médicas como legales, incluso cuando las indicaciones clínicas para el uso de estos medicamentos no siempre se confirman. Esto puede conducir al uso innecesario de antimicrobianos, un patrón que puede haber empeorado durante la pandemia de COVID-19.
Los estudios han demostrado que los conceptos erróneos comunes sobre la eficacia y la necesidad de los antibióticos para tratar enfermedades leves comunes contribuyen a su uso excesivo.
Pandemias, desinfectantes y sistemas sanitarios
El aumento del uso de antibióticos durante la pandemia de COVID-19 puede exacerbar este desafío de salud global. Además, las cargas pandémicas en algunos sistemas de salud pueden contribuir a las infecciones resistentes a los antibióticos. Por otro lado, un estudio sugiere que "una mayor higiene de manos, menos viajes internacionales y menos procedimientos hospitalarios electivos pueden reducir la selección y propagación de patógenos RAM a corto plazo". Los desinfectantes, como en diversas formas de uso de desinfectantes para manos a base de alcohol, y el lavado de manos antiséptico también pueden tener el potencial de aumentar la resistencia a los antimicrobianos. Según un estudio, "El uso extensivo de desinfectantes conduce a mutaciones que inducen resistencia a los antimicrobianos".
Contaminación ambiental
Los efluentes no tratados de las industrias farmacéuticas, hospitales y clínicas, y la eliminación inadecuada de medicamentos vencidos o sin usar pueden exponer a los microbios del medio ambiente a los antibióticos y desencadenar la evolución de resistencia.
Producción de alimentos
Ganadería
La crisis de la resistencia a los antimicrobianos también se extiende a la industria alimentaria, específicamente a los animales destinados a la producción de alimentos. Los antibióticos se alimentan al ganado para que actúen como suplementos de crecimiento y como una medida preventiva para disminuir la probabilidad de infecciones. Esto da como resultado la transferencia de cepas bacterianas resistentes a los alimentos que comen los humanos, lo que provoca una transferencia de enfermedades potencialmente mortal. Si bien esta práctica da como resultado mejores rendimientos y productos cárnicos, es un problema importante en términos de prevención de la resistencia a los antimicrobianos. Aunque la evidencia que relaciona el uso de antimicrobianos en el ganado con la resistencia a los antimicrobianos es limitada, el Grupo Asesor de la Organización Mundial de la Salud sobre Vigilancia Integrada de la Resistencia a los Antimicrobianos recomendó encarecidamente la reducción del uso de antimicrobianos médicamente importantes en el ganado. Además, el Grupo Asesor afirmó que dichos antimicrobianos deberían prohibirse expresamente tanto para la promoción del crecimiento como para la prevención de enfermedades.
En un estudio publicado por la Academia Nacional de Ciencias que mapea el consumo de antimicrobianos en el ganado a nivel mundial, se predijo que en los 228 países estudiados, habría un aumento total del 67 % en el consumo de antibióticos por parte del ganado para 2030. En algunos países como Brasil, Rusia, India, China y Sudáfrica, se prevé que se produzca un aumento del 99 %. Varios países han restringido el uso de antibióticos en el ganado, incluidos Canadá, China, Japón y los EE. UU. Estas restricciones a veces se asocian con una reducción de la prevalencia de la resistencia a los antimicrobianos en humanos.
Pesticidas
La mayoría de los pesticidas protegen los cultivos contra insectos y plantas, pero en algunos casos se usan pesticidas antimicrobianos para proteger contra varios microorganismos como bacterias, virus, hongos, algas y protozoos. El uso excesivo de muchos pesticidas en un esfuerzo por tener un mayor rendimiento de los cultivos ha resultado en que muchos de estos microbios desarrollen una tolerancia contra estos agentes antimicrobianos. Actualmente hay más de 4000 pesticidas antimicrobianos registrados en la EPA y vendidos al mercado, lo que demuestra el uso generalizado de estos agentes. Se estima que por cada comida que consume una persona, se utilizan 0,3 g de pesticidas, ya que el 90 % de todos los pesticidas se utilizan en la agricultura. La mayoría de estos productos se utilizan para ayudar a defenderse contra la propagación de enfermedades infecciosas y, con suerte, proteger la salud pública. Pero de la gran cantidad de pesticidas utilizados, también se estima que menos del 0,1% de esos agentes antimicrobianos alcanzan realmente sus objetivos. Eso deja más del 99% de todos los pesticidas utilizados disponibles para contaminar otros recursos. En el suelo, el aire y el agua, estos agentes antimicrobianos pueden propagarse, entrar en contacto con más microorganismos y hacer que estos microbios desarrollen mecanismos para tolerar y resistir aún más los pesticidas.
Prevención
Ha habido cada vez más llamados públicos para la acción colectiva global para hacer frente a la amenaza, incluida una propuesta para un tratado internacional sobre la resistencia a los antimicrobianos. Todavía se necesitan más detalles y atención para reconocer y medir las tendencias en la resistencia a nivel internacional; se ha sugerido la idea de un sistema de seguimiento global, pero aún no se ha implementado. Un sistema de esta naturaleza proporcionaría información sobre las áreas de alta resistencia, así como la información necesaria para evaluar los programas y otros cambios realizados para combatir o revertir la resistencia a los antibióticos.
Duración de los antibióticos
La duración del tratamiento con antibióticos debe basarse en la infección y otros problemas de salud que pueda tener una persona. Para muchas infecciones, una vez que una persona ha mejorado, hay poca evidencia de que suspender el tratamiento provoque más resistencia. Algunos, por lo tanto, sienten que detenerse temprano puede ser razonable en algunos casos. Sin embargo, otras infecciones requieren tratamientos prolongados, independientemente de si la persona se siente mejor.
Monitoreo y mapeo
Existen múltiples programas de monitoreo nacionales e internacionales para las amenazas resistentes a los medicamentos, que incluyen Staphylococcus aureus resistente a la meticilina (MRSA), S. aureus resistente a la vancomicina (VRSA), betalactamasa de espectro extendido (BLEE), Enterococcus resistente a la vancomicina (VRE) y Acinetobacter baumannii multirresistente (MRAB).
ResistanceOpen es un mapa mundial en línea de la resistencia a los antimicrobianos desarrollado por HealthMap que muestra datos agregados sobre la resistencia a los antimicrobianos a partir de datos disponibles públicamente y enviados por los usuarios. El sitio web puede mostrar datos en un radio de 40 km (25 millas) desde una ubicación. Los usuarios pueden enviar datos de antibiogramas para hospitales o laboratorios individuales. Los datos europeos provienen de EARS-Net (Red europea de vigilancia de la resistencia a los antimicrobianos), parte del ECDC.
ResistanceMap es un sitio web del Center for Disease Dynamics, Economics & Política y proporciona datos sobre la resistencia a los antimicrobianos a nivel mundial.
Limitar el uso de antibióticos
Los programas de administración de antibióticos parecen útiles para reducir las tasas de resistencia a los antibióticos. El programa de administración de antibióticos también proporcionará a los farmacéuticos el conocimiento para educar a los pacientes que los antibióticos no funcionarán para un virus.
El uso excesivo de antibióticos se ha convertido en uno de los principales contribuyentes a la evolución de la resistencia a los antibióticos. Desde el comienzo de la era de los antibióticos, los antibióticos se han utilizado para tratar una amplia gama de enfermedades. El uso excesivo de antibióticos se ha convertido en la principal causa del aumento de los niveles de resistencia a los antibióticos. El principal problema es que los médicos están dispuestos a recetar antibióticos a personas mal informadas que creen que los antibióticos pueden curar casi todas las enfermedades, incluidas las infecciones virales como el resfriado común. En un análisis de recetas de medicamentos, el 36% de las personas con un resfriado o una infección de las vías respiratorias superiores (ambas de origen viral) recibieron recetas de antibióticos. Estas recetas no lograron otra cosa que aumentar el riesgo de una mayor evolución de bacterias resistentes a los antibióticos. El uso de antibióticos sin receta es otra fuerza impulsora que conduce al uso excesivo de antibióticos para el autotratamiento de enfermedades como el resfriado común, la tos, la fiebre y la disentería, lo que resulta en una epidemia de resistencia a los antibióticos en países como Bangladesh, con el riesgo de que se propague por todo el mundo. La introducción de una administración estricta de antibióticos en el ámbito ambulatorio puede reducir la resistencia bacteriana emergente.
A nivel hospitalario
Los equipos de administración de antimicrobianos en los hospitales fomentan el uso óptimo de los antimicrobianos. Los objetivos de la administración de antimicrobianos son ayudar a los médicos a elegir el fármaco correcto en la dosis y la duración correctas de la terapia, al mismo tiempo que se previene el uso indebido y se minimiza el desarrollo de resistencia. La administración puede reducir la duración de la estadía en un promedio de poco más de 1 día sin aumentar el riesgo de muerte.
A nivel de cultivo
Está establecido que el uso de antibióticos en la cría de animales puede dar lugar a resistencias AMR en las bacterias que se encuentran en los animales destinados al consumo humano a los antibióticos que se administran (a través de inyecciones o alimentos medicados). Por esta razón, solo los antimicrobianos que se consideran "no clínicamente relevantes" se utilizan en estas prácticas.
Estudios recientes han demostrado que el uso profiláctico de medicamentos "no prioritarios" o "sin relevancia clínica" los antimicrobianos en los alimentos pueden potencialmente, bajo ciertas condiciones, conducir a la selección conjunta de bacterias AMR ambientales con resistencia a antibióticos médicamente importantes. La posibilidad de coselección de resistencias a AMR en la cadena alimentaria puede tener implicaciones de gran alcance para la salud humana.
A nivel de médico de cabecera
Dado el volumen de atención brindada en la atención primaria (práctica general), las estrategias recientes se han centrado en reducir la prescripción innecesaria de antibióticos en este entorno. Se ha demostrado que las intervenciones simples, como la información escrita que explica la inutilidad de los antibióticos para las infecciones comunes, como las infecciones de las vías respiratorias superiores, reducen la prescripción de antibióticos.
El prescriptor debe adherirse estrictamente a los cinco derechos de la administración de medicamentos: el paciente correcto, el fármaco correcto, la dosis correcta, la vía correcta y el momento correcto.
Se deben tomar cultivos antes del tratamiento cuando esté indicado y se debe cambiar el tratamiento según el informe de susceptibilidad.
Alrededor de un tercio de las recetas de antibióticos escritas en entornos ambulatorios en los Estados Unidos no fueron apropiadas en 2010 y 2011. Los médicos en los Estados Unidos escribieron 506 prescripciones anuales de antibióticos por cada 1000 personas, de las cuales 353 eran médicamente necesarias.
Los trabajadores de la salud y los farmacéuticos pueden ayudar a combatir la resistencia al: mejorar la prevención y el control de infecciones; solo recetar y dispensar antibióticos cuando realmente se necesiten; prescribir y dispensar el(los) antibiótico(s) adecuado(s) para tratar la enfermedad.
A nivel individual
Las personas pueden ayudar a combatir la resistencia usando antibióticos solo cuando los receta un médico; completar la prescripción completa, incluso si se sienten mejor; nunca compartir antibióticos con otros ni usar recetas sobrantes.
Ejemplos de países
- Los Países Bajos tienen la tasa más baja de prescripción de antibióticos en la OCDE, a un ritmo de 11.4 dosis diarias definidas (DDD) por 1.000 personas por día en 2011.
- Alemania y Suecia también tienen tasas de prescripción más bajas, y la tasa de Suecia ha estado disminuyendo desde 2007.
- Grecia, Francia y Bélgica tienen altas tasas de prescripción de más de 28 DDD.
Agua, saneamiento, higiene
El control de enfermedades infecciosas a través de una infraestructura mejorada de agua, saneamiento e higiene (WASH) debe incluirse en la agenda de resistencia a los antimicrobianos (AMR). El "Grupo de Coordinación Interagencial sobre Resistencia Antimicrobiana" declaró en 2018 que "la propagación de patógenos a través del agua insegura da como resultado una alta carga de enfermedades gastrointestinales, lo que aumenta aún más la necesidad de tratamiento con antibióticos". Este es un problema particular en los países en desarrollo, donde la propagación de enfermedades infecciosas causada por estándares WASH inadecuados es un importante impulsor de la demanda de antibióticos. El uso creciente de antibióticos junto con los niveles persistentes de enfermedades infecciosas han llevado a un ciclo peligroso en el que aumenta la dependencia de los antimicrobianos mientras que disminuye la eficacia de los medicamentos. El uso adecuado de la infraestructura de agua, saneamiento e higiene (WASH) puede resultar en una disminución del 47% al 72% de los casos de diarrea tratados con antibióticos, según el tipo de intervención y su eficacia. Una reducción de la carga de la enfermedad diarreica a través de una infraestructura mejorada daría como resultado una gran disminución en el número de casos de diarrea tratados con antibióticos. Esto se estimó en un rango de 5 millones en Brasil hasta 590 millones en India para el año 2030. El fuerte vínculo entre el aumento del consumo y la resistencia indica que esto mitigará directamente la propagación acelerada de AMR. Saneamiento y agua para todos al 2030 es la Meta Número 6 de los Objetivos de Desarrollo Sostenible.
Un aumento en el cumplimiento del lavado de manos por parte del personal del hospital da como resultado una disminución de las tasas de organismos resistentes.
La infraestructura de abastecimiento de agua y saneamiento en los establecimientos de salud ofrece importantes beneficios colaterales para combatir la resistencia a los antimicrobianos, y se debe aumentar la inversión. Hay mucho margen de mejora: la OMS y UNICEF estimaron en 2015 que, en todo el mundo, el 38 % de los establecimientos de salud no tenían una fuente de agua, casi el 19 % no tenía retretes y el 35 % no tenía agua ni jabón ni desinfectante para manos a base de alcohol para lavarse las manos..
Tratamiento de aguas residuales industriales
Los fabricantes de antimicrobianos deben mejorar el tratamiento de sus aguas residuales (utilizando procesos de tratamiento de aguas residuales industriales) para reducir la liberación de residuos al medio ambiente.
Gestión en aprovechamiento animal
Europa
En 1997, los ministros de salud de la Unión Europea votaron para prohibir la avoparcina y cuatro antibióticos adicionales utilizados para promover el crecimiento animal en 1999. En 2006, se convirtió en una prohibición del uso de antibióticos en los piensos europeos, con la excepción de dos antibióticos en los piensos para aves de corral. eficaz. En Escandinavia, existe evidencia de que la prohibición ha llevado a una menor prevalencia de resistencia a los antibióticos en poblaciones bacterianas animales (no peligrosas). A partir de 2004, varios países europeos establecieron una disminución de la resistencia a los antimicrobianos en humanos al limitar el uso de antimicrobianos en la agricultura y las industrias alimentarias sin poner en peligro la salud animal o el costo económico.
Estados Unidos
El Departamento de Agricultura de los Estados Unidos (USDA) y la Administración de Alimentos y Medicamentos (FDA) recopilan datos sobre el uso de antibióticos en humanos y, de manera más limitada, en animales. La FDA determinó por primera vez en 1977 que existe evidencia de aparición de cepas bacterianas resistentes a los antibióticos en el ganado. No obstante, la práctica establecida desde hace mucho tiempo de permitir la venta de antibióticos de venta libre (incluida la penicilina y otras drogas) a propietarios de animales legos para que los administren a sus propios animales continuó en todos los estados. En 2000, la FDA anunció su intención de revocar la aprobación del uso de fluoroquinolonas en la producción avícola debido a la evidencia sustancial que lo relaciona con la aparición de infecciones por Campylobacter resistentes a las fluoroquinolonas en humanos. Los desafíos legales de las industrias de alimentos para animales y farmacéutica retrasaron la decisión final hasta 2006. Se prohibió el uso de fluoroquinolonas fuera de la etiqueta en animales para alimentos en los EE. UU. desde 2007. Sin embargo, siguen usándose ampliamente en animales exóticos y de compañía.
Planes de acción globales y conciencia
La creciente interconexión del mundo y el hecho de que no se hayan desarrollado ni aprobado nuevas clases de antibióticos durante más de 25 años resaltan hasta qué punto la resistencia a los antimicrobianos es un desafío para la salud mundial. En la 68.ª Asamblea Mundial de la Salud celebrada en mayo de 2015, se aprobó un plan de acción mundial para hacer frente al creciente problema de la resistencia a los antibióticos y otros medicamentos antimicrobianos. Uno de los objetivos clave del plan es mejorar la concienciación y la comprensión de la resistencia a los antimicrobianos a través de comunicación, educación y formación. Este plan de acción global desarrollado por la Organización Mundial de la Salud fue creado para combatir el problema de la resistencia a los antimicrobianos y fue guiado por el asesoramiento de países y partes interesadas clave. El plan de acción global de la OMS se compone de cinco objetivos clave que pueden abordarse a través de diferentes medios, y representa a los países que se unen para resolver un problema importante que puede tener consecuencias para la salud en el futuro. Estos objetivos son los siguientes:
- mejorar la conciencia y la comprensión de la resistencia antimicrobiana mediante una comunicación efectiva, la educación y la capacitación.
- fortalecer la base de conocimientos y pruebas mediante la vigilancia y la investigación.
- reducir la incidencia de la infección mediante medidas eficaces de saneamiento, higiene y prevención de infecciones.
- optimizar el uso de medicamentos antimicrobianos en salud humana y animal.
- desarrollar el caso económico de inversión sostenible que tenga en cuenta las necesidades de todos los países y aumentar la inversión en nuevos medicamentos, herramientas de diagnóstico, vacunas y otras intervenciones.
Pasos hacia el progreso
- React basado en Suecia ha producido material informativo sobre AMR para el público en general.
- Se están produciendo videos para que el público en general genere interés y conciencia.
- El Departamento de Salud de Irlanda publicó en octubre de 2017 un Plan de Acción Nacional sobre la Resistencia Antimicrobiana. The Strategy for the Control of Antimicrobial Resistance in Ireland (SARI), Iaunched in 2001 developed Guidelines for Antimicrobial Stewardship in Hospitals in Ireland in jointly with the Health Protection Surveillance Centre, these were published in 2009. Tras su publicación se lanzó una campaña de información pública 'Acción sobre antibióticos' para destacar la necesidad de un cambio en la prescripción de antibióticos. A pesar de ello, la prescripción de antibióticos sigue siendo elevada con varianza en la adhesión a las directrices.
Semana de Concientización sobre los Antibióticos
La Organización Mundial de la Salud ha promovido la primera Semana Mundial de Concientización sobre los Antibióticos del 16 al 22 de noviembre de 2015. El objetivo de la semana es aumentar la conciencia mundial sobre la resistencia a los antibióticos. También quiere promover el uso correcto de los antibióticos en todos los campos para evitar nuevos casos de resistencia a los antibióticos.
La Semana Mundial de Concientización sobre los Antibióticos se lleva a cabo cada noviembre desde 2015. Para 2017, la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), la Organización Mundial de la Salud (OMS) y la Organización Mundial de Sanidad Animal (OIE) están juntos llamando al uso responsable de antibióticos en humanos y animales para reducir la aparición de resistencia a los antibióticos.
Naciones Unidas
En 2016, el Secretario General de las Naciones Unidas convocó al Grupo de coordinación interinstitucional (IACG) sobre la resistencia a los antimicrobianos. El IACG trabajó con organizaciones internacionales y expertos en salud humana, animal y vegetal para crear un plan para combatir la resistencia a los antimicrobianos. Su informe publicado en abril de 2019 destaca la gravedad de la resistencia a los antimicrobianos y la amenaza que representa para la salud mundial. Sugiere cinco recomendaciones a seguir por los estados miembros para hacer frente a esta creciente amenaza. Las recomendaciones del IACG son las siguientes:
- Acelerar los progresos en los países
- Innovar para asegurar el futuro
- Colaborar para una acción más eficaz
- Invertir para una respuesta sostenible
- Fortalecer la rendición de cuentas y la gobernanza mundial
Mecanismos y organismos
Bacterias

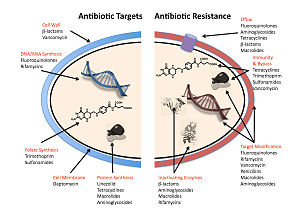
Los cinco mecanismos principales por los que las bacterias muestran resistencia a los antibióticos son:
- Inactivación o modificación de fármacos: por ejemplo, desactivación enzimática de penicilina G en algunas bacterias resistentes a la penicilina mediante la producción de β-lactamasas. Los fármacos también pueden ser modificados químicamente a través de la adición de grupos funcionales por enzimas transferasasas; por ejemplo, la acetilación, la fosforilación o la adenylación son mecanismos comunes de resistencia a los aminoglicosides. La acetilación es el mecanismo más utilizado y puede afectar a varias clases de drogas.
- Alteración del sitio objetivo o vinculante: por ejemplo, alteración del PBP, el sitio de destino vinculante de penicilinas, en el MRSA y otras bacterias resistentes a la penicilina. Otro mecanismo protector encontrado entre las especies bacterianas es proteínas de protección ribosomal. Estas proteínas protegen la célula bacteriana de los antibióticos que apuntan a los ribosomas de la célula para inhibir la síntesis de proteínas. El mecanismo implica la unión de las proteínas de protección ribosomal a los ribosomas de la célula bacteriana, que a su vez cambia su forma conformacional. Esto permite que los ribosomas continúen sintetizando proteínas esenciales para la célula, evitando al mismo tiempo los antibióticos de unión al ribosoma para inhibir la síntesis de proteínas.
- Alteración de vías metabólicas: por ejemplo, algunas bacterias resistentes a la sulfonamida no requieren ácido para-aminobenzoico (PABA), un importante precursor para la síntesis de ácido fólico y ácidos nucleicos en bacterias inhibidas por sulfonamidas, en cambio, como las células mamíferas, recurren al ácido fólico preformado.
- Reducción de la acumulación de drogas: disminuyendo la permeabilidad de las drogas o aumentando el eflujo activo (golpeando) de las drogas en la superficie celular Estas bombas dentro de la membrana celular de ciertas especies bacterianas se utilizan para bombear antibióticos fuera de la célula antes de que puedan hacer cualquier daño. A menudo se activan por un sustrato específico asociado con un antibiótico, como en la resistencia a la fluoroquinolona.
- Reciclaje y división del ríbote: por ejemplo, el estancamiento mediático del ribosoma por lincomycina y eritromicina destilada por una proteína de choque térmico que se encuentra en Listeria monocytogenes, que es un homólogo de HflX de otras bacterias. La liberación del ribosoma de la droga permite más traducción y consiguiente resistencia a la droga.
Hay varios tipos diferentes de gérmenes que han desarrollado una resistencia con el tiempo.
Los seis patógenos que causan la mayoría de las muertes asociadas con la resistencia son Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Acinetobacter baumannii y Pseudomonas aeruginosa. Fueron responsables de 929 000 muertes atribuibles a la resistencia y 3,57 millones de muertes asociadas a la resistencia en 2019.
La Neisseria gonorrhoeae productora de penicilinasa desarrolló resistencia a la penicilina en 1976. Otro ejemplo es la Neisseria gonorrhoeae resistente a la azitromicina, que desarrolló resistencia a la azitromicina en 2011.
En las bacterias gramnegativas, los genes de resistencia mediados por plásmidos producen proteínas que pueden unirse a la ADN girasa, protegiéndola de la acción de las quinolonas. Finalmente, las mutaciones en sitios clave en la ADN girasa o la topoisomerasa IV pueden disminuir su afinidad de unión a las quinolonas, disminuyendo la eficacia del fármaco.
Algunas bacterias son naturalmente resistentes a ciertos antibióticos; por ejemplo, las bacterias gramnegativas son resistentes a la mayoría de los antibióticos lactámicos β debido a la presencia de lactamasa β. La resistencia a los antibióticos también se puede adquirir como resultado de una mutación genética o de una transferencia horizontal de genes. Aunque las mutaciones son raras, con mutaciones espontáneas en el genoma del patógeno que ocurren a una tasa de aproximadamente 1 en 105 a 1 en 108 por replicación cromosómica, el hecho de que las bacterias se reproduzcan a una tasa alta permite que el efecto sea significativo. Dado que la esperanza de vida y la producción de nuevas generaciones pueden ser en una escala de tiempo de meras horas, una nueva mutación (de novo) en una célula madre puede convertirse rápidamente en una mutación heredada de prevalencia generalizada, lo que resulta en la microevolución de una colonia completamente resistente. Sin embargo, las mutaciones cromosómicas también confieren un costo de aptitud. Por ejemplo, una mutación ribosómica puede proteger una célula bacteriana al cambiar el sitio de unión de un antibiótico, pero puede resultar en una tasa de crecimiento más lenta. Además, algunas mutaciones adaptativas pueden propagarse no solo a través de la herencia sino también a través de la transferencia horizontal de genes. El mecanismo más común de transferencia horizontal de genes es la transferencia de plásmidos portadores de genes de resistencia a antibióticos entre bacterias de la misma especie o de especies diferentes a través de la conjugación. Sin embargo, las bacterias también pueden adquirir resistencia a través de la transformación, como en la absorción de Streptococcus pneumoniae de fragmentos desnudos de ADN extracelular que contienen genes de resistencia a los antibióticos a la estreptomicina, a través de la transducción, como en la transferencia mediada por bacteriófagos de genes de resistencia a la tetraciclina. entre cepas de S. pyogenes, o a través de agentes de transferencia de genes, que son partículas producidas por la célula huésped que se asemejan a estructuras de bacteriófagos y son capaces de transferir ADN.
La resistencia a los antibióticos se puede introducir artificialmente en un microorganismo a través de protocolos de laboratorio, a veces se usa como un marcador seleccionable para examinar los mecanismos de transferencia de genes o para identificar individuos que absorbieron una porción de ADN que incluía el gen de resistencia y otro gen de interés.
Hallazgos recientes no muestran la necesidad de grandes poblaciones de bacterias para la aparición de resistencia a los antibióticos. Pequeñas poblaciones de Escherichia coli en un gradiente de antibióticos pueden volverse resistentes. Cualquier entorno heterogéneo con respecto a los gradientes de nutrientes y antibióticos puede facilitar la resistencia a los antibióticos en pequeñas poblaciones bacterianas. Los investigadores plantean la hipótesis de que el mecanismo de evolución de la resistencia se basa en cuatro mutaciones SNP en el genoma de E. coli producida por el gradiente de antibiótico.
En un estudio, que tiene implicaciones para la microbiología espacial, una cepa no patógena E. coli MG1655 estuvo expuesto a niveles traza del antibiótico de amplio espectro cloranfenicol, bajo microgravedad simulada (LSMMG, o Low Shear Modeled Microgravity) durante 1000 generaciones. La cepa adaptada adquirió resistencia no solo al cloranfenicol, sino también resistencia cruzada a otros antibióticos; esto contrastaba con la observación en la misma cepa, que se adaptó a más de 1000 generaciones bajo LSMMG, pero sin ninguna exposición a antibióticos; la cepa en este caso no adquirió tal resistencia. Por lo tanto, independientemente de dónde se usen, el uso de un antibiótico probablemente daría lugar a una resistencia persistente a ese antibiótico, así como a una resistencia cruzada a otros antimicrobianos.
En los últimos años, la aparición y propagación de las β-lactamasas denominadas carbapenemasas se ha convertido en una importante crisis sanitaria. Una de estas carbapenemasas es la metalobetalactamasa 1 de Nueva Delhi (NDM-1), una enzima que hace que las bacterias sean resistentes a una amplia gama de antibióticos betalactámicos. Las bacterias más comunes que producen esta enzima son gramnegativas como E. coli y Klebsiella pneumoniae, pero el gen de la NDM-1 puede propagarse de una cepa de bacterias a otra mediante la transferencia horizontal de genes.
Virus
Se utilizan medicamentos antivirales específicos para tratar algunas infecciones virales. Estos medicamentos evitan que los virus se reproduzcan al inhibir las etapas esenciales del ciclo de replicación del virus en las células infectadas. Los antivirales se usan para tratar el VIH, la hepatitis B, la hepatitis C, la influenza, los virus del herpes, incluido el virus de la varicela zoster, el citomegalovirus y el virus de Epstein-Barr. Con cada virus, algunas cepas se han vuelto resistentes a los medicamentos administrados.
Los medicamentos antivirales generalmente se dirigen a componentes clave de la reproducción viral; por ejemplo, el oseltamivir se dirige a la neuraminidasa de influenza, mientras que los análogos de guanosina inhiben la ADN polimerasa viral. Así, la resistencia a los antivirales se adquiere a través de mutaciones en los genes que codifican las proteínas dianas de los fármacos.
La resistencia a los antivirales del VIH es problemática, e incluso han evolucionado cepas resistentes a múltiples fármacos. Una fuente de resistencia es que muchos medicamentos actuales contra el VIH, incluidos los NRTI y los NNRTI, se dirigen a la transcriptasa inversa; sin embargo, la transcriptasa inversa del VIH-1 es muy propensa a errores y, por lo tanto, las mutaciones que confieren resistencia surgen rápidamente. Las cepas resistentes del virus del VIH emergen rápidamente si solo se usa un medicamento antiviral. El uso de tres o más medicamentos juntos, denominado terapia combinada, ha ayudado a controlar este problema, pero se necesitan nuevos medicamentos debido a la continua aparición de cepas de VIH resistentes a los medicamentos.
Hongos
Las infecciones por hongos son causa de alta morbimortalidad en personas inmunocomprometidas, como las que tienen VIH/SIDA, tuberculosis o reciben quimioterapia. Los hongos Candida, Cryptococcus neoformans y Aspergillus fumigatus causan la mayoría de estas infecciones y en todos ellos se presenta resistencia antifúngica. La resistencia a múltiples fármacos en hongos está aumentando debido al uso generalizado de fármacos antimicóticos para tratar infecciones en personas inmunodeprimidas.
De particular interés, las especies de Candida resistentes al fluconazol han sido destacadas como un problema creciente por los CDC. Más de 20 especies de Candida pueden causar infección por candidiasis, la más común de las cuales es Candida albicans. Las levaduras Candida normalmente habitan en la piel y las membranas mucosas sin causar infección. Sin embargo, el crecimiento excesivo de Candida puede provocar candidiasis. Algunas cepas de Candida se están volviendo resistentes a los agentes antifúngicos de primera y segunda línea, como los azoles y las equinocandinas.
Parásitos
Los parásitos protozoarios que causan las enfermedades paludismo, tripanosomiasis, toxoplasmosis, criptosporidiosis y leishmaniasis son patógenos humanos importantes.
Los parásitos de la malaria que son resistentes a los medicamentos disponibles actualmente para las infecciones son comunes y esto ha llevado a mayores esfuerzos para desarrollar nuevos medicamentos. También se ha notificado resistencia a fármacos desarrollados recientemente, como la artemisinina. El problema de la resistencia a los medicamentos en la malaria ha impulsado los esfuerzos para desarrollar vacunas.
Los tripanosomas son protozoos parásitos que causan la tripanosomiasis africana y la enfermedad de Chagas (tripanosomiasis americana). No existen vacunas para prevenir estas infecciones, por lo que se utilizan medicamentos como la pentamidina y la suramina, el benznidazol y el nifurtimox para tratar las infecciones. Estos medicamentos son efectivos, pero se han informado infecciones causadas por parásitos resistentes.
La leishmaniasis es causada por protozoos y es un importante problema de salud pública en todo el mundo, especialmente en países subtropicales y tropicales. La resistencia a los medicamentos se ha 'convertido en una preocupación importante'.
Historia
Las décadas de 1950 a 1970 representaron la edad de oro del descubrimiento de antibióticos, donde se descubrieron innumerables clases nuevas de antibióticos para tratar enfermedades previamente incurables, como la tuberculosis y la sífilis. Sin embargo, desde entonces, el descubrimiento de nuevas clases de antibióticos ha sido casi inexistente y representa una situación que es especialmente problemática si se tiene en cuenta la resiliencia de las bacterias que se muestra a lo largo del tiempo y el continuo uso indebido y excesivo de antibióticos en el tratamiento.
El fenómeno de la resistencia a los antimicrobianos causado por el uso excesivo de antibióticos fue predicho ya en 1945 por Alexander Fleming, quien dijo: "Puede llegar el momento en que cualquiera pueda comprar penicilina en las tiendas". Luego existe el peligro de que el hombre ignorante se administre fácilmente una dosis insuficiente y, al exponer a sus microbios a cantidades no letales de la droga, los haga resistentes." Sin la creación de antibióticos nuevos y más fuertes, una era en la que las infecciones comunes y las lesiones menores pueden causar la muerte, y en la que los procedimientos complejos, como la cirugía y la quimioterapia, se vuelven demasiado riesgosos, es una posibilidad muy real. La resistencia a los antimicrobianos puede dar lugar a epidemias de enormes proporciones si no se toman medidas preventivas. En la actualidad, la resistencia antimicrobiana actual conduce a estadías hospitalarias más largas, costos médicos más altos y una mayor mortalidad.
Sociedad y cultura
Desde mediados de la década de 1980, las compañías farmacéuticas han invertido en medicamentos para el cáncer o enfermedades crónicas que tienen un mayor potencial para generar dinero y han "quitado el énfasis o eliminado el desarrollo de antibióticos". El 20 de enero de 2016 en el Foro Económico Mundial en Davos, Suiza, más de "80 empresas farmacéuticas y de diagnóstico" de todo el mundo pidieron "modelos comerciales transformadores" a nivel mundial para estimular la investigación y el desarrollo de antibióticos y en el "uso mejorado de pruebas de diagnóstico que pueden identificar rápidamente el organismo infeccioso".
Marcos legales
Algunos académicos de la salud global han argumentado que se necesita un marco legal global para prevenir y controlar la resistencia a los antimicrobianos. Por ejemplo, se podrían utilizar políticas globales vinculantes para crear estándares de uso de antimicrobianos, regular la comercialización de antibióticos y fortalecer los sistemas de vigilancia global. Asegurar el cumplimiento de las partes involucradas es un desafío. Las políticas globales de resistencia a los antimicrobianos podrían aprender lecciones del sector ambiental mediante la adopción de estrategias que han hecho que los acuerdos ambientales internacionales sean exitosos en el pasado, tales como: sanciones por incumplimiento, asistencia para la implementación, reglas de toma de decisiones por voto mayoritario, un panel científico independiente y compromisos específicos.
Estados Unidos
Para el presupuesto de Estados Unidos de 2016, el presidente estadounidense Barack Obama propuso casi duplicar la cantidad de fondos federales para "combatir y prevenir" resistencia a los antibióticos a más de $ 1.2 mil millones. Muchas agencias de financiación internacionales como USAID, DFID, SIDA y Bill & La Fundación Melinda Gates ha prometido dinero para desarrollar estrategias para contrarrestar la resistencia a los antimicrobianos.
El 27 de marzo de 2015, la Casa Blanca publicó un plan integral para abordar la creciente necesidad de las agencias de combatir el aumento de bacterias resistentes a los antibióticos. El Grupo de Trabajo para Combatir las Bacterias Resistentes a los Antibióticos desarrolló El Plan de Acción Nacional para Combatir las Bacterias Resistentes a los Antibióticos con la intención de proporcionar una hoja de ruta para guiar a los EE. UU. en el desafío de la resistencia a los antibióticos y con la esperanza de salvar muchas vidas.. Este plan describe los pasos necesarios que ha tomado el gobierno federal durante los próximos cinco años para prevenir y contener los brotes de infecciones resistentes a los antibióticos; mantener la eficacia de los antibióticos que ya están en el mercado; y para ayudar a desarrollar futuros diagnósticos, antibióticos y vacunas.
El Plan de acción se desarrolló en torno a cinco objetivos centrados en el fortalecimiento de la atención médica, la medicina veterinaria de salud pública, la agricultura, la investigación y la seguridad alimentaria y la fabricación. Estos objetivos, enumerados por la Casa Blanca, son los siguientes:
- Despacio la emergencia de las bacterias resistentes e impida la propagación de infecciones resistentes
- Fortalecimiento de los esfuerzos nacionales de vigilancia de la salud para combatir la resistencia
- Desarrollo y uso de pruebas diagnósticas rápidas e innovadoras para la identificación y caracterización de bacterias resistentes
- Acelerar la investigación básica y aplicada y el desarrollo para nuevos antibióticos, otras terapias y vacunas
- Mejorar la colaboración y las capacidades internacionales para la prevención, vigilancia, control y investigación y desarrollo antibióticos
Los siguientes son objetivos establecidos para cumplir para 2020:
- Establecimiento de programas antimicrobianos en entornos hospitalarios agudos
- Reducción de la prescripción antibiótica inapropiada y uso en al menos un 50% en los ajustes ambulatorios y un 20% en los ajustes de los pacientes
- Establecimiento de programas estatales de prevención de la resistencia antibiótica en los 50 estados
- Eliminación del uso de antibióticos de importancia médica para la promoción del crecimiento en animales productores de alimentos.
Reino Unido
Public Health England informó que el número total de infecciones resistentes a los antibióticos en Inglaterra aumentó un 9 %, de 55 812 en 2017 a 60 788 en 2018, pero el consumo de antibióticos se redujo en un 9 %, de 20,0 a 18,2 dosis diarias definidas por cada 1000 habitantes por día entre 2014 y 2018.
Políticas
Según la Organización Mundial de la Salud, los formuladores de políticas pueden ayudar a combatir la resistencia fortaleciendo la capacidad de laboratorio y de seguimiento de la resistencia y regulando y promoviendo el uso adecuado de los medicamentos. Los formuladores de políticas y la industria pueden ayudar a enfrentar la resistencia al: fomentar la innovación y la investigación y el desarrollo de nuevas herramientas; y promover la cooperación y el intercambio de información entre todas las partes interesadas.
Más investigación
Pruebas virales rápidas
La investigación clínica para descartar infecciones bacterianas a menudo se realiza en pacientes con infecciones respiratorias agudas pediátricas. Actualmente no está claro si las pruebas virales rápidas afectan el uso de antibióticos en niños.
Vacunas
Por lo general, los microorganismos no desarrollan resistencia a las vacunas porque las vacunas reducen la propagación de la infección y se dirigen al patógeno de múltiples maneras en el mismo huésped y posiblemente de diferentes maneras entre diferentes huéspedes. Además, si aumenta el uso de vacunas, existe evidencia de que disminuirán las cepas de patógenos resistentes a los antibióticos; la necesidad de antibióticos disminuirá naturalmente a medida que las vacunas prevengan la infección antes de que ocurra. Sin embargo, existen casos bien documentados de resistencia a las vacunas, aunque estos suelen ser un problema mucho menor que la resistencia a los antimicrobianos.
Aunque teóricamente prometedoras, las vacunas antiestafilocócicas han demostrado una eficacia limitada debido a la variación inmunológica entre las especies de Staphylococcus y la duración limitada de la eficacia de los anticuerpos producidos. Se están desarrollando y probando vacunas más eficaces.
Dos ensayos de registro han evaluado vacunas candidatas en estrategias de inmunización activa contra S. aureus infección. En un ensayo de fase II, una vacuna bivalente de proteínas capsulares 5 & 8 se probó en 1804 pacientes en hemodiálisis con una fístula primaria o un acceso vascular de injerto sintético. Después de 40 semanas después de la vacunación, se observó un efecto protector contra S. aureus, pero no a las 54 semanas después de la vacunación. En base a estos resultados, se realizó un segundo ensayo que no logró demostrar eficacia.
Merck probó V710, una vacuna dirigida a IsdB, en un ensayo aleatorizado ciego en pacientes sometidos a esternotomía mediana. El ensayo se terminó después de que se encontrara una tasa más alta de muertes relacionadas con fallas multiorgánicas en los receptores de V710. Los receptores de la vacuna que desarrollaron S. aureus tenían cinco veces más probabilidades de morir que los receptores de control que desarrollaron S. aureus infección.
Numerosos investigadores han sugerido que una vacuna de múltiples antígenos sería más eficaz, pero la falta de biomarcadores que definan la inmunidad protectora humana mantiene estas propuestas en el ámbito lógico, pero estrictamente hipotético.
Terapia alternante
La terapia alterna es un método propuesto en el que se toman dos o tres antibióticos en una rotación en lugar de tomar solo un antibiótico, de modo que las bacterias resistentes a un antibiótico mueren cuando se toma el siguiente antibiótico. Los estudios han encontrado que este método reduce la velocidad a la que emergen bacterias resistentes a los antibióticos in vitro en relación con un solo fármaco durante todo el tiempo.
Los estudios han encontrado que las bacterias que desarrollan resistencia a los antibióticos hacia un grupo de antibióticos pueden volverse más sensibles a otros. Este fenómeno se puede utilizar para seleccionar contra bacterias resistentes utilizando un enfoque denominado ciclo de sensibilidad colateral, que recientemente se ha descubierto que es relevante en el desarrollo de estrategias de tratamiento para infecciones crónicas causadas por Pseudomonas aeruginosa. A pesar de su promesa, los estudios clínicos y experimentales a gran escala revelaron evidencia limitada de susceptibilidad al ciclo de antibióticos en varios patógenos.
Desarrollo de nuevos fármacos
Desde el descubrimiento de los antibióticos, los esfuerzos de investigación y desarrollo (I+D) han proporcionado nuevos medicamentos a tiempo para tratar las bacterias que se volvieron resistentes a los antibióticos más antiguos, pero en la década de 2000 ha habido preocupación de que el desarrollo se haya ralentizado lo suficiente como para enfermar gravemente. las personas pueden quedarse sin opciones de tratamiento. Otra preocupación es que los médicos pueden volverse reacios a realizar cirugías de rutina debido al mayor riesgo de infecciones dañinas. Los tratamientos de respaldo pueden tener efectos secundarios graves; por ejemplo, los antibióticos como los aminoglucósidos (como amikacina, gentamicina, kanamicina, estreptomicina, etc.) utilizados para el tratamiento de la tuberculosis resistente a los medicamentos y la fibrosis quística pueden causar trastornos respiratorios, sordera e insuficiencia renal. La crisis potencial en cuestión es el resultado de una marcada disminución en la investigación y el desarrollo de la industria. La mala inversión financiera en la investigación de antibióticos ha exacerbado la situación. La industria farmacéutica tiene pocos incentivos para invertir en antibióticos debido al alto riesgo y porque es menos probable que los rendimientos financieros potenciales cubran el costo del desarrollo que para otros productos farmacéuticos. En 2011, Pfizer, una de las últimas compañías farmacéuticas importantes en desarrollar nuevos antibióticos, cerró su principal esfuerzo de investigación, citando bajos rendimientos para los accionistas en relación con los medicamentos para enfermedades crónicas. Sin embargo, las pequeñas y medianas empresas farmacéuticas siguen activas en la investigación de fármacos antibióticos. En particular, aparte de las metodologías clásicas de química sintética, los investigadores han desarrollado una plataforma de biología sintética combinatoria a nivel de una sola célula en una forma de cribado de alto rendimiento para diversificar nuevos lantipéptidos.
En los Estados Unidos, las compañías farmacéuticas y la administración del presidente Barack Obama han estado proponiendo cambiar los estándares por los cuales la FDA aprueba los antibióticos dirigidos a los organismos resistentes.
El 18 de septiembre de 2014, Obama firmó una orden ejecutiva para implementar las recomendaciones propuestas en un informe del Consejo de Asesores sobre Ciencia y Tecnología (PCAST, por sus siglas en inglés) del presidente que describe estrategias para optimizar los ensayos clínicos y acelerar la I+D de nuevos antibióticos. Entre las propuestas:
- Crear una 'red de ensayos clínicos nacionales para pruebas antibióticas' que rápidamente inscriba a los pacientes identificados para tener infecciones bacterianas peligrosas. La red permitirá probar múltiples nuevos agentes de diferentes empresas simultáneamente por su seguridad y eficacia.
- Establecer una vía de uso médico especial (SMU) para que la FDA apruebe nuevos agentes antimicrobianos para su uso en poblaciones de pacientes limitadas, acortar el cronograma de aprobación para nuevos fármacos para que los pacientes con infecciones severas puedan beneficiarse lo antes posible.
- Proporcione incentivos económicos, especialmente para el desarrollo de nuevas clases de antibióticos, para compensar los costos empinados de R plagaD que alejan a la industria para desarrollar antibióticos.
Los científicos han comenzado a utilizar enfoques computacionales avanzados con supercomputadoras para desarrollar nuevos derivados de antibióticos para combatir la resistencia a los antimicrobianos.
Biomateriales
El uso de alternativas sin antibióticos en el tratamiento de infecciones óseas puede ayudar a disminuir el uso de antibióticos y, por lo tanto, la resistencia a los antimicrobianos. Se ha demostrado que el material de regeneración ósea, el vidrio bioactivo S53P4, inhibe eficazmente el crecimiento bacteriano de hasta 50 bacterias clínicamente relevantes, incluidas MRSA y MRSE.
Nanomateriales
Durante las últimas décadas, los nanomateriales de cobre y plata han demostrado características atractivas para el desarrollo de una nueva familia de agentes antimicrobianos.
Redescubrimiento de tratamientos antiguos
De manera similar a la situación en la terapia contra la malaria, donde se han encontrado tratamientos exitosos basados en recetas antiguas, ya ha habido cierto éxito en encontrar y probar medicamentos antiguos y otros tratamientos que son efectivos contra las bacterias AMR.
Diagnóstico rápido
Distinguir las infecciones que requieren antibióticos de las autolimitadas es un desafío clínico. Para guiar el uso apropiado de los antibióticos y prevenir la evolución y propagación de la resistencia a los antimicrobianos, se necesitan pruebas de diagnóstico que brinden a los médicos resultados procesables oportunos.
La enfermedad febril aguda es una razón común para buscar atención médica en todo el mundo y una causa importante de morbilidad y mortalidad. En áreas con incidencia de paludismo decreciente, muchos pacientes febriles reciben tratamiento inadecuado para paludismo, y en ausencia de una prueba de diagnóstico simple para identificar causas alternativas de fiebre, los médicos suponen que una enfermedad febril no palúdica es más probable que sea una infección bacteriana, lo que conduce a Uso inapropiado de antibióticos. Múltiples estudios han demostrado que el uso de pruebas de diagnóstico rápido de malaria sin herramientas confiables para distinguir otras causas de fiebre ha resultado en un mayor uso de antibióticos.
Las pruebas de susceptibilidad a los antimicrobianos (AST) pueden ayudar a los profesionales a evitar la prescripción de antibióticos innecesarios al estilo de la medicina de precisión y ayudarlos a prescribir antibióticos efectivos, pero con el enfoque tradicional podría llevar de 12 a 48 horas. Las pruebas rápidas, posibles gracias a las innovaciones de diagnóstico molecular, se definen como "ser factibles dentro de un turno de trabajo de 8 horas". El progreso ha sido lento debido a una variedad de razones que incluyen el costo y la regulación.
Las técnicas ópticas como la microscopía de contraste de fase en combinación con el análisis de una sola célula son otro método poderoso para monitorear el crecimiento bacteriano. En 2017, científicos de Suecia publicaron un método que aplica principios de microfluidos y seguimiento celular para monitorear la respuesta bacteriana a los antibióticos en menos de 30 minutos de tiempo total de manipulación. Recientemente, esta plataforma ha avanzado acoplando un chip microfluídico con pinzas ópticas para aislar bacterias con fenotipo alterado directamente de la matriz analítica.
Terapia de fagos
La fagoterapia es el uso terapéutico de bacteriófagos para tratar infecciones bacterianas patógenas. La terapia con fagos tiene muchas aplicaciones potenciales en la medicina humana, así como en la odontología, la ciencia veterinaria y la agricultura.
La fagoterapia se basa en el uso de bacteriófagos naturales para infectar y lisar bacterias en el sitio de infección en un huésped. Debido a los avances actuales en genética y biotecnología, es posible que estos bacteriófagos se puedan fabricar para tratar infecciones específicas. Los fagos pueden modificarse mediante bioingeniería para atacar infecciones bacterianas multirresistentes, y su uso implica el beneficio adicional de prevenir la eliminación de bacterias beneficiosas en el cuerpo humano. Los fagos destruyen las paredes y membranas de las células bacterianas mediante el uso de proteínas líticas que matan a las bacterias haciendo muchos agujeros de adentro hacia afuera. Los bacteriófagos pueden incluso poseer la capacidad de digerir la biopelícula que desarrollan muchas bacterias que las protegen de los antibióticos para infectar y matar bacterias de manera efectiva. La bioingeniería puede desempeñar un papel en la creación de bacteriófagos exitosos.
Comprender las interacciones mutuas y las evoluciones de las poblaciones de bacterias y fagos en el entorno de un cuerpo humano o animal es esencial para una terapia de fagos racional.
Los bacteriófagos se utilizan contra las bacterias resistentes a los antibióticos en Georgia (Instituto George Eliava) y en un instituto en Wrocław, Polonia. Los cócteles de bacteriófagos son medicamentos comunes que se venden sin receta en las farmacias de los países del este. En Bélgica, cuatro pacientes con infecciones musculoesqueléticas graves recibieron terapia con bacteriófagos con antibióticos concomitantes. Después de un ciclo único de terapia con fagos, no se produjo recurrencia de la infección y no se detectaron efectos secundarios graves relacionados con la terapia.
Contenido relacionado
Prueba de Mantoux
Fenilcetonuria
Enzima