Reordenamiento de Beckmann
El reordenamiento de Beckmann, llamado así por el químico alemán Ernst Otto Beckmann (1853-1923), es un reordenamiento de un grupo funcional oxima a amidas sustituidas. El reordenamiento también se ha realizado con éxito en haloiminas y nitronas. Las oximas y haloiminas cíclicas producen lactamas.
El reordenamiento de Beckmann a menudo es catalizado por ácido; sin embargo, se sabe que otros reactivos promueven la transposición. Estos incluyen cloruro de tosilo, cloruro de tionilo, pentacloruro de fósforo, pentóxido de fósforo, trietilamina, hidróxido de sodio, yoduro de trimetilsililo, entre otros. La fragmentación de Beckmann es otra reacción que a menudo compite con el reordenamiento, aunque la selección cuidadosa de las condiciones del reactivo promotor y del disolvente puede favorecer la formación de uno sobre el otro, dando a veces casi exclusivamente un producto. El reordenamiento ocurre estereoespecíficamente para cetoximas y N-cloro/N-fluoro iminas, siendo el grupo migrante anti-periplanar al grupo saliente en el nitrógeno. Se sabe que ciertas condiciones racemizan la geometría de la oxima, lo que conduce a la formación de ambos regioisómeros. El reordenamiento de las aldoximas ocurre con estereoespecificidad en la fase gaseosa y sin estereoespecificidad en la fase de solución. Algunas metodologías permiten el reordenamiento de aldoximas a amidas primarias, pero la fragmentación comúnmente compite en estos sistemas. El reordenamiento de nitrona también ocurre sin estereoespecificidad; el regioisómero formado tiene el nitrógeno amídico sustituido por el grupo que posee la mayor aptitud migratoria.
El reordenamiento arquetípico de Beckmann es la conversión de ciclohexanona en caprolactama a través de la oxima. La caprolactama es la materia prima en la producción de Nylon 6.
La solución de Beckmann consta de ácido acético, ácido clorhídrico y anhídrido acético, y fue ampliamente utilizada para catalizar el reordenamiento. Se han utilizado otros ácidos, tales como ácido sulfúrico, ácido polifosfórico y fluoruro de hidrógeno. El ácido sulfúrico es el ácido más utilizado para la producción de lactama comercial debido a la formación de un subproducto de sulfato de amonio cuando se neutraliza con amoníaco. El sulfato de amonio es un fertilizante agrícola común que proporciona nitrógeno y azufre.
Mecanismo de reacción
El mecanismo de reacción más común del reordenamiento de Beckmann consiste generalmente en una migración de alquilo anti-periplanar a la expulsión de un grupo saliente para formar un ion nitrilio. A esto le sigue la solvólisis a un imidato y luego la tautomerización a la amida:
Se sabe que este ión nitrilio es interceptado por otros nucleófilos, incluido el grupo saliente de la oxima.
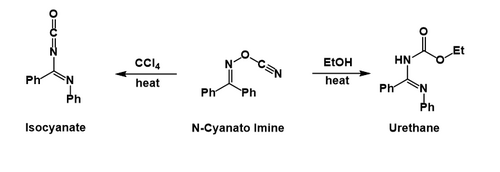
Presumiblemente, después de que el grupo fenilo migra y expulsa el cianato, este último ataca al ion nitrilio formado. En el tetracloruro de carbono, el isocianato se puede aislar, mientras que en el etanol, el uretano se forma después de la solvólisis del isocianato.
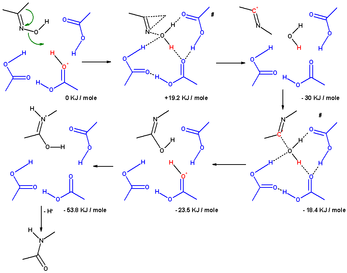
Un estudio computacional ha establecido el mecanismo que explica las moléculas de solventes y los sustituyentes. El reordenamiento de la oxima de acetona en la solución de Beckmann involucró tres moléculas de ácido acético y un protón (presente como un ion oxonio). En el estado de transición que conduce al ion iminio (complejo σ), el grupo metilo migra al átomo de nitrógeno en una reacción concertada a medida que se expulsa el grupo hidroxilo. El átomo de oxígeno en el grupo hidroxilo está estabilizado por tres moléculas de ácido acético. En el siguiente paso, el átomo de carbono electrofílico del ion nitrilo es atacado por el agua y se dona un protón al ácido acético. En el estado de transición que conduce al imidato, el átomo de oxígeno del agua está coordinado con otros 4 átomos. En el tercer paso, un paso de isomerización protona el átomo de nitrógeno que conduce a la amida.
El mismo cálculo con un ion hidroxonio y 6 moléculas de agua tiene el mismo resultado, pero cuando el sustituyente que migra es un grupo fenilo, el mecanismo favorece la formación de un complejo π intermedio de tres miembros. Este complejo π no se encuentra en el H3O+(H2O)6.
Con la ciclohexanona-oxima, el alivio de la tensión del anillo da como resultado un tercer mecanismo de reacción, que conduce directamente a la caprolactama protonada en un solo paso concertado sin la formación intermedia de un complejo π o un complejo σ.
Reacción de Beckmann asistida por cloruro cianúrico
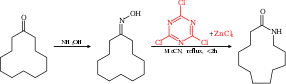
El reordenamiento de Beckmann puede volverse catalítico utilizando cloruro cianúrico y cloruro de zinc como cocatalizador. Por ejemplo, la ciclododecanona se puede convertir en la lactama correspondiente, el monómero utilizado en la producción de Nylon 12.
El mecanismo de reacción para esta reacción se basa en un ciclo catalítico con cloruro cianúrico que activa el grupo hidroxilo a través de una sustitución aromática nucleófila. El producto de reacción se desaloja y se reemplaza por un nuevo reactivo a través de un complejo de Meisenheimer intermedio.
Fragmentación de Beckmann
La fragmentación de Beckmann es una reacción que frecuentemente compite con el reordenamiento de Beckmann. Cuando el grupo α de la oxima es capaz de estabilizar la formación de carbocationes, la fragmentación se convierte en una vía de reacción viable. La reacción genera un nitrilo y un carbocatión, que se interceptan rápidamente para formar una variedad de productos. El nitrilo también se puede hidrolizar en condiciones de reacción para dar ácidos carboxílicos. Diferentes condiciones de reacción pueden favorecer la fragmentación sobre el reordenamiento.
Los centros de carbono cuaternario promueven la fragmentación al estabilizar la formación de carbocationes a través de la hiperconjugación. Como se muestra en la imagen de arriba, el "estable" se forma un carbocatión, que luego pierde un hidrógeno para dar lugar a un sitio de insaturación. Los átomos de oxígeno y nitrógeno también promueven la fragmentación a través de la formación de cetonas e iminas respectivamente.
El azufre también es capaz de promover la fragmentación, aunque en un rango mayor que el oxígeno o el nitrógeno.
El silicio es capaz de dirigir la fragmentación a través del efecto beta-silicio.
El carbocatión intermedio en esta reacción es interceptado por el fluoruro nucleofílico del trifluoruro de dietilaminoazufre (DAST):
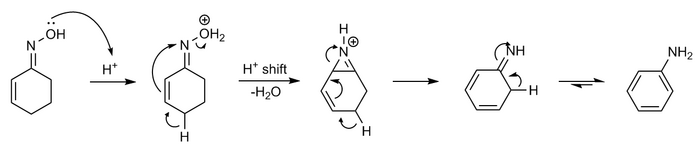
Reacción de Semmler-Wolff
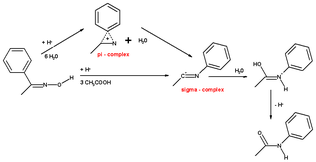
La oxima de ciclohexenona con ácido forma anilina en una reacción de deshidratación – aromatización llamada reacción de Semmler-Wolff o aromatización de Wolff
El mecanismo se puede mostrar a continuación:
La reacción es intrínsecamente un caso especial de reordenamiento de Beckmann combinado con la participación de grupos vecinos.
Aplicaciones en síntesis de fármacos
Una síntesis industrial de paracetamol desarrollada por Hoechst-Celanese implica la conversión de una metilcetona en acetanilida a través de un reordenamiento de Beckmann.
Se afirma que el reordenamiento térmico que ocurre en la síntesis de ketamina es un reordenamiento de Beckmann según: url.