Reglas de pauling
Las reglas de Pauling son cinco reglas publicadas por Linus Pauling en 1929 para predecir y racionalizar las estructuras cristalinas de compuestos iónicos.
Primera regla: la regla de la relación de radio
Para los sólidos iónicos típicos, las caciones son más pequeñas que los aniones, y cada cation está rodeado de aniones coordinadas que forman un poliedro. La suma de los radios iónicos determina la distancia cation-anion, mientras que la proporción de radio cation-anion r+/r− − {displaystyle ¿Qué? (o rc/ra{displaystyle ¿Qué?) determina el número de coordinación (C.N.) de la cation, así como la forma del poliedro coordinado de los aniones.
Para los números de coordinación y los poliedros correspondientes en la siguiente tabla, Pauling derivó matemáticamente la relación de radio mínima para la cual el catión está en contacto con el número dado de aniones (considerando los iones como esferas rígidas) . Si el catión es más pequeño, no estará en contacto con los aniones, lo que resulta en inestabilidad que conduce a un número de coordinación más bajo.

| C.N. | Polyhedron | Radius ratio |
|---|---|---|
| 3 | triangular | 0.155 |
| 4 | tetrahedron | 0.225 |
| 6 | octaedro | 0.414 |
| 7 | capped octahedron | 0,592 |
| 8 | antiprisma cuadrado (anticube) | 0.645 |
| 8 | cube | 0.732 |
| 9 | prisma triangular triaugmentado | 0.732 |
| 12 | cuboctahedron | 1.00 |
Los tres diagramas a la derecha corresponden a coordinación octaedral con un número de coordinación de seis: cuatro aniones en el plano de los diagramas, y dos (no se muestran) arriba y debajo de este plano. El diagrama central muestra la relación radiofónica mínima. La cación y los dos aniones forman un triángulo derecho, con 2r− − =2()r− − +r+){displaystyle 2r_{-}={sqrt {2}(r_{-}+r_{+}) }o 2r− − =r− − +r+{displaystyle {sqrt {2}r_{-}=r_{-}+r_{+}. Entonces... r+=()2− − 1)r− − =0.414r− − {displaystyle r_{+}=({sqrt {2}-1)r_{-}=0.414r_{-}. Las pruebas geométricas similares producen las proporciones mínimas de radio para los casos altamente simétricos C.N. = 3, 4 y 8.


Para C.N. = 6 y una relación de radio mayor que el mínimo, el cristal es más estable ya que el catión todavía está en contacto con seis aniones, pero los aniones están más alejados entre sí por lo que se reduce su repulsión mutua. Entonces se puede formar un octaedro con una relación de radio mayor o igual a 0,414, pero a medida que la relación aumenta por encima de 0,732, una geometría cúbica se vuelve más estable. Esto explica por qué Na+ en NaCl con una relación de radio de 0,55 tiene coordinación octaédrica, mientras que Cs+ en CsCl con una relación de radio de 0,93 tiene coordinación cúbica.
Si la relación de radio es menor que el mínimo, dos aniones tenderán a separarse y los cuatro restantes se reorganizarán en una geometría tetraédrica donde todos estarán en contacto con el catión.
Las reglas de relación de radio son una primera aproximación que tiene cierto éxito en la predicción de números de coordinación, pero existen muchas excepciones. En un conjunto de más de 5.000 óxidos, sólo el 66% de los entornos de coordinación concuerdan con la primera regla de Pauling. Los óxidos formados con cationes de metales alcalinos o alcalinotérreos que contienen múltiples coordinaciones catiónicas son desviaciones comunes de esta regla.
Segunda regla: la regla de valencia electrostática
Para una determinada cación, Pauling definió el Fuerza de unión electrostática a cada aión coordinada s=z. . {displaystyle s={frac {Z}{nu} }, donde z es el cargo de cation y ν es el número de coordinación de cation. Una estructura iónica estable está dispuesta a preservar electroneutralidad local, por lo que la suma de las fortalezas de los lazos electrostáticos a un aión equivale a la carga en ese anión.
- . . =. . isi{displaystyle xi =sum ¿Qué?
Donde . . {displaystyle xi } es la carga de anión y la suma es sobre las caciones adyacentes. Para sólidos simples, si{displaystyle S_{i} son iguales para todas las caciones coordinadas a un anión dado, por lo que el número de coordinación del anión es la carga de anión dividida por cada unión electrostática fuerza. En la tabla se dan algunos ejemplos.
| Cation | Radius ratio | Cation C.N. | Electrostático fuerza de unión | Anion C.N. |
|---|---|---|---|---|
| Li+ | 0.34 | 4 | 0,25 | 8 |
| Mg2+ | 0.47 | 6 | 0.33 | 6 |
| Sc3+ | 0.60 | 6 | 0.5 | 4 |
Pauling demostró que esta regla es útil para limitar las posibles estructuras a considerar para cristales más complejos como la ortoclasa mineral de aluminosilicato, KAlSi 3O8, con tres cationes diferentes. Sin embargo, a partir del análisis de datos de óxidos de la Base de datos de estructuras cristalinas inorgánicas (ICSD), el resultado mostró que solo el 20% de todos los átomos de oxígeno coincidían con la predicción de la segunda regla (usando un límite de 0,01).
Tercera regla: compartir esquinas, aristas y caras del poliedro
El hecho de que dos poliedros aniónicos compartan aristas y, en particular, caras, disminuye la estabilidad de una estructura iónica. Compartir esquinas no disminuye tanto la estabilidad, por lo que (por ejemplo) los octaedros pueden compartir esquinas entre sí.
La disminución de la estabilidad se debe al hecho de que compartir bordes y caras coloca a los cationes más cerca entre sí, de modo que aumenta la repulsión electrostática catión-catión. El efecto es mayor para cationes con carga alta y C.N bajo. (especialmente cuando r+/r- se acerca al límite inferior de la estabilidad poliédrica). Generalmente los elementos más pequeños cumplen mejor la regla.
Como ejemplo, Pauling consideró las tres formas minerales del dióxido de titanio, cada una con un número de coordinación de 6 para los cationes Ti4+. . La forma más estable (y más abundante) es el rutilo, en el que los octaedros de coordinación están dispuestos de modo que cada uno comparte sólo dos aristas (y ninguna cara) con los octaedros contiguos. Las otras dos formas, menos estables, son la brookita y la anatasa, en las que cada octaedro comparte tres y cuatro aristas respectivamente con los octaedros contiguos.
Cuarta regla: cristales que contienen diferentes cationes
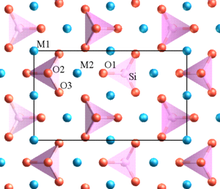
En un cristal que contiene diferentes cationes, aquellos de alta valencia y pequeño número de coordinación tienden a no compartir elementos poliédricos entre sí. Esta regla tiende a aumentar la distancia entre cationes altamente cargados, de modo que se reduce la repulsión electrostática entre ellos.
Uno de los ejemplos de Pauling es el olivino, M2SiO4, donde M es una mezcla de Mg2+ en algunos sitios y Fe2+ en otros. La estructura contiene tetraedros SiO4 distintos que no comparten oxígeno (en las esquinas, bordes o caras). juntos. Los compuestos de valencia inferior Mg2+ y Fe2+ los cationes están rodeados de poliedros que comparten oxígeno.
Quinta regla: la regla de la parsimonia
El número de tipos esencialmente diferentes de constituyentes en un cristal tiende a ser pequeño. Las unidades repetidas tenderán a ser idénticas porque cada átomo de la estructura es más estable en un entorno específico. Puede haber dos o tres tipos de poliedros, como tetraedros u octaedros, pero no habrá muchos tipos diferentes.
Limitación
En un estudio de 5000 óxidos, sólo el 13% de ellos satisfacen las últimas 4 reglas, lo que indica una universalidad limitada de las reglas de Pauling.
Contenido relacionado
Ley de Fick
Fuerza nuclear débil
Dalton (unidad)
Fuerza nuclear fuerte
Cátodo








