Regla de los 18 electrones
La regla de los 18 electrones es una regla empírica química que se utiliza principalmente para predecir y racionalizar fórmulas para complejos estables de metales de transición, especialmente compuestos organometálicos. La regla se basa en el hecho de que los orbitales de valencia en la configuración electrónica de los metales de transición constan de cinco orbitales (n−1)d, un orbital ns y tres orbitales np, donde n es el número cuántico principal. Estos orbitales pueden acomodar colectivamente 18 electrones como pares de electrones enlazantes o no enlazantes. Esto significa que la combinación de estos nueve orbitales atómicos con orbitales de ligando crea nueve orbitales moleculares que son enlazantes metal-ligando o no enlazantes. Cuando un complejo metálico tiene 18 electrones de valencia, se dice que ha alcanzado la misma configuración electrónica que el gas noble en el período, lo que le otorga estabilidad al complejo. Los complejos de metales de transición que se apartan de la regla suelen ser interesantes o útiles porque tienden a ser más reactivos. La regla no resulta útil para los complejos de metales que no son metales de transición. La regla fue propuesta por primera vez por el químico estadounidense Irving Langmuir en 1921.
Aplicabilidad
La regla predice de manera útil las fórmulas para complejos de bajo espín de las tríadas Cr, Mn, Fe y Co. Algunos ejemplos conocidos son el ferroceno, el pentacarbonilo de hierro, el carbonilo de cromo y el carbonilo de níquel.
Los ligandos en un complejo determinan la aplicabilidad de la regla de los 18 electrones. En general, los complejos que obedecen a la regla están compuestos al menos en parte por ligandos aceptores π (también conocidos como π-ácidos). Este tipo de ligando ejerce un campo de ligando muy fuerte, que reduce las energías de los orbitales moleculares resultantes de modo que se ocupan favorablemente. Los ligandos típicos incluyen olefinas, fosfinas y CO. Los complejos de π-ácidos típicamente presentan un metal en un estado de baja oxidación. La relación entre el estado de oxidación y la naturaleza de los ligandos se racionaliza dentro del marco del enlace π.
Consecuencias para la reactividad
Los compuestos que obedecen la regla de los 18 electrones son típicamente "inertes al intercambio". Algunos ejemplos son [Co(NH3)6]Cl3, Mo(CO)6 y [Fe(CN)6]4−. En tales casos, en general, el intercambio de ligandos ocurre a través de mecanismos de sustitución disociativa, en los que la velocidad de reacción está determinada por la velocidad de disociación de un ligando. Por otro lado, los compuestos de 18 electrones pueden ser altamente reactivos hacia los electrófilos, como los protones, y tales reacciones son asociativas en su mecanismo, siendo reacciones ácido-base.
Los complejos con menos de 18 electrones de valencia tienden a mostrar una reactividad mayor. Por lo tanto, la regla de los 18 electrones es a menudo una receta para la no reactividad, ya sea en sentido estequiométrico o catalítico.
Regla de Duodectet
Los hallazgos computacionales sugieren que los orbitales p de valencia del metal participan en la unión metal-ligando, aunque de manera débil. Sin embargo, Weinhold y Landis, en el contexto de los orbitales de enlace naturales, no cuentan los orbitales p del metal en la unión metal-ligando, aunque estos orbitales se incluyen como funciones de polarización. Esto da como resultado una regla de duodecteto (12 electrones) para cinco orbitales d y un orbital s solamente.
El consenso actual en la comunidad química general es que, a diferencia de la regla del octeto singular para los elementos del grupo principal, los metales de transición no obedecen estrictamente ni a la regla de los 12 ni a la de los 18 electrones, sino que las reglas describen el límite inferior y el límite superior del recuento de electrones de valencia respectivamente. Por lo tanto, si bien los enlaces de los orbitales d y s de los metales de transición ocurren fácilmente, la participación de los orbitales p de mayor energía y más difusos espacialmente en el enlace depende del átomo central y del entorno de coordinación.
Excepciones
Los ligandos π-donadores o σ-donadores con pequeñas interacciones con los orbitales metálicos conducen a un campo de ligando débil que aumenta las energías de los orbitales t2g. Estos orbitales moleculares se convierten en orbitales no enlazantes o débilmente antienlazantes (Δoct pequeño). Por lo tanto, la adición o eliminación de electrones tiene poco efecto sobre la estabilidad del complejo. En este caso, no hay restricción en el número de electrones d y son posibles complejos con 12–22 electrones. Un Δoct pequeño hace posible el llenado de eg* (>18 e−) y los ligandos π-donadores pueden hacer que t2g sea antienlazante (<18 e−). Estos tipos de ligandos se encuentran en la parte baja a media de la serie espectroquímica. Por ejemplo: [TiF6]2− (Ti(IV), d0, 12 e−), [Co(NH3)6]3+ (Co(III), d6, 18 e−), [Cu(OH2)6]2+ (Cu(II), d9, 21 e−).
En términos de iones metálicos, Δoct aumenta a medida que desciende un grupo y también aumenta el número de oxidación. Los campos de ligandos fuertes dan lugar a complejos de bajo espín que causan algunas excepciones a la regla de los 18 electrones.
Complejos de 16 electores
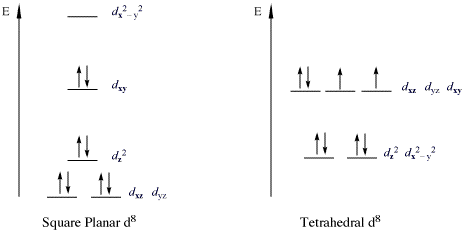
Una clase importante de complejos que violan la regla 18e son los complejos de 16 electrones con configuraciones metálicas d8. Todos los iones metálicos d8 de alto espín son octaédricos (o tetraédricos), pero los iones metálicos d8 de bajo espín son todos planos-cuadrados. Ejemplos importantes de iones metálicos d8 de bajo espín planos-cuadrados son Rh(I), Ir(I), Ni(II), Pd(II) y Pt(II). En la siguiente imagen se muestra la división de la subcapa d en complejos planos-cuadrados de bajo espín. Los ejemplos son especialmente frecuentes para los derivados de las tríadas de cobalto y níquel. Dichos compuestos son típicamente planos-cuadrados. El ejemplo más famoso es el complejo de Vaska (IrCl(CO)(PPh3)2), [PtCl4]2− y la sal de Zeise [PtCl3(η2-C2H4)]−. En estos complejos, el orbital dz2 está doblemente ocupado y no es enlazante.
Muchos ciclos catalíticos funcionan a través de complejos que alternan entre configuraciones de 18 electrones y configuraciones plano-cuadradas de 16 electrones. Algunos ejemplos son la síntesis de ácido acético de Monsanto, las hidrogenaciones, las hidroformilaciones, las isomerizaciones de olefinas y algunas polimerizaciones de alquenos.
Se pueden clasificar otras violaciones según los tipos de ligandos presentes en el centro metálico.
ligandos a granel
Los ligandos voluminosos pueden impedir la aproximación del complemento completo de ligandos que permitiría al metal alcanzar la configuración electrónica de 18. Ejemplos:
- Ti(neopentyl)4 (8 e)−)
- Cp*2Ti(C)2H4) (16 e−)
- V(CO)6 (17 e−)
- Cp*Cr(CO)3 (17 e)−)
- Pt(PtBu3)2 (14 e)−)
- Co(norbornyl)4 (13 e−)
- [FeCp2]+ (17 e)−)
A veces, estos complejos participan en interacciones agósticas con la estructura hidrocarbonada del ligando voluminoso. Por ejemplo:
- W(CO)3[P(C)6H11)3]2 tiene 16 e− pero tiene un breve contacto de enlace entre un enlace C-H y el centro W.
- Cp(PMe)3V3(14 e)−, diamagnético) tiene un enlace corto V-H con el 'alkylidene-H', por lo que la descripción del compuesto es en algún lugar entre Cp(PMe3V3) y Cp(PMe)3)V(H)(CCMe)3).
Complejos de punta alta
Los complejos metálicos de alto espín tienen orbitales ocupados individualmente y pueden no tener orbitales vacíos a los que los ligandos puedan donar densidad electrónica. En general, hay pocos o ningún ligando π-ácido en el complejo. Estos orbitales ocupados individualmente pueden combinarse con los orbitales ocupados individualmente de ligandos radicales (por ejemplo, oxígeno), o la adición de un ligando de campo fuerte puede causar el apareamiento de electrones, creando así un orbital vacío al que puede donar. Ejemplos:
- CrCl3(THF)3 (15 e)−)
- [Mn(H)2O)6]2+ (17 e)−)
- [Cu(H)2O)6]2+ (21 e)−, ver los comentarios a continuación)
Los complejos que contienen ligandos que donan fuertemente π a menudo violan la regla de los 18 electrones. Estos ligandos incluyen fluoruro (F−), óxido (O2−), nitruro (N3−), alcóxidos (RO−) e imidas (RN2−). Ejemplos:
- [CrO4]2 - 2 (16 e−)
- Mo(=NR)2Cl2 (12 e)−)
En el último caso, hay una donación sustancial de los pares solitarios de nitrógeno al Mo (por lo que el compuesto también podría describirse como un compuesto de 16 e−). Esto se puede ver a partir de la corta longitud del enlace Mo–N y del ángulo Mo–N–C(R), que es de casi 180°. Contraejemplos:
- trans-WO2(Me2PCH2CH2PMe2)2 (18 e−)
- Cp*ReO3 (18 e−)
En estos casos, los enlaces M=O son enlaces dobles "puros" (es decir, no hay donación de pares solitarios de oxígeno al metal), como se refleja en las distancias de enlace relativamente largas.
ligands de donación
Los ligandos en los que los átomos coordinantes que portan pares solitarios no enlazantes suelen estabilizar los complejos insaturados. Las amidas y los alcóxidos metálicos suelen violar la regla 18e.
Combinaciones de efectos
Los factores anteriores a veces pueden combinarse. Algunos ejemplos incluyen:
- Cp*VOCl2 (14 e)−)
- TiCl4 (8 e)−)
Cuentas de electrones superiores
Algunos complejos tienen más de 18 electrones. Ejemplos:
- Cobaltocene (19 e)−)
- Nickelocene (20 e−)
- El hexaquacobre(II) ion [Cu(H)2O)6]2+ (21 e)−)
- TM(CO)8− ()TM = Sc, Y) (20 e−)
A menudo, los casos en los que los complejos tienen más de 18 electrones de valencia se atribuyen a fuerzas electrostáticas: el metal atrae ligandos hacia sí mismo para intentar contrarrestar su carga positiva, y el número de electrones que acaba teniendo no es importante. En el caso de los metalocenos, la naturaleza quelante del ligando ciclopentadienilo estabiliza su unión al metal. Las dos observaciones siguientes son algo satisfactorias: el cobaltoceno es un fuerte donador de electrones, que forma fácilmente el catión cobaltocenio de 18 electrones; y el niqueloceno tiende a reaccionar con sustratos para dar complejos de 18 electrones, por ejemplo, CpNiCl(PR3) y CpH libre.
En el caso del niqueloceno, los dos electrones adicionales están en orbitales que son débilmente antienlazantes metal-carbono; por eso a menudo participa en reacciones donde los enlaces M-C se rompen y el conteo de electrones del metal cambia a 18.
Los sistemas de 20 electrones TM(CO)8− (TM = Sc, Y) tienen una geometría de equilibrio cúbica (Oh) y un estado electrónico fundamental singlete (1A1g). Hay un OM de valencia ocupado con simetría a2u, que está formado únicamente por orbitales de ligando sin una contribución de los orbitales atómicos metálicos. Pero los aductos TM(CO)8− (TM=Sc, Y) cumplen la regla de los 18 electrones cuando se consideran únicamente aquellos electrones de valencia, que ocupan orbitales de enlace metal-ligando.
Véase también
- Conteo de electrones – Formalismo utilizado para clasificar compuestos
- Teoría de campo ligand – Teoría orbital molecular aplicada a complejos de metal de transición
- d conteo de electrones – Descripción de la configuración de electrones
- Regla de Tolman – Regla que describe las reacciones químicas
Referencias
- ^ a b Langmuir, I. (1921). "Tipos de Valence". Ciencia. 54 (1386): 59–67. Bibcode:1921Sci....54...59L. doi:10.1126/science.54.1386.59. PMID 17843674.
- ^ Jensen, William B. (2005). "El origen de la regla 18-Electron". Journal of Chemical Education. 82 (1): 28. Bibcode:2005JChEd..82...28J. doi:10.1021/ed082p28.
- ^ Frenking, Gernot; Shaik, Sason, eds. (Mayo 2014). "Capítulo 7: La unión química en los compuestos de metal de transición". El Bono Químico: Bono Químico A través de la Tabla Periódica. Wiley-VCH. ISBN 978-3-527-33315-8.
- ^ Landis, C. R.; Weinhold, F. (2007). "Órbitales de garantía y extravalencia en el grupo principal y la unión metálica de transición". Journal of Computational Chemistry. 28 (1): 198–203. doi:10.1002/jcc.20492. PMID 17063478.
- ^ Frenking, Gernot; Fröhlich, Nikolaus (2000). "La naturaleza de la bonificación en los compuestos de transición-metal". Reseñas químicas. 100 (2): 717–774. doi:10.1021/cr980401l. PMID 11749249.
- ^ Zhao, Lili; Holzmann, Nicole; Schwerdtfeger, Peter; Frenking, Gernot (2019). "Modelos Chemicales de Bonificación y Bonificación de Compuestos Principales". Reseñas químicas. 119 (14): 8781–8845. doi:10.1021/acs.chemrev.8b00722. PMID 31251603. S2CID 195761899.
- ^ Bayse, Craig; Hall, Michael (1999). "Predicción de las geometrías de complejos de polihidratos de metal de transición simple por análisis de simetría". Journal of the American Chemical Society. 121 (6): 1348–1358. doi:10.1021/ja981965+.
- ^ King, R.B. (2000). "Strutura y unión en los iones de hidrauro de metal de transición homoléptica". Análisis de química de coordinación200–202: 813–829. doi:10.1016/S0010-8545(00)00263-0.
- ^ Girolami, Gregory; Rauchfuss, Thomas; Angelici, Robert (1999). "Experimento 20". Sintesis y Técnica en Química Inorgánica. Sausalito, California: University Science Books. ISBN 978-0-935702-48-4.
- ^ Jin, Jiaye; Yang, Tao; Xin, Ke; Wang, Guanjun; Jin, Xiaoyang; Zhou, Mingfei; Frenking, Gernot (2018-04-25). "Octacarbonyl Anion Complexes of Group Three Transition Metals [TM(CO)8]− (TM=Sc, Y, La) and the 18-Electron Rule". Angewandte Chemie International Edition. 57 (21): 6236–6241. doi:10.1002/anie.201802590. ISSN 1433-7851. PMID 29578636.
Más lectura
- Tolman, C. A. (1972). "La regla de 16 y 18 electrones en química organometállica y catalisis homogénea". Chem. Soc. Rev. 1 (3): 337. doi:10.1039/CS9720100337.