Reactivo de Grignard

Los reactivos de Grignard o compuestos de Grignard son compuestos químicos con la fórmula general R−Mg−X, donde X es un halógeno y R es un grupo orgánico, normalmente un alquilo o arilo. Dos ejemplos típicos son el cloruro de metilmagnesio Cl−Mg−CH3 y el bromuro de fenilmagnesio (C6H5)−Mg−Br. Son una subclase de los compuestos organomagnésicos.
Los compuestos de Grignard son reactivos populares en la síntesis orgánica para crear nuevos enlaces carbono-carbono. Por ejemplo, cuando reaccionan con otro compuesto halogenado R'−X' en presencia de un catalizador adecuado, normalmente producen R−R' y el haluro de magnesio MgXX' como subproducto; y este último es insoluble en los disolventes que se utilizan normalmente. En este aspecto, son similares a los reactivos de organolitio.
Los reactivos de Grignard rara vez se aíslan como sólidos. En cambio, normalmente se manipulan como soluciones en solventes como éter dietílico o tetrahidrofurano utilizando técnicas sin aire. Los reactivos de Grignard son complejos con el átomo de magnesio unido a dos ligandos de éter, así como a los ligandos de haluro y organilo.
El descubrimiento de la reacción de Grignard en 1900 fue reconocido con el Premio Nobel otorgado a Victor Grignard en 1912.
Síntesis
De metal Mg
Tradicionalmente, los reactivos de Grignard se preparan tratando un haluro orgánico (normalmente organobromado) con magnesio metálico. Se requieren éteres para estabilizar el compuesto organomagnésico. Se excluyen el agua y el aire, que destruyen rápidamente el reactivo por protonólisis u oxidación. Aunque los reactivos deben seguir estando secos, el ultrasonido puede permitir que los reactivos de Grignard se formen en disolventes húmedos activando el magnesio de modo que consuma el agua.
Como es habitual en las reacciones que involucran sólidos y soluciones, la formación de reactivos de Grignard suele estar sujeta a un período de inducción. Durante esta etapa, se elimina el óxido pasivante del magnesio. Después de este período de inducción, las reacciones pueden ser altamente exotérmicas. Esta exotermicidad debe tenerse en cuenta cuando se amplía la escala de una reacción del laboratorio a la planta de producción. La mayoría de los organohaluros funcionarán, pero los enlaces carbono-flúor generalmente no son reactivos, excepto con magnesio especialmente activado (a través de metales de Rieke).
Magnesio
Normalmente, la reacción para formar reactivos de Grignard implica el uso de una cinta de magnesio. Todo el magnesio está recubierto con una capa pasivante de óxido de magnesio, que inhibe las reacciones con el haluro orgánico. Se han desarrollado muchos métodos para debilitar esta capa pasivante, exponiendo así el magnesio altamente reactivo al haluro orgánico. Los métodos mecánicos incluyen la trituración de los trozos de Mg in situ, la agitación rápida y la sonicación. El yodo, el yoduro de metilo y el 1,2-dibromoetano son agentes activadores comunes. El uso de 1,2-dibromoetano es ventajoso ya que su acción se puede controlar mediante la observación de burbujas de etileno. Además, los productos secundarios son inocuos:
- Mg + BrC2H4Br → C2H4 + MgBr2
La cantidad de Mg que consumen estos agentes activadores suele ser insignificante. Una pequeña cantidad de cloruro de mercurio amalgamará la superficie del metal, mejorando su reactividad. A menudo se utiliza la adición de reactivo de Grignard preformado como iniciador.
El magnesio activado de forma especial, como el magnesio de Rieke, evita este problema. La capa de óxido también se puede romper mediante ultrasonidos, raspando la capa oxidada con una varilla agitadora o añadiendo unas gotas de yodo o 1,2-diyodoetano. Otra opción es utilizar magnesio sublimado o antraceno de magnesio.
El "magnesio de Rieke" se prepara mediante la reducción de un cloruro de magnesio anhidro con un cloruro de potasio:- MgCl2 + 2 K → Mg + 2 KCl
Mecanismo
En términos del mecanismo, la reacción se produce mediante la transferencia de un solo electrón:
Reacción de transferencia de Mg (intercambio dehalógeno-Mg)
Una preparación alternativa de reactivos de Grignard implica la transferencia de Mg desde un reactivo de Grignard preformado a un haluro orgánico. También se utilizan otros reactivos organomagnésicos. Este método ofrece la ventaja de que la transferencia de Mg tolera muchos grupos funcionales. Una reacción ilustrativa implica cloruro de isopropilmagnesio y bromuro de arilo o yoduros:
- i-PrMgCl + ArCl → i-PrCl + ArMgCl
De compuestos alquilzincos (transmetalación reductiva)
Otro método para sintetizar reactivos de Grignard implica la reacción de Mg con un compuesto de organocinc. Este método se ha utilizado para fabricar reactivos de Grignard basados en adamantano, que, debido a las reacciones secundarias de acoplamiento C-C, son difíciles de fabricar mediante el método convencional a partir del haluro de alquilo y Mg. La transmetalación reductora logra:
- AdZnBr + Mg → AdMgBr + Zn
Pruebas Reactivos Grignard
Dado que los reactivos de Grignard son tan sensibles a la humedad y al oxígeno, se han desarrollado muchos métodos para comprobar la calidad de un lote. Las pruebas típicas implican titulaciones con reactivos próticos anhidros y que se pueden pesar, por ejemplo, mentol en presencia de un indicador de color. La interacción del reactivo de Grignard con fenantrolina o 2,2'-biquinolina provoca un cambio de color.
Reacciones de reactivos Grignard
Con compuestos de carbono

La aplicación más común de los reactivos de Grignard es la alquilación de aldehídos y cetonas, es decir, la reacción de Grignard:

Tenga en cuenta que el grupo funcional acetal (un carbonilo protegido) no reacciona.
Estas reacciones suelen implicar un tratamiento ácido acuoso, aunque este paso rara vez se muestra en los esquemas de reacción. En los casos en los que el reactivo de Grignard se añade a un aldehído o a una cetona proquiral, el modelo de Felkin-Anh o la regla de Cram suelen poder predecir qué estereoisómero se formará. Con 1,3-dicetonas fácilmente desprotonadas y sustratos ácidos relacionados, el reactivo de Grignard RMgX funciona simplemente como una base, dando el anión enolato y liberando el alcano RH.
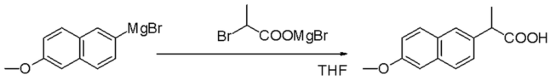
Los reactivos de Grignard son nucleófilos en sustituciones alifáticas nucleofílicas, por ejemplo, con haluros de alquilo, en un paso clave en la producción industrial de naproxeno:
Los reactivos de Grignard también reaccionan con muchos compuestos "similares al carbonilo" y otros electrófilos:

Reacciones como base
Los reactivos de Grignard sirven como base para sustratos no próticos (este esquema no muestra las condiciones de procesamiento, que normalmente incluyen agua). Los reactivos de Grignard son básicos y reaccionan con alcoholes, fenoles, etc. para dar alcóxidos (ROMgBr). El derivado de fenóxido es susceptible a la formilación por paraformaldehído para dar salicilaldehído.
Alquilamiento de metales y metaloides
Al igual que los compuestos de organolitio, los reactivos de Grignard son útiles para formar enlaces carbono-heteroátomo.
Los reactivos Grignard reaccionan con muchos electrofilos metálicos. Por ejemplo, pasan por transmetalación con cloruro de cadmio (CdCl2) para dar dialkylcadmium:
- 2 RMgX + CdCl2 → R2Cd + 2 Mg(X)Cl
Equilibrio Schlenk
La mayoría de las reacciones de Grignard se llevan a cabo en disolventes etéreos, especialmente éter dietílico y THF. Los reactivos de Grignard reaccionan con 1,4-dioxano para dar lugar a compuestos de diorganomagnesio y al polímero de coordinación insoluble MgX2(dioxano)2 y (R = grupo orgánico, X = haluro):
- 2 RMgX + dioxano ⇌ R2Mg + MgX2(dioxane)2
Esta reacción explota el equilibrio de Schlenk, llevándolo hacia la derecha.
Precursores a magnesiatos
Los reactivos de Grignard reaccionan con compuestos de organolitio para formar complejos de ato (Bu = butilo):
- BuMgBr + 3 BuLi → LiMgBu3 + BuBr
Coupling with organic halides
Los reactivos de Grignard no suelen reaccionar con haluros orgánicos, en contraste con su alta reactividad con otros haluros del grupo principal. Sin embargo, en presencia de catalizadores metálicos, los reactivos de Grignard participan en reacciones de acoplamiento C-C. Por ejemplo, el bromuro de nonilmagnesio reacciona con p-clorobenzoato de metilo para dar ácido p-nonilbenzoico, en presencia de tris(acetilacetonato)hierro(III) (Fe(acac)3), después de un tratamiento con NaOH para hidrolizar el éster, como se muestra a continuación. Sin el Fe(acac)3, el reactivo de Grignard atacaría al grupo éster sobre el haluro de arilo.
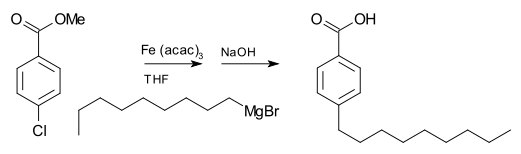
Para el acoplamiento de haluros de arilo con reactivos de Grignard de arilo, el cloruro de níquel en tetrahidrofurano (THF) también es un buen catalizador. Además, un catalizador eficaz para los acoplamientos de haluros de alquilo es el catalizador Gilman tetraclorocuprato de litio (Li2CuCl4), preparado mezclando cloruro de litio (LiCl) y cloruro de cobre(II) (CuCl2) en THF. El acoplamiento de Kumada-Corriu da acceso a estirenos [sustituidos].
Oxidación
El tratamiento de un reactivo de Grignard con oxígeno produce el organoperóxido de magnesio. La hidrólisis de este material produce hidroperóxidos o alcohol. Estas reacciones implican intermediarios radicales.
La oxidación simple de reactivos de Grignard para formar alcoholes tiene poca importancia práctica, ya que los rendimientos son generalmente bajos. En cambio, la secuencia de dos pasos mediante un borano (vide supra) que posteriormente se oxida al alcohol con peróxido de hidrógeno es de utilidad sintética.
La utilidad sintética de las oxidaciones de Grignard se puede aumentar mediante una reacción de reactivos de Grignard con oxígeno en presencia de un alqueno para formar un alcohol extendido con etileno. Esta modificación requiere reactivos de Grignard arílicos o vinílicos. Añadir sólo el reactivo de Grignard y el alqueno no da como resultado una reacción que demuestre que la presencia de oxígeno es esencial. El único inconveniente es el requisito de al menos dos equivalentes de Grignard, aunque esto se puede evitar en parte mediante el uso de un sistema dual de Grignard con un reactivo de Grignard reductor barato como el bromuro de n-butilmagnesio.

Eliminación
En la síntesis de olefinas de Boord, la adición de magnesio a ciertos β-haloéteres da como resultado una reacción de eliminación del alqueno. Esta reacción puede limitar la utilidad de las reacciones de Grignard.

Uso industrial
Un ejemplo de la reacción de Grignard es un paso clave en la producción industrial (no estereoselectiva) de tamoxifeno (actualmente utilizado para el tratamiento del cáncer de mama con receptores de estrógeno positivos en mujeres):

Véase también
- Dibutylmagnesium
- Base de Hauser
Galería
- Los giros de magnesio se colocan en un frasco.
- Tetrahidrofuran y un pequeño pedazo de yodo se añaden.
- Se añade una solución de bromuro de alquilo mientras se calienta.
- Después de completar la adición, la mezcla se calienta por un tiempo.
- La formación del reactivo Grignard está completa. Todavía queda una pequeña cantidad de magnesio en el frasco.
- El reactivo Grignard así preparado se enfría 0°C antes de la adición del compuesto de carbono. La solución se vuelve nublada mientras el reactivo Grignard se precipita.
- Una solución de compuesto de carbono se añade al reactivo Grignard.
- La solución se calienta a temperatura ambiente. En este punto la reacción está completa.
Referencias
- ^ Goebel, M. T.; Marvel, C. S. (1933). "La oxidación de los Reagentes Grignard". Journal of the American Chemical Society. 55 (4): 1693-1696. doi:10.1021/ja01331a065.
- ^ Smith, David H. (1999). "Grignard Reactions in "Wet" Ether". Journal of Chemical Education. 76 (10): 1427. Bibcode:1999JChEd.76.1427S. doi:10.1021/ed076p1427.
- ^ Philip E. Rakita (1996). "5. Prácticas de Manejo Seguro de Ragentes de Escala Industrial" (Google Books excerpt). En Gary S. Silverman; Philip E. Rakita (eds.). Handbook of Grignard reagents. CRC Press. pp. 79–88. ISBN 0-8247-9545-8.
- ^ Smith, David H. (1999). "Grignard Reactions in "Wet" Ether". Journal of Chemical Education. 76 (10): 1427. Bibcode:1999JChEd.76.1427S. doi:10.1021/ed076p1427.
- ^ Rieke, R. D. (1989). "Preparación de compuestos organometálicos de polvos metálicos altamente reactivas". Ciencia. 246 (4935): 1260-1264. Código: 1989Sci...246.1260R. doi:10.1126/ciencia.246.4935.1260. PMID 17832221. S2CID 92794.
- ^ Clayden, Jonathan; Greeves, Nick (2005). Química Orgánica. Oxford: Oxford Univ. Press. pp. 212. ISBN 978-0-19-850346-0.
- ^ Wakefield, Basil J. (1995). Organomagnesium Métodos en Química Orgánica. Academic Press. pp. 21–25. ISBN 0080538177.
- ^ Garst, J. F.; Ungvary, F. "Mechanism of Grignard reagent formation". In Grignard Reagents; Richey, R. S., Ed.; John Wiley ' Sons: New York, 2000; pp 185–275. ISBN 0-471-99908-3.
- ^ Química Orgánica Avanzada Parte B: Reacciones y síntesis F.A. Carey, R.J. Sundberg 2nd Ed. 1983. Page 435
- ^ Garst, J.F.; Soriaga, M.P. "Formación de reactivos de Garst", Coord. Chem. Rev. 2004, 248, 623 - 652. doi:10.1016/j.ccr.2004.02.018.
- ^ Arredondo, Juan D.; Li, Hongmei; Balsells, Jaume (2012). "Preparación de t-Butyl-3-Bromo-5-Formylbenzoate a través de reacciones selectivas de intercambio de Metal-Halogen". Sintetías orgánicas. 89: 460. doi:10.15227/orgsyn.089.0460.
- ^ Knochel, P.; Dohle, W.; Gommermann, N.; Kneisel, F.; Kopp, F.; Korn, T.; Sapountzis, I.; Vu, V. A. (2003). "Highly Functionalized Organomagnesium Reagents Prepared through Halogen-Metal Exchange". Angewandte Chemie International Edition. 42 (36): 4302–4320. doi:10.1002/anie.200300579. PMID 14502700.
- ^ Armstrong, D.; Taullaj, F.; Singh, K.; Mirabi, B.; Lough, A. J.; Fekl, U. (2017). "Adamantyl Metal Complexes: New Routes to Adamantyl Anions and New Transmetallations". Transacciones de Dalton. 46 (19): 6212–6217. doi:10.1039/C7DT00428A. PMID 28443859.
- ^ Krasovskiy, Arkady; Knochel, Paul (2006). "Método de Titration Conveniente para Zinc Organometallic, Harshal ady Magnesium, y Reagents Lanthanide". Síntesis. 2006 (5): 890-891. doi:10.1055/s-2006-926345.
- ^ Henry Gilman y R. H. Kirby (1941). "Acido butírico, α-metil-". Sintetías orgánicas; Volumenes recogidos, vol. 1, pág. 361.
- ^ Haugan, Jarle André; Songe, Pål; Rømming, Christian; Rise, Frode; Hartshorn, Michael P.; Merchán, Manuela; Robinson, Ward T.; Roos, Björn O.; Vallance, Claire; Wood, Bryan R. (1997). "Sintesis total de C31-Metil Ketone Apocarotenoides 2: La primera síntesis total de (3R)-Triophaxanthin" (PDF). Acta Chemica Escandinavica. 51: 1096–1103. doi:10.3891/acta.chem.scand.51-1096. Retrieved 26 de noviembre, 2009.
- ^ Peters, D. G.; Ji, C. (2006). "Una síntesis multipaso para un laboratorio de química orgánica de grado avanzado". Journal of Chemical Education. 83 (2): 290. Bibcode:2006JChEd..83..290P. doi:10.1021/ed083p290.
- ^ "Unit 12 Aldehydes, Ketones y Ácidos Carboxílicos" (PDF). Libro de texto de la Parte II para la clase XII. Vol. 2. India: National Council of Educational Research and Training. 2010. p. 355. ISBN 978-81-7450-716-7. Archivado desde el original (PDF) el 20 de septiembre de 2018. Retrieved 9 de marzo 2019.
- ^ Arredondo, Juan D.; Li, Hongmei; Balsells, Jaume (2012). "Preparación de t-Butyl-3-Bromo-5-Formylbenzoate a través de reacciones selectivas de intercambio de Metal-Halogen". Sintetías orgánicas. 89: 460. doi:10.15227/orgsyn.089.0460.
- ^ A. Fürstner, A. Leitner, G. Seidel (2004). "4-Nonylbenzoic Acid". Sintetías orgánicas. 81: 33-42
{{cite journal}}: CS1 maint: múltiples nombres: lista de autores (link). - ^ Youhei Nobe; Kyohei Arayama; Hirokazu Urabe (2005). "Anexión de Reagentes Grignard a Olefins. Un protocolo simple para un proceso de coupulación de tres componentes de alcoholismo". J. Am. Chem. Soc. 127 (51): 18006–18007. doi:10.1021/ja055732b. PMID 16366543.
- ^ Richey, Herman Glenn (2000). Grignard Reagents: Nuevos desarrollos. Wiley. ISBN 0471999083.
- ^ Jordania VC (1993). "Fourteenth Gaddum Memorial Lecture. Vista actual del tamoxifeno para el tratamiento y prevención del cáncer de mama". Br J Pharmacol. 110 (2): 507–17. doi:10.1111/j.1476-5381.1993.tb13840.x. PMC 2175926. PMID 8242225.
Más lectura
- Rakita, Philip E.; Silverman, Gary S., eds. (1996). Handbook of Grignard Reagents. Nueva York, N.Y: Marcel Dekker. ISBN 0-8247-9545-8.
- Mary McHale, "Grignard Reaction", Connexions, http://cnx.org/content/m15245/1.2/. 2007.
- Conocimiento de Grignard: Química de acoplamiento de Alkyl con metales de transición baratos por Larry J. Westrum, Fine Chemistry Noviembre/diciembre de 2002, págs. 10 a 13 [1]
Literatura especializada
- Rogers, H. R.; Hill, C. L.; Fujiwara, Y.; Rogers, R. J.; Mitchell, H. L.; Whitesides, G. M. (1980). "Mecanismo de formación de reactivos Grignard. Kinetics of reaction of alkyl halides in diethyl ether with magnesium". Journal of the American Chemical Society. 102 (1): 217. doi:10.1021/ja00521a034.
- De Boer, H.J.R.; Akkerman, O.S; Bickelhaupt, F. (1988). "Carbaniones como intermediarios en la síntesis de Reagentes Grignard". Angew. Chem. Int.. 27 (5): 687–89. doi:10.1002/anie.198806871.
- Van Klink, G.P.M.; de Boer, H.J.R; Schat, G.; Akkerman, O.S.; Bickelhaupt, F.; Spek, A. (2002). "Carbanions as Intermediates in the Formation of Grignard Reagents". Organometallics. 21 (10): 2119–35. doi:10.1021/om011083a. hdl:1874/14334. S2CID 94556915.
- Shao, Y.; Liu, Z.; Huang, P.; Liu, B. (2018). "Un modelo unificado de formación reactivo Grignard". Física Química Física Química Física Química. 20 (16): 11100–08. Código:2018PCCP...2011100S. doi:10.1039/c8cp01031e. PMID 29620768.
![{\displaystyle {\begin{aligned}{\ce {R-X{}+Mg}}&\longrightarrow {\ce {[R-X^{\bullet }]^{-}{}+[Mg^{\bullet }]+}}\\{\ce {[R-X^{\bullet }]-}}&\longrightarrow {\ce {R^{\bullet }{}+X-}}\\{\ce {R^{\bullet }{}+[Mg^{\bullet }]+}}&\longrightarrow {\ce {R-Mg+}}\\{\ce {R-Mg+{}+X-}}&\longrightarrow {\ce {R-MgX}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e5ad1a3f77639428eb795568fed4835951e25400)
![Reactions of Grignard reagents with non carbon electrophiles {\displaystyle {\begin{matrix}{\ce {R4B-}}\\{\color {White}\scriptstyle {\ce {Et2O.BF3\ or\ NaBF4}}}{\Bigg \uparrow }\scriptstyle {\ce {Et2O.BF3\ or\ NaBF4}}\\{\ce {Ph2PR<-[{\ce {Ph2PCl}}]RMgX->[{\ce {Bu3SnCl}}]Bu3SnR}}\\{\color {White}\scriptstyle {\ce {B(OMe)3}}}{\Bigg \downarrow }\scriptstyle {\ce {B(OMe)3}}\\{\ce {RB(OMe)2}}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e437b60e37160b69a20e287dba0820ae949a6a4d)
![Grignard oxygen oxidation pathways {\displaystyle {\begin{array}{lcrll}{\ce {{R-MgX}+O2->}}\ {\color {Red}{\ce {{R^{\bullet }}+[O2^{\bullet }]-}}}+{\ce {MgX+->}}&{\ce {R-O-O-MgX}}&{\color {Gray}+\ {\ce {H3O+}}}&{\ce {->{R-O-O-H}}}&{\color {Gray}+\ {\ce {{HO-MgX}+H+}}}\\&{\Bigg \downarrow }{\ce {R-MgX}}\\&{\ce {R-O-MgX}}&{\color {Gray}+\ {\ce {H3O+}}}&{\ce {->{R-O-H}}}&{\color {Gray}+\ {\ce {{HO-MgX}+H+}}}\\\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/137122d243bd686bf1055500358b585b758a0c54)







