Reacción exergónica
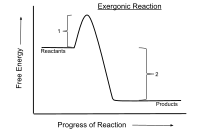
En termodinámica química, una reacción exergónica es una reacción química donde el cambio en la energía libre es negativo (hay una liberación neta de energía libre). Esto indica una reacción espontánea si el sistema está cerrado y las temperaturas inicial y final son las mismas. Para procesos que tienen lugar en un sistema cerrado a presión y temperatura constantes, se utiliza la energía libre de Gibbs, mientras que la energía de Helmholtz es relevante para procesos que tienen lugar a volumen y temperatura constantes. Cualquier reacción que ocurra a temperatura constante sin aporte de energía eléctrica o fotónica es exergónica, según la segunda ley de la termodinámica. Un ejemplo es la respiración celular.
Simbólicamente, la liberación de energía libre, , en una reacción exergónica (a presión constante y temperatura) se denota como
Aunque se dice que las reacciones exergónicas ocurren espontáneamente, esto no implica que la reacción tendrá lugar a una velocidad observable. Por ejemplo, la desproporción del peróxido de hidrógeno libera energía libre pero es muy lenta en ausencia de un catalizador adecuado. Se ha sugerido que ansioso sería un término más intuitivo en este contexto.
De manera más general, los términos exergónico y endergónico se relacionan con el cambio de energía libre en cualquier proceso, no solo en reacciones químicas. Por el contrario, los términos exotérmico y endotérmico se relacionan con un cambio de entalpía en un sistema cerrado durante un proceso, generalmente asociado con el intercambio de calor.

